Optimierbar - die Langzeiteinnahme antihormoneller Therapien
Die Antihormontherapie oder endokrine Therapie ist neben Operation, Bestrahlung und Chemotherapie ein wesentlicher Eckpfeiler der Krebstherapie des Mammakarzinoms. Circa 66% aller Mammakarzinome sind hormonsensitiv. Hormone, vor allem Östrogene und Progesterone, haben einen proliferativen Effekt auf Tumorzellen, indem sie an die Hormonrezeptoren binden und die Tumorzellteilung induzieren. Prämenopausal wird der Großteil des Östrogens in den Ovarien, postmenopausal vorwiegend adrenal, im Muskel und im Fettgewebe produziert. 25% aller Mammakarzinome werden bei prämenopausalen Patientinnen diagnostiziert. Die 5-Jahres- Überlebensrate beträgt bei Patientinnen unter 40 Jahren 80% und bei jenen über 40 Jahren 89% (Gnant et al., Breast Cancer Online 2009).
Die endokrine Therapie wird in 3 große Wirkstoffgruppen abhängig vom Wirkmechanismus unterteilt: Antiöstrogene, LHRH-Antagonisten und Aromatasehemmer (Tab.).
Die Auswahl des Therapeutikums richtet sich nach Menopausenstatus, Komorbiditäten und Verträglichkeit. Durch eine gezielte Antihormontherapie lässt sich bei hormonsensitiven Mammakarzinomen das Tumorwachstum aufhalten bzw. stark reduzieren und eine Ausbreitung im Körper inhibieren. Im Unterschied zur chirurgischen und strahlentherapeutischen Therapie wirkt die endokrine Therapie ähnlich der Chemotherapie im gesamten Körper. Im Gegensatz zur Chemotherapie zielt die endokrine Therapie nicht auf hormonunabhängige Zellen ab, zeigt somit ein weniger aggressives Nebenwirkungsprofil und wird auch über längere Zeiträume verabreicht.
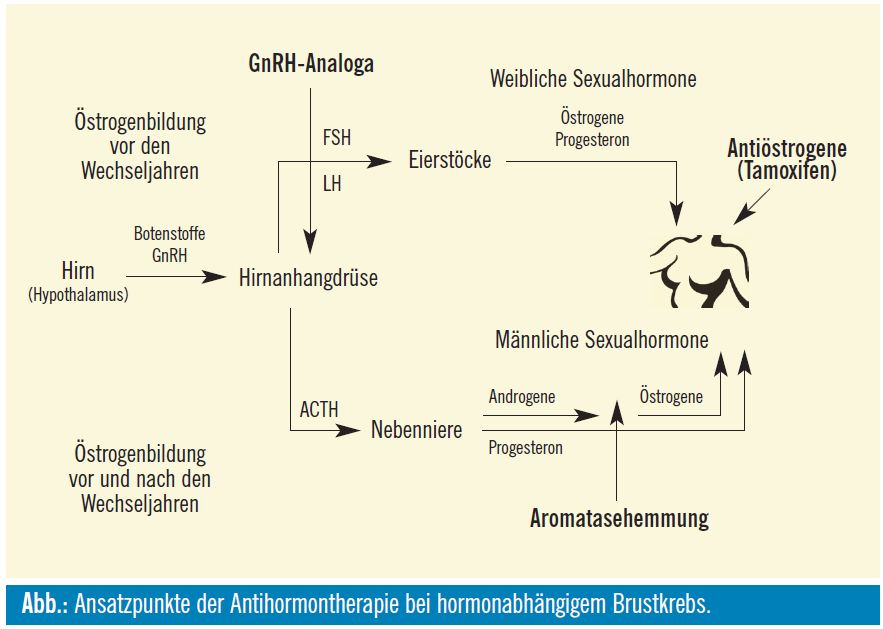
Ziel der endokrinen Therapie ist eine Proliferationshemmung auf die Karzinomzellen. Es werden Hormonrezeptoren blockiert (selektive Östrogen-Rezeptor-Modulatoren [SERM], reine Antiöstrogene), es wird die Umwandlung von Androgenen zu Östrogen gehemmt (Aromatasehemmer) oder die Östrogenbildung über Releasinghormone reduziert (LHRHAnaloga). (Abb.)
| Tab.: Infobox Antihormone | ||||
|---|---|---|---|---|
|
Wirkstoff |
Wirkstoff-gruppe |
Dosis |
Häufigkeit |
Neben- |
|
Anastrozol |
Aromatase Inhibitor |
1 mg |
1-mal täglich per os |
trockene Scheide, Haarausfall, Kopfschmerz, |
|
Letrozol |
Aromatase Inhibitor |
2,5 mg |
1-mal täglich per os |
erhöhtes Frakturrisiko, Thrombosen, Hot Flashes, sexuelle Dysfunktion |
|
Exemestan |
Aromatase Inhibitor |
25 mg |
1-mal täglich per os |
trockene Scheide, Haarausfall, Kopfschmerz, Frakturrisiko, Hot Flashes, sexuelle Dysfunktion |
|
Tamoxifen (Nolvadex®) |
Antiöstrogen SERM |
20 mg |
1-mal täglich per os |
Thromboembolien, Endometrium-hyperplasie |
|
Fulvestrant |
Reines Antiöstrogen |
500 mg |
alle 30 Tage intramuskulär |
Thromboembolien, Hitzewallungen |
|
Goserelin |
LHRH-Analogon |
3,6 mg |
alle 30 Tage subkutan |
trockene Scheide, Kopfschmerz, Hitzewallungen |
| 10,8 mg | alle 3 Monate | |||
Nebenwirkungsprofil der Antihormone
Östrogene steuern zahlreiche essenzielle Körperfunktionen, somit bewirkt eine Hemmung eine Vielzahl von Nebenwirkungen, welche klimakterischen Beschwerden entsprechen.
Hitzewallungen: Prinzipiell sollte bei Auftreten von Hitzewallungen der Hormonstatus bestimmt und auch andere Faktoren und Noxen medizinisch ausgeschlossen werden, bevor man die endokrine Therapie verantwortlich macht. Lifestyle-Änderungen gewinnen zunehmend an Bedeutung und finden inzwischen Eingang in das westlich medizinische Weltbild. Regelmäßige sportliche Aktivität, Bewegungstherapie gekoppelt mit Entspannungsmethoden wie Qigong und Yoga, energetische Massagetechniken wie Shiatsu, Akupunktur und das psychische Wohlbefinden durch Psychotherapie und autogenes Training fassen nicht nur in zahlreichen Internetforen und Selbsthilfegruppen Fuß. Als wesentlicher Faktor sollte auch die richtige Ernährung z.B. nach dem 5-Elemente-Prinzip der traditionellen chinesischen Medizin in Betracht gezogen werden. Kaffee, Schwarztee, scharfe Zutaten und allgemein das Übergewicht wirken sich verstärkend auf Hitzesensationen der Patientinnen aus.
Als Ultima Ratio bieten sich Medikamente wie Neuroleptika und Blutdrucksenker an. Hierbei sollte man jedoch die Nebeneffekte und Wechselwirkung mit der endokrinen Therapie nicht außer Acht lassen.
Reizbarkeit, Depression: Zu den Wechselbeschwerden gesellen sich häufig auch Depression, Verstimmungen und Gereiztheit. Auch in diesem Fall soll zuerst eine medizinische Differenzialdiagnostik klären, ob die Antihormontherapie die Ursache ist. Die therapeutischen Möglichkeiten erstrecken sich ähnlich den Hitzewallungen auf ein breites Aktionsfeld mit speziellem Schwerpunkt auf antidepressive Medikation.
Gelenksprobleme, Osteopenie, Osteoporose: Der Knochenstoffwechsel und die Gelenke stehen in enger Verbindung zum Hormonhaushalt. Als Folge der Senkung des Östrogenspiegels vor allem durch Aromatasehemmer können Gelenks- und Knochenschmerzen auftreten und die Knochendichte abnehmen. Vermehrte Knochenbrüche, Osteoporose und körperliche Immobilität verschlechtern die Lebensqualität der Patientinnen massiv.
Analgetika wie nichtsteroidale Antirheumatika können Abhilfe schaffen, in Einzelfällen muss die endokrine Therapie bei therapieresistenten Schmerzen jedoch vorzeitig abgebrochen werden. Bei Knochendichteverlust ist die Einnahme von Kalzium, Vitamin D und in schweren Fällen Biphosphonaten zu erwägen. Der neue Antikörper Denosumab, der die Osteoklastenaktivität herabreguliert, wird momentan im adjuvanten Setting in Rahmen der prospektiv randomisierten placebokontrollierten Studie ABCSG-18 als Knochenschutz bei Aromatasehemmertherapie gepüft. Sportliche Aktivitäten wie Gymnastik, Walken, Schwimmen und Radfahren sind für den Knochenaufbau zielführend.
Weitere Nebenwirkungen: Thromboembolien, Schlaganfälle, Endometrium – hyperplasie und Uteruskarzinom sind schwerwiegende Nebenwirkungen von Antiöstrogenen und bedingen ein Therapieswitching. Alopezie, trockene Schleimhäute, Kopfschmerzen und Libidoverlust treten gehäuft bei Aromatasehemmern und LHRH-Analoga auf. Medizinische Differenzialdiagnostik, kausale und supportive Maßnahmen sind von ärztlicher Seite zu ergreifen.
Indikationsspektrum endokriner Therapien
Aromataseinhibitoren
Aromataseinhibitoren (AI) blockieren das Enzym Aromatase und verhindern, dass Hormonvorstufen in Östrogen umgewandelt werden können. Fett- und Muskelgewebe werden als Hauptproduktionsstätte von Östrogen im postmenopausalen Status somit gehemmt. Bei perimenopausalen Patientinnen empfiehlt sich deshalb eine exakte Hormonspiegelbestimmung. AI werden regelhaft im adjuvanten Setting bei postmenopausalen Patientinnen eingesetzt. In der Studie ABCSG-6a konnte bei 856 Patientinnen gezeigt werden, dass das Rezidivrisiko nach 5 Jahren Tamoxifen bei anschließender AITherapie im Vergleich zu keiner Folgetherapie im 5-Jahres-Follow-up signifikant (p = 0,03) gesenkt werden konnte (Jakesz et al., J Natl Cancer Inst, 2007). Zusätzlich lassen sich AI gut mit Strahlentherapie, Chemotherapie und Trastuzumab kombinieren.
Im palliativen Setting können AI eine Tumorreduktion und Verlangsamung des Tumorwachstums bewirken. Sie können sowohl in der Second-Line- als auch Third-Line-Therapie zum Einsatz kommen. In einer Metaanalyse mit über 8.500 Patientinnen mit fortgeschrittenem Mammakarzinom konnte ein Überlebensvorteil von AI (Letrozol, Exemestan, Anastrozol) im Vergleich mit Tamoxifen nachgewiesen werden (p = 0,03) (Mauri et al., J Natl Cancer Inst 2006). Im direkten Vergleich mit Tamoxifen traten bei AI deutlich weniger schwerwiegende Nebenwirkungen und Therapieabbrüche auf und somit waren AI bei geringerer Rezidivrate und einem besseren Überleben insgesamt besser verträglich.
Anastrozol: Anastrozol kann sowohl als Upfront-Therapie eingesetzt werden als auch, wie die Studie ABCSG-8 bestätigt, als Sequenztherapie nach 2 Jahren Tamoxifentherapie. In der Sequenztherapie kam es im Unterschied zu 5 Jahren Tamoxifen zu einer Risikoreduktion des rezidivfreien Überlebens (DFS: disease free survival) um 11% und der Letalität um 18% (Jakesz et al., Lancet 2005).
Letrozol: Die BIG-1-98-Studie konnte an über 8000 postmenopausalen Patientinnen ein signifikant verbessertes DFS bei adjuvanter Letrozoleinnahme verglichen mit Tamoxifen nach 51 Monaten nachweisen (p = 0,007) (Coates et al., J Clin Oncol 2005). Eine neoadjuvante Therapie mit Letrozol sollte über mindestens 6 Monate andauern (Domont et al., Breast Cancer Res Treat 2004).
Exemestan: Die prospektiv randomisierte EFECT-Studie verglich bei 693 Patientinnen mit progredientem Mammakarzinom Exemestan mit Fulvestrant nach Rezidiv unter AI-Therapie. DFS (p = 0,65) und die klinische Benefitrate (p = 0,85) waren ähnlich (Chia et al., J Clin Oncol 2008). Neben- und Wechselwirkungsprofile entsprechen größtenteils den anderen AI, wobei Exemestan die geringste Nebenwirkungsausprägung aufweist. Erhöhte Blutfettwerte können einhergehen.
Antiöstrogene
Antiöstrogene binden an den Östrogenrezeptor, so können keine Botenstoffe mehr die Zellteilung induzieren. Eine Rest-Rezeptorwirkung bleibt erhalten. Reine Antiöstrogene binden nicht nur an den Östrogenrezeptor, sondern beschleunigen den Abbau der Rezeptoren durch Unterbindung der Dimerisierung zweier Rezeptoren. Reine Antiöstrogene werden monatlich intramuskulär mit Depotwirkung verabreicht
Tamoxifen: Tamoxifen ist ein selektiver Östrogen-Rezeptor-Modulator (SERM), der Östrogenrezeptoren hemmt und Progesteronrezeptoren stimuliert. Er ist ein Partialagonist mit einer leichten Östrogenwirkung und einem gleichzeitigen kompetitiven Östrogenantagonismus. Tamoxifen findet sowohl im adjuvanten als auch palliativen Setting seine Anwendung. Im Rahmen einer Metaanalyse an über 33.000 Patientinnen mit hormonsensitivem Mammakarzinom konnte durch Tamoxifengabe eine jährliche Letalitätsreduktion von 31% erzielt werden. Im 5-Jahres-Follow-up konnten krankheitsfreies Überleben (DFS) und Gesamtüberleben (OS) signifikant verbessert werden (p < 0,00001) und die 15-Jahres-Letalität um 50% reduziert werden. Unerfreulicherweise stieg die Rate an Schlaganfällen (p = 0,07) und Uteruskarzinomen (p < 0,00001) in der Tamoxifengruppe an (EBCSG, Lancet 2005). Die Studie ABCSG-5 zeigte bei über 1000 prämenopausalen Patientinnen bei 6 Zyklen CMF verglichen mit 3 Jahren Tamoxifen plus Goserelin und zusätzlichen 2 Jahren Tamoxifen nach einem 5-Jahres-Follow-up eine signifikante Steigerung des DFS in der endokrinen Therapiegruppe (p = 0,008) (Jakesz et al., J Clin Oncol 2002).
Fulvestrant: Als Hauptindikation für Fulvestrant gelten das lokal fortgeschrittene hormonsensitive Mammakarzinom bei postmenopausalen Patientinnen, das metastasierte Mammakarzinom, das Rezidivkarzinom während oder nach adjuvanter Antihormontherapie sowie die Tumorprogression unter endokriner Therapie. Die CONFIRM-Studie zeigte bei 736 postmenopausalen Patientinnen mit progredientem oder rezidivierendem Mammakarzinom nach Tamoxifen und AI-Therapie eine Progressionsrisikominderung um 20% (p = 0,006) bei Verdopplung der Standardtherapie von 250 mg auf 500 mg Fulvestrant bei gleich guter Verträglichkeit (Di Leo et al., J Clin Oncol 2010).
LHRH-Analoga
Die Östrogenbildung vor der Menopause erfolgt hauptsächlich über die Ovarien. Die Ovarien werden wiederum über Hormone des Hypothalamus (Gonadoliberin oder luteinisierendes Hormon Releasing-Hormon = LHRH) gesteuert. LHRH-Analoga verhindern durch kontinuierliche Stimulation der Hypophyse (eine pulsatile Ausschüttung ist stimulierend) die Ausschüttung von luteinisierendem Hormon (LH), hemmen die Follikelreifung und somit auch die Östrogenproduktion (chemische Kastration) (Emens et al., Clin Cancer Res 2003). In einer Metaanlayse mit über 2200 Patientinnen zeigte die ovarielle Ablation ein um 25% verbessertes DFS gegenüber 10% im Chemotherapiearm (p = 0,0005) (EBCTCG, Lancet 1996). Im Unterschied dazu konnte bei über 1.300 perimenopausalen Patientinnen weder eine Steigerung des DFS noch des OS nachgewiesen werden (EBCTCG, Cochrane Database Syst Rev 2000). LHRH-Analoga werden standardmäßig mit Antiöstrogenen zur kompletten Östrogenblockade bei prämenopausalen Patientinnen kombiniert, entsprechend der Studie ABCSG 12 (Gnant et al., New Engl J Med 2009).
Goserelin: Nach 14 bis 21 Tagen kontinuierlicher LH-Stimulation mit Goserelin kommt es zu einer Downregulation der Sexualhormone auf Kastrationsniveau (Boccardo et al., Ann Oncol 1994).
Die ZEBRA-Studie konnte bei über 1600 prämenopausalen nodalpositiven Patientinnen keinen Unterschied zwischen Goserelin 3,6 mg versus 6 Zyklen CMF (Cyclophosphamid, Methotrexat, Fluorouracil) im DFS und OS nach medianem Follow-up von 6 Jahren nachweisen (Jonat W et al., J Clin Oncol 2002).
Eine Metaanalyse mit über 11.900 prämenopausalen Patientinnen konnte zeigen, dass durch Kombination von Goserelin mit Tamoxifen als auch mit Chemotherapie das DFS (13% Verbesserung, p = 0,02) und die rezidivbedingte Letalität (15% Reduktion, p = 0,03) signifikant verändert werden (Cuzick et al., Lancet 2007).
Compliance
Die Compliance, definiert als korrekte Einnahme von Medikamenten gemäß der Verordnung durch den Therapeuten, ist ein nicht zu unterschätzender Faktor für den Therapieerfolg. Bei Eingabe der Schlagworte: Compliance, Endocrine therapy, Breast cancer finden sich in der PubMed (US National Library of Medicine National Institutes of Health) 71 Studien und signalisieren die zunehmende Wichtigkeit dieses Themas.
In der NSABP-P1-Studie wurden bei über 11.000 Patientinnen mit Tamoxifen versus Placebo Lebensqualitäts- und Depressionsfragebögen evaluiert. Dabei fiel auf, dass die Compliance nach 36 Monaten stark abnahm und zwar in beiden Studienarmen (Day et al., J Clin Oncol 1999). In der IBIS-I-Studie wurde bei über 7.100 Patientinnen mit erhöhtem Mammakarzinomrisikoplacebokontrolliert Tamoxifen 20 mg über 5 Jahre verabreicht. In dieser Zeit wurden 36% der Patientinnen im Tamoxifen-Arm und 26% im Placebo-Arm incompliant (Cuzick et al., Lancet 2002).
Über 12.000 Patientinnen mit Mammakarzinom unter adjuvanter Anastrozoltherapie wurden über 3 Jahre auf ihre Einnahmetreue überprüft. Nach den ersten 12 Monaten nahmen noch 78 bis 86%, nach 36 Monaten nur noch 62 bis 79% der Patientinnen die AI regelmäßig ein (Partridge AH et al., J Clin Oncol 2008).
Eine deutsche Studie untersuchte 100 postmenopausale Frauen mit adjuvanter endokriner Therapie (je 50% Anastrozol und Tamoxifen). Alle Patientinnen gaben eine konsequente Medikamenteneinnahme zu Protokoll. Bei objektiver Überprüfung der Anzahl der Verschreibungen über den Einnahmezeitraum ergaben sich jedoch erhebliche Diskrepanzen zu den subjektiven Patientenangaben. So waren nur 80% in der Tamoxifengruppe und 69% in der Anastrozolgruppe einnahmetreu (jeweils p < 0,01 im Vergleich mit den subjektiven Angaben) (Ziller et al., Ann Oncol 2009).
Im Rahmen eines Cochrane Database Systematic Reviews wurden 9 prospektiv randomisierte Studien mit kurzfristiger Therapie und 69 prospektiv randomisierte Studien mit Langzeittherapien untersucht. Verstärkte ärztliche Zuwendung, Informationsmaterial, regelmäßige Erinnerungsanrufe, verstärktes Selbstmonitoring, Familientherapie, Psychotherapie, Krisenintervention und telefonische Follow-up-Anrufe wurden als Interventionsmaßnahmen evaluiert. In 9 Studien mit kurzfristigen Therapien zeigten durchschnittlich 4 von 10 Interventionsmaßnahmen einen Effekt auf die Therapietreue und letztendlich auch auf das klinische Ergebnis. Bei Studien mit langer Therapiedauer zeigten 36 von 81 Interventionsmaßnahmen eine verbesserte Compliance, jedoch konnte nur bei 25 Interventionen auch eine Verbesserung des klinischen Outcomes nachgewiesen werden. Insgesamt war der Effekt von Interventionsmaßnahmen auf die Compliance bei Langzeittherapie nicht überzeugend (Haynes et al., Cochrane Database Syst Rev 2008).
Fact-Box
Antihormone werden in drei große Wirkstoffgruppen unterteilt:
-
Aromatasehemmer unterbinden vor allem bei postmenopausalen Patientinnen die Östrogenproduktion und haben Osteoporose als schwerwiegende Nebenwirkung.
-
Antiöstrogene blockieren im prä- und postmenopausalen Setting die Östrogenrezeptoren der Tumorzellen und wirken antiproliferativ. Endometriumhyperplasie und erhöhte Thrombose- und Emboliegefahr sind Indikationen für einen Therapiewechsel.
-
LHRH-Analoga bewirken durch Downregulierung der Sexualhormone eine chemische Kastration bei prämenopausalen Patientinnen. Die klassischen Wechselbeschwerden können einen erheblichen Einfluss auf die Einnahmetreue haben.
Lifestyle-Änderung, Einsatz komplementärer Medizin, Stressreduktion, Bewegungstherapie, psychologische Betreuung und Ernährungsumstellung können die Lebensqualität unter Antihormontherapie steigern. Bei schwerwiegenden Problemen bietet sich als Ultima Ratio die medikamentöse Therapie (z.B. Antidepressiva, Neuroleptika, Blutdrucksenker) an.
Die Einnahmetreue bei Langzeittherapie ist laut aktueller Studienlage bei 64% bis 84% anzusiedeln, trotz multipler Interventionsstrategien.
Literatur beim Verfasser