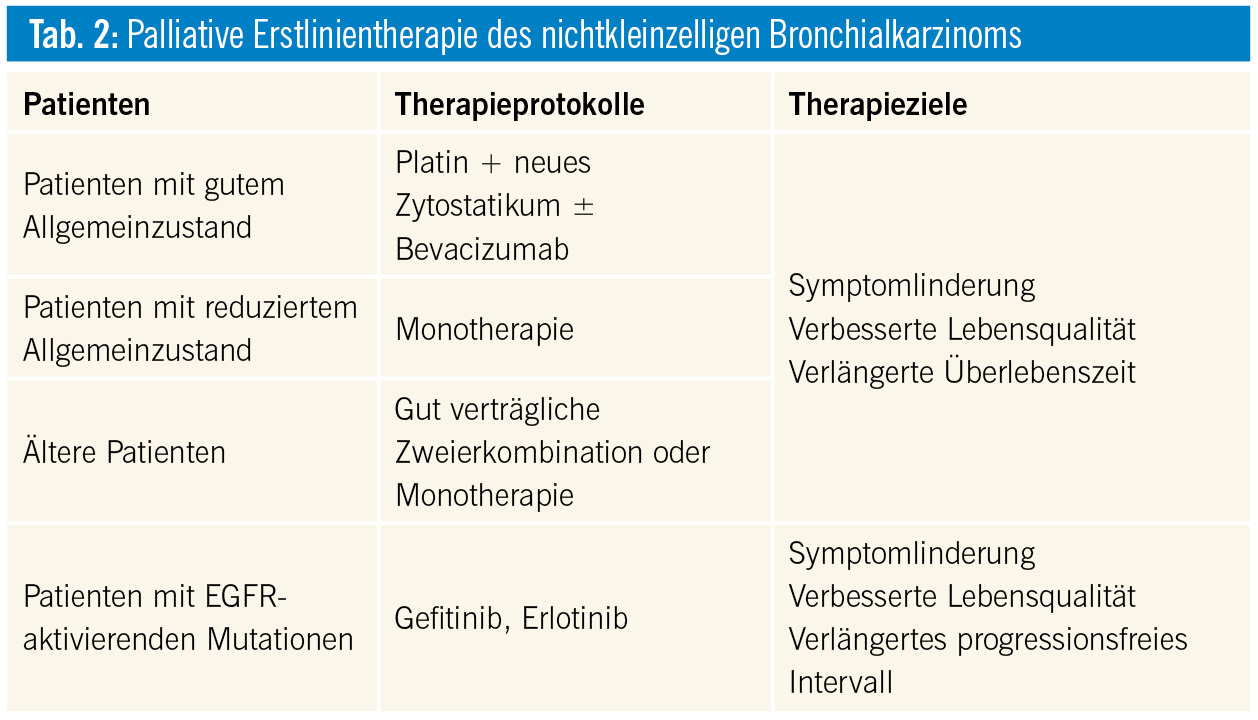
Kontext: Die palliative Erstlinienchemotherapie bei Patienten mit fortgeschrittenen nichtkleinzelligen Bronchialkarzinomen erfolgt mit einem Platin (Cisplatin, Carboplatin) in Kombination mit einem Zytostatikum der 3. Generation1, 2 (Tab. 1). Diese Zweierkombinationen lindern die tumorbedingten Symptome und verlängern das Überleben der Patienten, wobei die mediane Überlebenszeit um etwa 2 Monate verlängert und die 1-Jahres-Überlebensrate um 10 % gesteigert werden1. Die Auswahl des Therapieprotokolls berücksichtigt Allgemeinzustand, Alter, Organfunktion, Verträglichkeit und Patientenpräferenz (Tab. 2). Patienten mit gutem Allgemeinzustand und adäquater Nierenfunktion (Kreatinin-Clearance > 60 ml/min) erhalten bevorzugt eine cisplatinhältige Zweierkombination. Die Cisplatindosis beträgt 80 mg/m2 alle 3 Wochen, und die Carboplatindosis liegt im Bereich von AUC 4–6 alle 3 Wochen. Bei nichtsquamöser Histologie ist Pemetrexed wirksamer als Gemcitabin und bei Plattenepithelkarzinomen ist Gemcitabin wirksamer als Pemetrexed. Patienten älter als 70 Jahre erhalten eine Monotherapie oder eine gut verträgliche Zweierkombination (z. B. Carboplatin plus Paclitaxel), wobei die supportiven Therapien verstärkt werden müssen und die klinischen Kontrollen häufiger durchgeführt werden sollten. Standardmäßig werden 4–6 Chemotherapiezyklen verabreicht, wobei Patienten mit lediglich stabiler Erkrankung unter Chemotherapie nur 4 Zyklen erhalten. Die Überwachung bezüglich der Wirkung der Chemotherapie erfolgt sowohl klinisch als auch mittels regelmäßiger radiologischer Kontrollen.
Erstlinienchemotherapie plus zielgerichtete Therapie
Chemotherapie plus Bevacizumab
Bevacizumab plus Chemotherapie war in 2 randomisierten Studien bei Patienten mit nichtsquamöser Histologie eines fortgeschrittenen nichtkleinzelligen Bronchialkarzinoms der alleinigen Chemotherapie überlegen3, 4. In der ECOG-Studie führte Bevacizumab (15 mg/kg Körpergewicht intravenös alle 3 Wochen) in Kombination mit Carboplatin plus Paclitaxel zu einer Verbesserung des Überlebens (median 12 versus 10 Monate) und des progressionsfreien Überlebens3. In der AVAiL-Studie war das progressionsfreie Überleben durch die Kombination von Bevacizumab (7,5 oder 15 mg/kg alle 3 Wochen) mit Cisplatin plus Gemcitabin im Vergleich zur alleinigen Chemotherapie verlängert4. Bevacizumab ist deshalb in Kombination mit platinhältiger Chemotherapie zur Behandlung von Patienten mit nichtsquamöser Histologie eines nichtkleinzelligen Bronchialkarzinoms zugelassen, wobei auf eventuell bestehende Kontraindikationen (Blutungs- oder Thromboseneigung, Gefäßinvasion, Nahebeziehung des Tumors zu großen Gefäßen) zu achten ist. Bevacizumab wird bis zur Progression oder inakzeptablen Toxizität verabreicht.
VEGFR-gerichtete Tyrosinkinaseinhibitoren in Kombination mit Erstlinienchemotherapie führten bisher zu keiner Verbesserung der Therapieergebnisse im Vergleich zur alleinigen Chemotherapie.

Chemotherapie plus Cetuximab
Cetuximab wurde bisher in zwei Phase-III-Studien untersucht5, 6. In der FLEX-Studie bewirkte Cetuximab in Kombination mit Cisplatin plus Vinorelbin im Vergleich zur alleinigen Chemotherapie eine Verlängerung des Gesamtüberlebens (median 11,3 versus 10,1 Monate, Hazard Ratio 0,87)5. In der BMS099-Studie konnte das progressionsfreie Überleben nicht signifikant verlängert werden6. Eine Metaanalyse aller randomisierten Studien bestätigte allerdings die Überlebensverlängerung durch Chemotherapie plus Cetuximab im Vergleich zur alleinigen Chemotherapie7.
Inzwischen konnte die immunhistochemische Expression des EGF-Rezeptors als prädiktiver Biomarker charakterisiert werden8. Bei Patienten mit hoher EGFR-Expression (Score &re; 200), welche bei 31 % der in die FLEX-Studie inkludierten Patienten nachgewiesen werde konnte, führte Chemotherapie plus Cetuximab im Vergleich zur alleinigen Chemotherapie zu einer deutlichen Verlängerung des Überlebens (median 12 versus 9,6 Monate, Hazard Ratio 0,73, p = 0,011). Bei Patienten mit niedriger Expression war die Kombination der alleinigen Chemotherapie nicht überlegen. Die entsprechenden Zulassungsverfahren für Cetuximab laufen.
Erstlinientherapie mit EGFR- Tyrosinkinaseinhibitoren bei EGFR-aktivierenden Mutationen
Im Vergleich zu einer palliativen Chemotherapie führten EGFR-gerichtete Tyrosinkinaseinhibitoren (Gefitinib, Erlotinib) bei Patienten mit nachgewiesenen EGFR-aktivierenden Mutationen im Tumor zu einer Verlängerung des progressionsfreien Intervalls und einer Verbesserung der Lebensqualität9–13. Eine Verlängerung des Gesamtüberlebens wurde allerdings nicht nachgewiesen. Die EGFR-aktivierenden Mutationen finden sich vorwiegend bei Nichtrauchern, Patienten mit Adenokarzinomen und bei Patienten asiatischer Herkunft. Gefitinib und Erlotinib sind deshalb für die Erstlinientherapie bei Patienten mit im Tumor nachgewiesenen EGFR-aktivierenden Mutationen zugelassen. Afatinib, ein irreversibler Tyrosinkinaseinhibitor, führte in einer Phase-III-Studie bei Patienten mit Adenokarzinomen und EGFR-aktivierenden Mutationen zu einer Verlängerung des progressionsfreien Überlebens im Vergleich zu Cisplatin plus Pemetrexed14.
1 NSCLC Meta-Analyses Collaborative Group. Chemotherapy in addition to supportive care improves survival in advanced non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data from 16 randomized controlled trials. J Clin Oncol 2008; 26:4617–4625.
2 Felip E, Gridelli C, Baas P et al., Metastatic non-small-cell lung cancer: consensus on pathology and molecular tests, first-line, second-line, and third-line therapy: 1st ESMO Consensus Conference in Lung Cancer; Lugano 2010. Ann Oncol 2011; 22:1507–1519.
3 Sandler A, Gray R, Perry MC et al., Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med 2006; 355:2542–2550.
4 Reck M, von Pawel J, Zatloukal P et al., Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 2009; 27:1227–1234.
5 Pirker R, Pereira JR, Szczesna A et al., Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer (FLEX): an open-label randomised phase III trial. Lancet 2009; 373:1525–1531.
6 Lynch TJ, Patel T, Dreisbach L et al., Cetuximab and first-line taxane/carboplatin chemotherapy in advanced non-small-cell lung cancer: results of the randomized multicenter phase III trial BMS099. J Clin Oncol 2010; 28:911–7.
7 Pujol JL, Lynch T, Rosell R et al., A meta-analysis of four randomized phase II/III trials adding cetuximab to platinum-based chemotherapy as 1st-line treatment in patients with non-small cell lung cancer (NSCLC). Eur J Cancer 2009; 7(Suppl):S508; 9009.
8 Pirker R, Pereira JR von Pawel J et al., EGFR expression as a predictor of survival for first-line chemotherapy plus cetuximab in patients with advanced non-small-cell lung cancer: analysis of data from the phase 3 FLEX study. Lancet Oncol 2011; Online Nov 4, 2011; DOI:10.1016/S1470–2045(11)70318–7.
9 Mok TS, Wu YL, Thongprasert S et al., Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361:947–957.
10 Mitsudomi T, Morita S, Yatabe Y et al., Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010; 11:121–128.
11 Maemondo M, Inoue A, Kobayashi K et al., Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 2010; 362:2380–2388.
12 Zhou C, Wu YL, Chen G et al., Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12:735–742.
13 Rosell R, Carcereny E, Gervais R, Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13:239–46.
14 Yang JC-H, Schuler MH, Yamamoto N et al., LUX-Lung 3: A randomized, open-label, phase III study of afatinib versus pemetrexed and cisplatin as first-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations. J Clin Oncol 2012; 30:(suppl; abstr LBA7500)























































































