PARP-Inhibitoren, VEGF-Antikörper – Ovarialkarzinom
Der orale PARP-Inhibitor (Poly- ADP-Ribose-Polymerase) Olaparib beim Rezidiv des Ovarialkarzinoms: randomisierte Phase-II-Studie bei Platinsensitivität1: Ca. 10 % der epithelialen Ovarialkarzinome weisen eine BRCA- 1- oder -2-Mutation auf und sind damit durch einen Defekt in der homologen DNA-Reparatur gekennzeichnet. Bis zur Hälfte der Patientinnen mit undifferenzierten serösen Ovarialkarzinomen dürften einen Defekt der homologen DNAReparatur aufweisen: Als Ursachen sind eine Keimbahnmutation oder eine somatisch erworbene Mutation von BRCA-1 oder -2 möglich, weiters BRCA-1- bzw. BRCA-2-unabhängige Defekte im homologen DNA-Rekombinationsweg sowie die epigenetische Inaktivierung von BRCA-1.
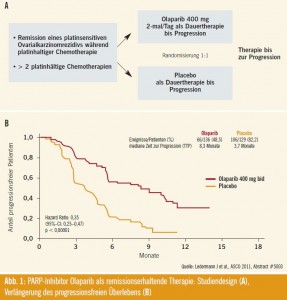
Studiendesign: Nach Remission eines platinsensitiven Rezidivs eines serösen, schlecht differenzierten Ovarialkarzinoms wurden Patientinnen in zwei Gruppen randomisiert: Gabe von Olaparib, eines oralen Poly-ADP-Ribose-Polymerase-Hem – mers oder Placebo (Abb. 1). Ein Viertel der Patientinnen wies eine BRCA-1- oder -2- Mutation auf. 14 % waren definitiv BRCA-negativ, und bei 64 % war der BRCA-Mutationsstatus unbekannt. 14 % der Patientinnen waren jüdischer Abstammung, 77 % wiesen einen ECOGStatus von 0 oder 1 auf. 60 % der Patientinnen wiesen vor der letzten platinhaltigen Chemotherapie ein platinfreies Intervall > 12 Monate auf; über 40 % hatten unter der letzten Chemotherapie eine Remission erzielt.
Studienergebnisse: Das mediane progressionsfreie Überleben betrug 8,4 Monate im Olaparib-Arm und 4,8 Monate im Placebo-Arm. Dieser Unterschied war hochsignifikant (p < 0,00001) (Abb. 1). Die folgenden Nebenwirkungen von Olaparib wurden gegenüber Placebo beobachtet: Übelkeit Grad 1+2: 66 % versus 35 %; Erbrechen/Dyspepsie Grad 1+2: 45 % und 22 %; Müdigkeit Grad 1–4 trat bei 49 % vs. 37 % der Patientinnen auf.
Schlussfolgerung: Olaparib war bei Patientinnen mit BRCA-Mutation und auch bei jenen ohne diese Mutation wirksam. Dies galt auch für Patientinnen mit unbekanntem Mutationsstatus. Patientinnen, die jünger als 65 Lebensjahre waren, profitierten mehr von Olaparib als ältere Patientinnen. Das platinfreie Intervall wies keinen Einfluss auf die Behandlungsergebnisse auf.
Iniparib in Kombination mit Carboplatin+ Gemcitabin beim platinsensitiven Ovarialkarzinomrezidiv – eine Phase-IIStudie1: In dieser Studie erhielten 58 Patientinnen Carboplatin AUC 4 Tag 1, Gemcitabin 1000 mg/m2 Tag 1 und 8 +/– den PARP-Inhibitor Iniparib (5,6 mg/kg; Tag 1, 4, 8, 11) alle 3 Wochen. Ein Ansprechen wurde bei 71 % der Patientinnen erreicht, und es wurde keine Korrelation zwischen BRCA-Mutation und Ansprechen gefunden.
Die ICON7-Studie3 und die GOG-218- Studie4 mit adjuvantem Bevacizumab beim Ovarialkarzinom: Über mehr als 1 Jahrzehnt bestand die etablierte adjuvante Therapie des Ovarialkarzinoms aus einer kombinierten Carboplatin-Taxan- Gabe. Das könnte sich durch das Vorliegen dreier positiver Studien, davon 2 im adjuvanten Setting, ändern.
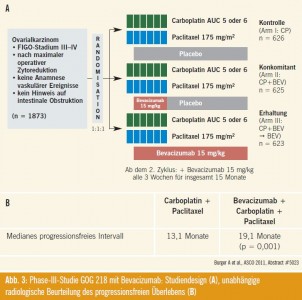
ICON7-Studie3: In der ICON7-Studie wiesen 94 % der Patientinnen einen guten ECOG-Status von 0–1 auf; 88 % hatten ein primäres Ovarialkarzinom, über 70 % ein undifferenziertes Karzinom und 69 % ein seröses Karzinom. Im Frühstadium I–IIa waren < 10 % der Patientinnen diagnostiziert worden, 21 % im Stadium IIb–IIIb und die Mehrzahl der Patientinnen im FIGO-Stadium IIIc– IV. Bei 74 % der Patientinnen war vor der adjuvanten Therapie ein optimales Tumor-Debulking mit Resttumoren < 1 cm durchgeführt worden (Abb. 2).
Studienergebnisse: Das mediane progressionsfreie Überleben lag in der Gesamtpopulation im Carboplatin+Paclitaxel- Arm bei 16,0 Monaten und im Carboplatin+ Paclitaxel+Bevacizumab-Arm (Dosis von Bevacizumab 7,5 mg/m2 alle 3 Wochen) bei 18,3 Monaten. Der Unterschied war hoch signifikant (p = 0,001) (Abb. 2). Das mediane progressionsfreie Überleben in der ungünstigen Subgruppe von Patientinnen mit Resttumoren über 1 cm und/oder Stadium IV betrug 10,5 Monate in der Standardtherapiegruppe und 15,9 Monate in der Bevacizumab- Gruppe. Auch dieser Unterschied war statistisch signifikant (p < 0,001). Selektionierte Nebenwirkungen vgl. Abb. 2.
GOG-218-Studie4: Die Zulassungsbehörde in den USA hat bei der GOG-218-Studie eine unabhängige radiologische Begutachtung verlangt, die am ASCO 2011 von R.A. Burger präsentiert wurde, vgl. Abb. 3.
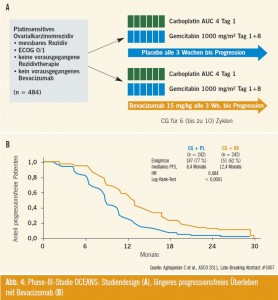
Randomisierte Studie mit Bevacizumab als Palliativtherapie beim platinsensiblen Ovarialkarzinomrezidiv (OCEANS)5: In der OCEANS-Studie konnte mit der Hinzunahme von Bevacizumab zur Chemotherapie beim platinsensitiven Rezidiv (= Rezidiv > 6 Monate nach letzter platinhaltiger Chemotherapie) ein Gewinn an progressionsfreiem Überleben erzielt werden: Das mediane PFS betrug mit Bevacizumab 12,4 Monate gegenüber 8,4 Monate im Standardtherapiearm (p < 0,0001) (Abb. 4).
Die mediane Remissionsdauer betrug 10,4 Monate (7,4 Monate im Standardtherapiearm). Komplette und partielle Remissionen traten zu 79 % im Bevacizumab- Arm gegenüber 57 % im Standardarm auf (p < 0,0001).
Beim Gesamtüberleben zeigte sich ein Trend zugunsten von Bevacizumab (36 Monate versus 30 Monate; p = 0,09). In der OCEANS-Studie wurden u. a. folgende Nebenwirkungen beobachtet (Carboplatin/ Gemcitabin [GC-Arm] vs. Bevacizumab + GC):
Fistel/Abszess < 1 % vs. 2 %; Darmperforation 0 vs. 0; Wundheilungsstörungen 0 vs. 1 %; Wundheilungsstörung ≥ Grad 3: 0 vs. 1 %; arterielle Thromboembolie aller Grade 1 % vs. 3 %; venöse Thromboembolie _ Grad 3: 3 % vs. 4 %; eine Hypertonie der Grade 3–4 in < 1 % vs. 17 %.
1 Ledermann J et al., Phase II randomized placebo-controlled study of olaparib in patients with platinum-sensitive relapsed serous ovarian cancer. J Clin Oncol 29 (Suppl 18) Abstract 5003
2 Penson RT, A phase II trial of iniparib in combination with gemcitabine/ carboplatin in patients with platinum-sensitive recurrent ovarian cancer. J Clin Oncol 29 (18 Suppl) Abstr. 5004
3 Kristensen G et al., Result of interim analysis of overall survival in the GCIG ICON7 phase III randomized trial of bevacizumab in women with newly diagnosed ovarian cancer. J Clin Oncol 29 (Suppl 18) Late-Breaking Abstract 5006
4 Burger A et al., Independent radiologic review of GOG 218, a phase III trial of bevacizumab in the primary treatment of advanced epithelial ovarian, primary peritoneal or fallopian tube cancer. J Clin Oncol 29 (Suppl 18) Abstract 5023
5 Aghajanian C et al., OCEANS: A randomized, double-blinded, placebocontrolled phase III trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer. J Clin Oncol 29 (Suppl 18) Late-Breaking Abstract 5007