Prädiktion und Prognose, Sicherheit und Wirksamkeit etablierter Therapien, neue Kombinationen und neue Targets – Rezente Entwicklungen beim Nierenzellkarzinom
Themen am ASCO 2011
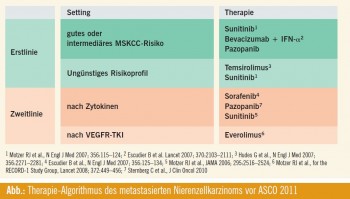
Wie in der Abb. ersichtlich, ergeben sich aufgrund der drei Optionen in der Erstlinientherapie bei gutem/intermediärem Risiko oftmals Auswahlschwierigkeiten, daher war Prädiktion, die einem die Qual der Wahl erleichtern soll, bei ASCO 2011 ein wichtiges Thema. Weitere wichtige Themen umfassten die Erweiterung des therapeutischen Potenzials in der Zweitlinie. Hierbei wurden Daten einer Phase-III-Studie mit dem neuen Tyrosinkinaseinhibitor Axitinib im Vergleich zu Sorafenib nach Versagen einer vorangegangenen Erstlinientherapie präsentiert. Weitere neue Daten umfassten die Themen Sicherheit und Wirksamkeit etablierter Therapien, dies insbesondere in Bezug auf die Interferon-Dosis bei der Bevacizumab+IFN-Kombination, moderne RCC-Therapie bei Dialysepatienten sowie die Themen Lebertoxizität bei Pazopanib, Hypothyreose bei Pazopanib sowie Prädiktion von Toxizität. Ein weiterer interessanter Schwerpunkt – wie schon im Vorjahr bei ASCO 2010 – war die Frage der Kombinationstherapie sowie auch die der Erweiterung des therapeutischen Armamentariums durch neue Therapien. Das Verhindern eines Rezidivs durch adjuvante Therapie war mit einer randomisierten Zytokin-Chemotherapie- Studie vertreten, und einige Autoren berichteten über neue Prognosefaktoren nach kurativer Nephrektomie.
Prädiktive Marker für neue Therapien
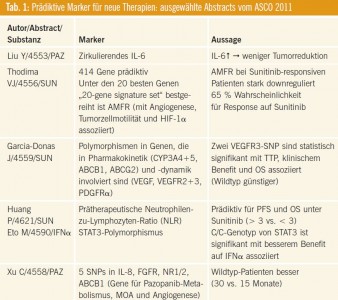
In Tab. 1 sind ausgesuchte Publikationen zum Thema Prädiktion dargestellt.
Interleukin 6 (Pazopanib): Liu und Kollegen (Abstract #4553) berichteten, dass erhöhte Serumspiegel des Inflammationsmarkers Interleukin-6 mit einer geringeren Reduktion der Tumormasse unter Pazopanib assoziiert sind. Wie wertvoll, klinisch relevant und neuwertig ist diese Information? Inflammationszeichen sind generell mit einer schlechteren Prognose beim mRCC assoziiert. Sie sind Ausdruck eines biologisch aggressiveren Tumorstadiums. Interleukin-6 (IL-6) gehört zum autokrinen Zytokinnetzwerk, welches das Tumorwachstum beeinflusst. Die Fähigkeit des Tumors, IL-6- Produktion zu triggern, ist mit einen höherem Metastasierungspotenzial und einer schlechteren Prognose assoziiert (Blay YL, Int J Cancer 1997; Negrier S, J Clin Oncol 2004). Was hier von Liu und Kollegen beobachtet wurde, ist also weniger Ausdruck dafür, dass sich Interleukin- 6 als spezifischer Pazopanib-Biomarker eignet, sondern eher die Bestätigung, dass bei diesem Patientengut generell mit modernen Therapien weniger zu erreichen ist als bei Patienten ohne Inflammationszeichen.
Angiogenesekodierendes Gen (Sunitinib): Thodima und Kollegen (Abstract #4556) haben aus 414 verschiedenen Genen 20 Gene identifiziert („Signature- Set“), die für das Ansprechen auf Sunitinib prädiktiv sind. Das bestgereihte Gen hierbei war AMFR, welches für Angiogenese, Tumorzellmotilität und HIF-1_ kodiert. Patienten mit Down-Regulierung des AMFR-Gens hatten eine 65%ige Wahrscheinlichkeit, auf Sunitinib responsiv zu sein.
Kommentar: Es handelt sich um eine sehr interessante Arbeit, jedoch ist es unwahrscheinlich, dass diese Ergebnisse nur auf Sunitinib zutreffen, vermutlich haben Patienten mit downreguliertem AMFR-Gen auch ein besseres Ansprechen auf andere Anti-VEGF-Therapien. Insofern erleichtert es die Wahl zwischen den Anti-VEGF-Therapien in der Erstlinientherapie wenig.
VEGFR-Genpolymorphismen (Sunitinib): Garcia-Jones et al. (Abstract # 4559) haben die Bedeutung von Polymorphismen in Genen, die für Pharmakokinetik und Pharmakodynamik von Sunitinib kodieren, in ihrer Bedeutung für den Benefit unter Sunitinib analysiert. Folgende Gene wurden untersucht: CYP3A4, CYP3A5, VEGF, VEGFR2, VEGFR3, PDGFR_. Zwei Single-Nukleotid-Polymorphismen in VEGFR3 waren statistisch signifikant mit einer besseren Zeit bis zur Progression und einem günstigeren Gesamtüberleben assoziiert, wobei Patienten mit Wildtyp- Profil besser abschnitten.
Kommentar: Ähnlich wie bei der zuvor zitierten Arbeit stellt sich die Frage, ob diese Daten nicht auch für andere Multikinaseinhibitoren gelten könnten, insbesondere für jene, die VEGFR-2+3 sowie PDGFR-_ als Target haben.
Neutrophilen-Lymphozyten-Ratio (Sunitinib): In einer Arbeit von Huang (Abstract #4621) wurde ein klinisch einfach zu erhebender Parameter, nämlich die Ratio Neutrophile zu Lymphozyten in ihrer Wertigkeit zur Vorhersage des Benefits einer Sunitinib-Therapie untersucht. Patienten mit einer Ratio < 3 hatten ein progressionsfreies Überleben von 15 Monaten, jene mit einer Ratio von > 3 ein PFS von nur 4 Monaten.
Kommentar: Ähnlich wie in der Arbeit zur Wertigkeit von Interleukin-6 zeigt sich auch hier wieder, dass Patienten mit hohen Inflammationsmarkern ungünstiger abschneiden. Zumindest ist dieser Marker aber einfach aus dem Routine- Labor zu erfassen.
Single-Nukleotid-Polymorphismen (Pazopanib): Xu und Kollegen (Abstract # 4558) haben 5 Single-Nukleotid-Polymorphismen in Genen identifiziert, die für Pazopanib-Metabolismus, Pazopanib- Wirkmechanismus und Angiogenese kodieren (IL-8, FGFR, NR1/2, ABCB1). Wildtyp-Patienten hatten hierbei mehr Benefit von Pazopanib (30 versus 15 Monate).
Kommentar: Auch hier ist unklar, ob man tatsächlich von einer Pazopanibspezifischen Prädiktion sprechen kann, da der Wirkmechanismus der Multikinaseinhibitoren zu ähnlich ist.
Polymorphismen im STAT-Pathway (Interferon): Die Arbeit von Eto und Kollegen (Abstract # 4590) zur Prädiktion eines etwaigen Benefits durch Interferon- alpha ist sehr interessant. In einer früheren Arbeit aus derselben Gruppe wurde bereits in einer retrospektiven Analyse festgestellt, dass Single-Nukleotid- Polymorphismen (SNP im „Signal Transducer and Activator 3“– [STAT3-] Gen signifikant mit einem besseren Ansprechen auf Interferon assoziiert sind (J Clin Oncol 2007). Nun wurden diese Daten prospektiv untersucht. Eto und Kollegen stellten fest, dass bei 204 untersuchten und mit Interferon alpha behandelten Patienten, die einer komplette/partielle Remission oder Stabilisierung erreicht hatten, der C/C-Genotyp von STAT3-2 vorliegt. Zur Erklärung: der STAT-Pathway wird nach Bindung von Interferon an den Interferon- Rezeptor aktiviert. STAT dimerisiert und transloziert in den Zellkern, was zur Induktion cyklinabhängiger Kinase – inhibitoren führt, die einen Zellzyklusarrest induzieren.
Fazit – Prädiktion
Keine der untersuchten Methoden ist spezifisch genug oder erleichtert die Auswahl zwischen Sunitinib, Pazopanib oder Bevacizumab+Interferon. Zudem sind die meisten Methoden derzeit im klinischen Alltag nicht praktikabel, geschweige denn durch ein anderes Zentrum validiert. Eine Ausnahme stellt die Arbeit von Eto dar: Der Nachweis eines STAT3- Polymorphismus (C/C Genotyp) könnte, sofern die Methodik verfügbar ist, ein guter Grund zur Auswahl einer Interferonbasierten Therapie, in diesem Fall Interferon+ Bevacizumab, sein (Tab. 1).
Sicherheit und Effektivität etablierter Therapien
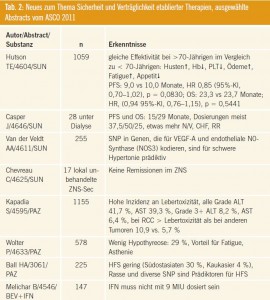
Die relevanten Arbeiten hierzu sind in Tab. 2 zusammengefasst.
Sunitinib beim älteren Patienten: Hutson und Kollegen (Abstract #4604) konnten in einer Analyse von 1059 Patienten demonstrieren, dass Sunitinib bei unter 70-Jährigen Patienten im gleichen Ausmaß wirkt wie bei über 70-Jährigen: PFS: 9,0 vs. 10,0 Monate, HR 0,85 (95%-KI, 0,70–1,02) p = 0,0830; OS: 23,3 vs. 23,7 Monate, HR, 0,94 (95%- KI, 0,76–1,15) p = 0,5441. Lediglich manche Toxizitäten waren bei der älteren Population stärker ausgeprägt; darunter Husten, Anämie, Thrombopenie, Ödeme, Fatigue und Appetitreduktion.
Kommentar: Diese Arbeit ist insofern wichtig, da sie mögliche Vorbehalte in der Anwendung von Sunitinib beim älteren Patienten reduzieren kann, somit also diese sehr wirksame Therapie älteren Patienten nicht unnötig vorenthalten wird. Ergänzend dazu zeigt eine Arbeit von Casper und Kollegen (Abstract #4646), dass Sunitinib in allen 3 Dosis- Varianten (50 mg, 37,5 mg und 25 mg) für Dialysepatienten geeignet ist: Das progressionsfreie Überleben sowie das Gesamtüberleben unterscheidet sich nicht von Patienten mit erhaltener Nierenfunktion (PFS 15 Monate, OS 29 Monate). Nausea, Vomitus, Hypertonie und kardiale Probleme waren allerdings bei Dialysepatienten etwas stärker ausgeprägt.
Vorhersehbarkeit von Toxizitäten: Van der Veldt und Kollegen (Abstract 4611) beschäftigen sich schon geraume Zeit mit dem Thema der Vorhersehbarkeit bestimmter Toxizitäten bei Sunitinib durch Erfassung von Single-Nukleotid-Polymorphismen in Genen von RCC-Patienten. In einer am ASCO vorgestellten Arbeit wurde nun Daten präsentiert, die zeigen, dass SNP in Genen, die für VEGF-A und endotheliale NO-Synthase (NOS3) kodieren, prädiktiv für das Auftreten einer schweren Hypertonie sind.
Kommentar: Eine akademisch interessante Arbeit aus dieser Gruppe, jedoch ist nicht klar, was die unmittelbare klinische Konsequenz sein könnte, denn der Blutdruck des Patienten wird ohnedies monitiert (bzw. sollte engmaschig monitiert werden), und die therapeutischen Alternativen sind gering, da alle drei First-Line-Therapien Hypertonie induzieren. Zudem ist das Auftreten einer Hypertonie als Biomarker anzusehen, was also dafür spricht, Patienten mit diesen SNP erst recht zu behandeln.
Fragliche Aktivität bei ZNS-Metastasen: Die Wirksamkeit von Sunitinib bei Metastasen im ZNS wurde von Chevreau und Kollegen (Abstract #4625) untersucht. Hierbei wurden 17 Patienten mit lokal unbehandelten ZNS-Metastasen mit Sunitinib therapiert: Eine Remission kam bei keinem Patienten zustande.
Kommentar: Diese Ergebnisse sind wichtig und wenig überraschend zu-
gleich. Die wichtigste Therapie von ZNSMetastasen ist und bleibt die Lokaltherapie, idealerweise Gamma-Knife oder Operation. Mit diesen Methoden ist die Prognose im Gehirn selbst ausgezeichnet, Rezidive sind selten. Moderne Multikinaseinhibitoren ersetzen Lokalthera – pien keinesfalls.
Befunde mit Pazopanib: Drei weitere Arbeiten aus dem Themenkreis Sicherheit befassen sich mit Nebenwirkungen von Pazopanib. Kapadia und Kollegen (Abstract #4595) betonen mit ihrer Arbeit die hohe Inzidenz an Lebertoxizität (alle Grade Alanin-Aminotransferase-[ALT-] – Erhöhung: 41,7 %, Aspartat-Aminotransferase-[ AST-]Erhöhung 39,3 %, wobei Grade 3,4 für ALT mit 8,2 % und für AST mit 6,4 % angegeben waren). Die Autoren stellen zudem fest, dass Lebertoxizität offenbar bei Patienten mit RCC häufiger vorkommt als bei anderen Tumorentitäten (10,9 % versus 5,7 %). Im Gegensatz dazu beobachtet die Arbeitsgruppe von Wolters (Abstract #4633), dass Pazopanib nur eine geringe Inzidenz an Hypothyreose aufweist (29 %) und diskutiert, ob dies nicht einen großen Vorteil in Bezug auf Fatigue und Asthenie darstellt. Ball und Kollegen (Abstract #3061) stellen fest, dass das Hand-Fuß-Syndrom (HFS) bei Pazopanib in der asiatischen Population gering ist, aber immer noch höher als im Vergleich zu Kaukasiern (30 % versus 4 %).
Kommentar: Ob die Tatsache, keine Hypothyreose zu entwickeln, tatsächlich als Vorteil gesehen werden kann, ist unklar. In anderen Arbeitsgruppen wurde immerhin festgestellt, dass Hypothyreose das Verhalten des Tumors beeinflusst, wobei Patienten mit Hypothyreose einen größeren Benefit haben (Schmidinger, Cancer 2010). Nicht verwunderlich ist die im Vergleich zu Sunitinib geringere Inzidenz an HFS bei asiatischen Patienten unter Pazopanib. So genannte Off- Target-Toxizitäten sind bei Asiaten häufiger und stellen eine echte therapeutische Limitierung dar; Pazopanib wird daher in diesen Ländern sicher eine sehr breite Anwendung finden, da Off-Target-Toxizitäten wie Hand-Fuß-Syndrom oder Myelotoxizitäten bei Pazopanib durch die geringe Affinität zu diesen Kinasen seltener vorkommen.
BEVLiN-Studie: Die bedeutendste Arbeit zum Thema Sicherheit und Wirksamkeit beim diesjährigen ASCO war vermutlich die BEVLiN-Studie (Melichar, Abstract #4546). In dieser Phase-II-Studie wurde Bevacizumab in der klassischen RCCDosierung von 10 mg/kg Körpergewicht eingesetzt; im Gegensatz zur AVORENStudie wurde aber Interferon-alpha mit 3 Millionen Einheiten 3-mal wöchentlich niedriger dosiert. 147 Patienten wurden untersucht und die Ergebnisse mit den Daten der AVOREN-Studie verglichen. Im indirekten Vergleich war das mediane PFS wesentlich höher als in der AVOREN- Studie (14,8 versus 10,2 Monate, HR: 0,72 [95%-KI: 0,56–0,94]), das mediane Überleben noch nicht erreicht (versus 25,8 Monate in AVOREN, HR: 0,74 [95%-KI: 0,51–1,08]), die Ansprechraten hingegen waren geringer: 25,57 % versus 37,9 %. Die Therapieverträglichkeit war erwartungsgemäß wesentlich besser, da bei geringerer IFNalpha- Dosis auch weniger IFN-alpha-assoziierte Toxizitäten zu erwarten sind.
Kommentar: Kritiker meinen, diese Daten würden nicht reichen, um Bevacizumab + niedrig dosiertes IFN-alpha als neue Bevacizumab/IFN-Variante im Therapie- Algorithmus zu etablieren. Diese Ansicht wird jedoch von den wenigsten Experten geteilt: Es muss nicht jedes Detail in einer randomisierten Phase-IIIStudie untersucht werden, und letztendlich geht es hierbei um die bessere Verträglichkeit einer bereits etablierten Therapie. Die meisten Experten halten Bevacizumab + niedrig dosiertes IFN-alpha für die bessere, neue Bevacizumab+ IFN-Variante (Tab. 2).
Erweiterung des therapeutischen Potenzials in der Zweitlinie
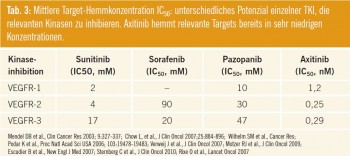
Axitinib vs. Sorafenib als Second-Line- Therapie: Axitinib ist ein hochpotenter VEGFR-1,2,3-Tyrosinkinase-Inhibitor, der in einer Phase-II-Studie bei zytokinrefraktären Patienten die bislang besten Ergebnisse in dieser Population im Sinne von ORR, PFS und OS gezeigt hat (44 %, 15,7 Monate, 29,9 Monate). Dies ist wenig überraschend, betrachtet man die molekularen Details: Die mittlere inhibitorische Konzentration IC50 von Axitinib ist mit wesentlich geringeren Dosierungen als bei allen anderen bislang verfügbaren TKI erreicht (Tab. 3).
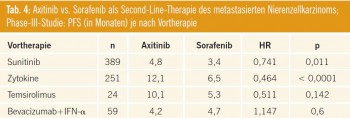
Aufgrund dieses viel versprechenden Potenzials wurden eine randomisierte Phase- III-Studie durchgeführt (Abstract #4503). 723 Patienten, die zuvor auf eine vorangehende First-Line-Therapie progredient waren, wurden zu Axitinib oder Sorafenib randomisiert. Vortherapien umfassten: Sunitinib oder Bevacizumab+ IFN-alpha oder Temsirolimus oder Zytokine. Die Hälfte der Patienten war mit Sunitinib vorbehandelt worden und ein Drittel mit Zytokinen. Das mediane progressionsfreie Überleben (PFS) (primärer Endpunkt) betrug 6,7 Monate (95%-KI 6,3–8,6) für Patienten unter Axitinib und 4,7 (95%-KI 4,6–5,6) Monate für Patienten im Sorafenib-Arm. Der Unterschied ist statistisch signifikant (p < 0,0001). Auch die objektive Remissionsrate war für Patienten im Axitinib-Arm statistisch signifikant höher als im Sorafenib- Arm (19,4 % vs. 9,4 %, p = 0,0001). Aufgrund dieser Ergebnisse wurde Axitinib vom Primary Investigator als „die neue Standardtherapie“ der Zweitlinie deklariert.
Kommentar: Axitinib per se ist eine hochwirksame Substanz, deren wahres Potenzial in dieser Studie nicht so gut erkennbar ist wie in zuvor publizierten Patientenpopulationen, die nur mit Zytokin vorbehandelt waren. Die Hoffnung, durch noch stärkere Kinaseinhibition nach Progression auf Sunitinib eine PFSVerlängerung durch Axitinib zu erreichen, ist zwar im Vergleich zu Sorafenib erfüllt worden, jedoch blieb das Ausmaß des PFS-Unterschieds hinter den Erwartungen zurück. Auch wenn die Ansprechraten relativ hoch erscheinen, muss man sich wohl vor Augen halten, dass ein nicht unbeträchtlicher Teil der Studienpatienten als Vortherapie nur Zytokine erhalten hatten – vermutlich kommt die hohe Gesamtansprechrate primär von diesem Patientengut. Tab. 4 schlüsselt das progressionsfreie Überleben nochmals nach Vortherapie auf: Hier ist gut erkennbar, dass Sunitinib-vorbehandelte Patienten durch Axitinib kein die Erwartungen übertreffendes PFS erreichten. Wie ist nun das Potenzial von Axitinib im indirekten Vergleich zu Everolimus bei Patienten, die auf Sunitinib progredient waren? In Tab. 5 ist ein (indirekter) PFSVergleich angeführt.
Axitinib scheint im indirekten Vergleich zwar etwas besser zu sein als Everolimus, der Unterschied ist jedoch gering. Bei Patienten, die eine volle Sunitinib- Dosis nicht tolerieren und auf 37,5 mg (statt 50 mg) progredient sind, könnte Axitinib in der Zweitlinie die optimale Lösung sein: VEGF wird stärker inhibiert und die Off-Target-Toxizitäten wie Hand- Fuß-Syndrom sind geringer. Wenn ein Patient aber auf 50 mg Sunitinib progredient ist, könnte eine Pause mit VEGF-Inhibitoren (während einer Everolimus- Zweitlinientherapie) unter Umständen von Vorteil sein, um diese vorübergehende Resistenz „auszusitzen“. Das Ansprechen auf Axitinib nach Progression auf Everolimus könnte dann u. U. viel besser sein als direkt nach Sunitinib.
Neue Therapien
Tab. 6 listet kleinere Studien mit neuen Substanzen auf. Wie schon in den letzten Jahren wurden auch bei ASCO 2011 neue Substanzen vorgestellt. Deren Potenzial zu erkennen ist noch schwierig, da neue Therapien zunächst meist in sehr späten Krankheitsstadien getestet werden. Eine sehr vielversprechende neue Substanz ist Tivozanib, ein hochpotenter Anti-VEGFR-TKI, der in seiner Potenz, die VEGF-Signalkaskade zu inhibieren, sogar effektiver als Axitinib ist. Ergebnisse einer Phase-II-Studie mit dem TKI258 Dovitinib, einem kombinierten FGFR- und VEGFR-Inhibitor, wurden ebenfalls präsentiert. Rationale hierfür ist, dass bei Patienten, die auf Sunitinib progredient sind, hohe Serumspiegel von FGF-mRNA nachweisbar sind, was für die Aktivierung des alternativen proangiogenen FGF-Pathways in der Phase der Sunitinib- Resistenz spricht. Die vorläufigen Ergebnisse sind im Vergleich zu einer Sunitinib- Reinduktion allerdings noch nicht so eindrucksvoll – hier wird man die Phase- III-Ergebnisse abwarten müssen, um einen besseren Eindruck vom Potenzial der Substanz zu bekommen.
Kombinationstherapien
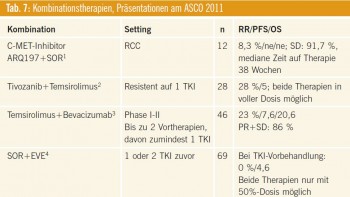
Dem Wunsch, die Rate an objektiven – vor allem kompletten – Remissionen zu erhöhen, wird mit Kombinationen effektiver Therapien begegnet. Bislang war keine Kombination effektiv und sicher genug, um eine größere Rolle zu spielen. Tab. 7 listet die am ASCO 2011 vorgestellten Kombinationsstudien auf.
Kommentar: Wenige Kombinationen sind viel versprechend, dieses Konzept wird zumeist durch unzureichende Dosierung der Kombinationspartner erschwert. Hierbei bildet Tivozanib in Kombination mit Temsirolimus eine Ausnahme, immerhin sind beide Substanzen in voller Dosis einsetzbar, die Remissionsrate von 28 % bei Resistenz auf einen vorangegangenen TKI ist als interessant zu werten.
Prognose
Polymorphismen und Rezidivwahrscheinlichkeit: Nach einer Arbeit von Schutz und Kollegen (Abstract #4506) lässt sich die Rezidivwahrscheinlichkeit nach Operation eines RCC (mit kurativer Intention) durch Single-Nukleotid-Polymorphismen vorhersagen: SNP im ABCB1-Gen, welches für das MDR-PGlykoprotein kodiert, sind mit einer hohen Rezidivwahrscheinlichkeit assoziiert (HR 2,88). Als ebenfalls bedeutsam wurden SNP im HIF-2-Gen eingestuft.
Lymphozyten-Count vor Nephrektomie: Saroha und Kollegen (Abstract #4641) konnten demonstrieren, dass ein niedriger absoluter Lymphozytenwert vor Nephrektomie mit einem höheren TNMStadium und „Nuclear Grade“ assoziiert ist und damit ein unabhängiger Prädiktor für das Überleben ist.
Nephronsparende Operation vs. radikale Nephrektomie: Kates und Kollegen (Abstract #4589) analysierten über 4000 Patienten mit Tumoren < 2 cm und stellten fest, dass eine radikale Nephrektomie im Vergleich zu einer nephronsparenden Operation mit einem signifikant höheren Risiko für kardiovaskuläre Mortalität assoziiert ist.
Kommentar: Die Rezidivwahrscheinlichkeit ist derzeit auch sehr verlässlich mit dem etablierten Leibovich-Score zu erheben, es fragt sich daher, ob Genuntersuchungen hierfür notwendig sind. Allerdings ermöglichen solche präoperativen Untersuchungen natürlich frühzeitiger eine prognostische Aussage, insofern kann der Lymphozytenwert vor Nephrektomie eine wertvolle Zusatzinformation sein. Die nephronsparende Operation bei kleineren Tumoren sollte ohnedies Standard sein, die Ergebnisse der oben genannten Studie unterstreichen dies.
Adjuvante Therapie
Das Immun-Chemotherapie-Konzept (Interferon- alpha, Interleukin-2, 5-Fluorouracil) aus früheren Jahren wurde von Aitchinson und Kollegen (Abstract #4505) in der adjuvanten Situation bei 309 Patienten untersucht; es zeigte sich kein Benefit beim krankheitsfreien oder beim Gesamtüberleben. Kommentar: Die Studie wurde zu einem Zeitpunkt begonnen, als moderne Therapien noch nicht weit verbreitet waren. Die Ergebnisse bestätigen die Daten, die man auch aus der Palliativsituation kennt.
Zusammenfassung ASCO 2011
In der Erstlinientherapie bei Patienten mit gutem oder intermediären Risikoprofil ist die Situation mit den drei Optionen Sunitinib, Bevacizumab+IFN-alpha oder Pazopanib unverändert, allerdings wird jetzt wesentlich häufiger niedrig dosiertes IFN-alpha zur Anwendung kommen, wenn IFN-alpha+Bevacizumab als Erstlinientherapie gewählt wird. Dies scheint gerechtfertigt, obwohl es sich lediglich um eine ergänzende Phase-II-Studie handelt.
Prädiktive Marker liefern derzeit noch keine ausreichenden Zusatzinformationen, die die Qual der Wahl bei der Erstlinientherapie erleichtern würden, da die Ergebnisse wahrscheinlich auf alle Multikinaseinhibitoren zutreffen. Zudem stellt sich die Frage, was – mangels therapeutischer Alternativen – dem Patienten alternativ angeboten werden kann. Interessant sind jedoch die Daten zur Prädiktion für die Interferon-basierte Therapie (in Kombination mit Bevacizumab), da die IFN-alpha-basierte Therapie (in Kombination mit Bevacizumab!) nach wie vor ein wichtiger therapeutischer Pfeiler ist.
In der Zweitlinientherapie ist Axitinib eine neue Option, nicht aber der neue Standard, es sei denn, die derzeit noch ausständigen Überlebensdaten wären wesentlich besser als mit Everolimus. Das Potenzial dieser sehr aktiven Substanz ist in der Zweitlinie nicht optimal genützt.
Die interessanteste Substanz der Zukunft ist Tivozanib, was die Bedeutung einer hohen VEGFR-TK-Affinität widerspiegelt. Kombinationen und neue Substanzen lassen vorerst keinen neuer – lichen Durchbruch in der Therapie des mRCC erkennen.