Radiotherapie
Am 12. Internationalen St. Gallen Meeting wurden die lokoregionäre Behandlung mittels neuer, radiotherapeutischer Techniken, neue Fraktionierungsschemata, deren Langzeiteffekte und Evidenz durch klinische Studien sowie moderne Differenzierungsmöglichkeiten für das Rezidivgeschehen behandelt. Im Folgenden werden die Fragen an das Panel sowie deren Beantwortung kommentiert wiedergegeben.
Duktales Carcinoma in situ (DCIS)
Ist Radiotherapie (RT) bei einem chirurgisch komplett entfernten DCIS Standard?
Ja: 67,6 %; Nein: 24,3 %; Enthaltung: 8,1 %
Kommentar: Sowohl die NSABP-B-17- Studie von 1999 als auch die EORTCStudie von 2006 an über 1000 randomisierten Patientinnen zeigen eine ca. 50%ige Reduktion des Risikos für invasive und nichtinvasive Rezidive.
Kann Strahlentherapie bei älteren Patientinnen vermieden werden (> 70 Jahre)?
Ja: 58,3 %; Nein: 33,3 %; Enthaltung: 8,3 %
Kommentar: Bei älteren Patientinnen wird aufgrund des relativ niedrigen Rezidivrisikos häufig von einer adjuvanten Strahlentherapie abgesehen. Eine Studie von Smith et al. untersuchte an 3409 DCIS-Patientinnen im Alter über 66 Jahre, welchen Stellenwert die adjuvante Strahlentherapie hat. Die Patientinnen wurden in Niedrig- und Hochrisiko-Gruppen unterteilt. Als Hochrisiko-Patientinnen galten jene, die mindestens einen der folgenden Risikofaktoren aufwiesen: Alter zwischen 66 bis 69 Jahren, Tumor größer als 2,5 cm, Komedo- oder G3-Histologie. Das 5-Jahres-Rezidivrisiko betrug in dieser Gruppe 13,6 % ohne vs. 3,8 % mit Radiotherapie. In der Niedrigrisiko- Gruppe: ohne RT 8,2 % vs. 1,0 % mit RT.
Kann Radiotherapie bei Low-Grade-/ Niedrigrisiko-DCIS vermieden werden?
Ja: 61,7 %; Nein: 31,9 %; Enthaltung: 6,4 %
Kommentar: Eine 2006 publizierte Untersuchung an 158 Patientinnen mit niedrigem Risiko (Sicherheitsabstand > 1 cm, Tumor < 2,5 cm, niedriges Grading 1–2) wurde wegen der hohen Rezidivrate (12 % in 5 Jahren) vorzeitig beendet. Diese Daten bestätigen die oben genannten Studien der NSABP und der EORTC, die auch für weit resezierte Tumoren einen klaren Vorteil durch eine adjuvante Bestrahlung sahen. Auch bei niedrigem Grading (univariate Analyse) wurde in der EORTC-Studie die Rezidivhäufigkeit von ca. 18 % ohne adjuvante RT auf unter 10 % gesenkt.
Akzelerierte Radiotherapie
Ist die akzelerierte Ganzbrustbestrahlung (WBRT) eine akzeptable Option?
Ja: 91,5 %; Nein: 4,3 %; Enthaltung: 4,3 %
Sollte Standard-Brustbestrahlung bei extensiver vaskulärer Invasion bevorzugt werden?
Ja: 34,8 % Nein: 32,6 % Enthaltung: 32,6 %
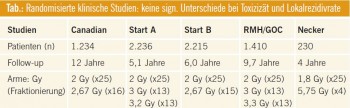
Kommentar: Wird eine Strahlentherapie konventionell appliziert (Einzeldosis [ED] 1,8 bzw. 2,0 Gy), beträgt die Dauer, in Abhängigkeit von der Dosisaufsättigung (Boost), zwischen 5 und 7 Wochen. Dies hat dazu geführt, dass insbesondere in den angelsächsischen Ländern versucht wurde, hypofraktionierte Protokolle mit einer verkürzten Gesamtbehandlungszeit bei biologisch gleicher Effektivität zu entwickeln.
Die Ergebnisse verschiedener Studien liegen vor und können in ausgewählten Fällen bei Niedrigrisiko-Patientinnen bei der Indikationsstellung zur adjuvanten Strahlentherapie herangezogen werden. Whelan et al. haben bei Patientinnen nach brusterhaltender Chirurgie, R0-Resektion und negativem Nodalstatus verglichen, ob eine Erhöhung der ED von 5- mal 2,0 Gy pro Woche bis zu einer Gesamtdosis (GD) von 50,0 Gy auf eine hypofraktionierte Vorgehensweise mit 5-mal 2,65 Gy pro Woche bis zu einer GD von 42,5 Gy möglich ist. Eine Boostbestrahlung hat nicht stattgefunden. Insgesamt zeigte sich eine vergleichbare Kontrolle in beiden Armen mit einem identen Gesamtüberleben. Auch die Nebenwirkungsrate bezüglich der Haut und des Unterhautgewebes wird als ähnlich beschrieben. Die in Großbritannien durchgeführten START-Studien haben gleichwertige Ergebnisse gezeigt.
Die hypofraktionierte Strahlentherapie stellt eine mögliche Option für Niedrigrisiko- Patientinnen dar.
Da dieses Vorgehen bei nodalpositiven Patientinnen nicht untersucht worden ist, sollten diese von diesem Vorgehen ausgeschlossen bleiben. Das Gleiche gilt für Patientinnen, bei denen die Indikation zur Dosisaufsättigung (Boost) besteht. Die Bedeutung einer Boostbestrahlung wurde bislang im Rahmen dieser hypofraktionierten Konzepte nicht definiert. Bei einer Nachbeobachtungszeit von bis zu 10 Jahren wurde von den unterschiedlichen Studiengruppen bisher über keine erhöhten Nebenwirkungsraten berichtet.
Aus radioonkologischer Sicht ist aber diese Nachbeobachtungszeit noch etwas zu knapp, um eine allgemeine Empfehlung aussprechen zu können. Daher sehen wir – übereinstimmend mit den Guide – lines der ASTRO (American Society for Therapeutic Radiology and Oncology) – die Hypofraktionierung als Behandlungsoption bei älteren Patientinnen mit niedrigem Risiko.
Teilbrustbestrahlung (PBRT)
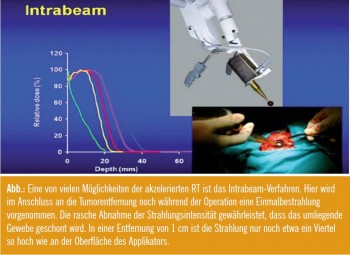
Im Rahmen brusterhaltender Chirurgie: Ist die Teilbrustbestrahlung (intraoperativ) akzeptabel …
a) … als definitive Bestrahlung, ohne jede externe Strahlentherapie?
Ja: 48,9 %; Nein: 35,6 %; Enthaltung: 15,6 %
b) … anstelle einer externen Boost – bestrahlung des Tumorbetts?
Ja: 61,8 %; Nein: 11,8 %; Enthaltung: 26,5 %
c) … kann die PBRT bei selektionierten Patienten angewendet werden (einschließlich intraoperative PBRT)?
– bei älteren Patientinnen (Alter > 70)?
Ja: 37,2 %; Nein: 25,6 %; Enthaltung: 37,2 %
– bei Lymphom-Überlebenden nach Mantelfeldbestrahlung?
Ja: 37,2 %; Nein: 25,6 %; Enthaltung: 37,2 %
Kommentar: Teilbrustbestrahlungen sind für gewöhnlich akzelerierte, also zeitlich verkürzte Strahlenbehandlungen, die als Alternative zur homogenen Strahlentherapie der gesamten Brust bei Niedrigrisiko-Patientinnen diskutiert werden (Accelerated partial breast irradiation, APBI). Zurzeit befinden sich verschiedene Verfahren in Phase-III-Studien in Erprobung, bei denen eine hohe Bestrahlungsdosis direkt im Tumorbett als definitive Therapie oder als Boostbestrahlung vorgenommen wird. Die angewandten Verfahren können intraoperativ, in Afterloading-Technik oder perkutan appliziert werden. Die APBI ist nicht für alle Patientinnen, die brusterhaltend operiert werden, repräsentativ. Aufgrund der Guidelines der ASTRO und ESTRO (European Society for Therapeutic Radiology and Oncology) können Niedrigrisiko-Patientinnen höheren Alters jedoch außerhalb klinischer Studien behandelt werden. Nach Bestrahlung eines Mantelfeldes ist die Teilbrustbestrahlung meist die einzige strahlentherapeutische Therapieoption.
Post-Mastektomie- Strahlentherapie (PMRT)
Sollte die PMRT Standard sein für Patienten mit
a) N+ ≥ 4?
Ja: 87,8 %; Nein: 4,9 %; Enthaltung: 7,3 %
Kommentar: Metaanalysen sowie randomisierte, kontrollierte Studien haben gezeigt, dass die PMRT die lokoregionäre Rezidivrate bei allen Patientinnen – ausgenommen solchen mit kleinen Tumoren und negativen Lymphknoten – substanziell reduziert; ein Hinweis darauf, dass der Benefit stadienabhängig ist. Die Reduktion der Lokalrezidive drückt sich in einem verlängerten Überleben aus. In der letzten Metaanalyse der Early Breast Cancer Trialist’s Collaborative Group (EBCTCG) hatten Patientinnen mit positiven Lymphknoten einen Benefit beim erkrankungsspezifischen Überleben von 5,4 % und beim Gesamtüberlebens von 4,4 % nach 15 Jahren. Bei Patientinnen mit 4 oder mehr positiven Lymphknoten, deren 5-Jahres-Lokalrezidivrate von 40,6 % auf 12,9 % reduziert wurde, war der Überlebensvorteil mit 6,2 % am größten. Die PMRT wird daher bei pT3–4-Tumoren, inkompletter Resektion sowie bei 4 oder mehr positiven axillären Lymphknoten empfohlen.
b) N+ 1–3?
Ja: 18,2 %; Nein: 70,5 %; Enthaltung: 11,4 %
Kommentar: Die letzte EBCTCG-Meta – analyse ergab eine absolute Reduktion der Brustkrebsmortalität von 4,4 % nach 15 Jahren. Die Lokalrezidivrate betrug 5,3 % vs. 24,3 % ohne Radiotherapie. In einer Subgruppenanalyse der Danish Breast Cancer Study Group betrug der Überlebensvorteil für Patienten mit 4 oder > 4 LK+ 9 % (21 % vs. 12 %).
Insbesondere wies die Subgruppe mit 1–3 LK+ denselben absoluten Überlebens – vorteil von 9 % auf (57 % vs. 48 %), während das Gesamtüberleben höher war. Auch die 20-Jahre-Analyse der British Columbia Studie erbrachte ähnliche Resultate.
Auf Grund dieser Ergebnisse wird die PMRT zunehmend auch für Patientinnen mit 1–3 positiven Lymphknoten empfohlen.
c) N0 pT > 1?
Ja: 12,8 %; Nein: 85,1 %; Enthaltung: 2,1 %
– nur bei jungen Patienten? (< 45 Jahre)
Ja: 51,2 %; Nein: 41,9 %; Enthaltung: 7,0 %
– bei Vorliegen ausgeprägter vaskulärer Invasion?
Ja: 56,5 %; Nein: 26,1 %; Enthaltung: 17,4 %
Kommentar: Bestehen minore Risikofaktoren wie T2-Tumoren > 3 cm, Lymphangiosis carcinomatosa, Gefäßeinbrüche, knapper Resektionsrand (< 1 mm), junges Alter der Patientin (< 45 Jahre) oder Infiltration der Pektoralisfaszie, ist ein Benefit durch eine zusätzliche Strahlentherapie sehr wahrscheinlich, insbesondere, wenn mehrere Risikofaktoren gleichzeitig vorliegen.