Spezifische Nebenwirkungen oraler Therapien: kardiovaskuläre Toxizitäten und Infektionen
In den letzten Jahren hat die Verfügbarkeit effektiver oraler Medikamente zur Behandlung maligner Erkrankungen dramatisch zugenommen. Dies ist natürlich primär zum Vorteil der Patienten, hat jedoch auch positive Auswirkungen auf das medizinische Management dieser Erkrankungen. Wurden diese Patienten zuvor überwiegend in Kliniken therapiert, ist dies nun auch im extramuralen Bereich effektiv möglich. Dem Rechnung tragend, hat die WGKK zusammen mit der 3. Medizinischen Abteilung des Hanusch-Krankenhauses den Häma-Verbund ins Leben gerufen, der die ambulante Versorgung von Patienten mit hämatologischen Erkrankungen in drei Wiener Gesundheitszentren (Wien-Mitte, Mariahilf und Floridsdorf) gewährleistet. Dies soll auch zur Entlastung der Fachabteilungen beitragen, die natürlich verdichtend die schwereren hämatologischen Fälle, v. a. akute Leukämien und rezidiviert/refraktäre Erkrankungen, versorgen. Im Weiteren sollen kardiologische und infektiologische Nebenwirkungen einiger wichtiger oraler Substanzen diskutiert werden.
BCR/ABL-Inhibitoren
Diese Medikamentenklasse hat die Behandlung der chronisch myeloischen Leukämie (CML) revolutioniert, Patienten mit CML haben mittlerweile eine normale Lebenserwartung. Allerdings müssen v. a. bei den Kinaseinhibitoren der 2. und 3. Generation kardiovaskuläre Toxizitäten beachtet werden. Dies ist umso relevanter, da der typische CML-Patient bei Diagnosestellung über 60 Jahre alt ist und eventuell bereits Komorbiditäten akquiriert hat. Eine italienische Arbeitsgruppe1 hat 472 Patienten analysiert, die allesamt höchst effektiv mit Nilotinib behandelt wurden. Insgesamt kam es zu 7 % arteriellen thrombotischen Ereignissen; während bei den unter 40- Jährigen kein einziges Event auftrat, waren 24 % der über 60-jährigen Patienten von solchen schweren Nebenwirkungen, meist kardiale Ischämien, betroffen. Ähnliches wurde für Ponatinib gezeigt, das auch bei der T315I-Mutation wirksam ist. In der PACE-Studie2 wurden Patienten mit CML und Philadelphia-positiver ALL mit unterschiedlichen Dosen Ponatinib (15–45 mg täglich) behandelt. Alters- und dosisabhängig traten deutlich gehäuft venöse thrombotische (bis zu 5 %) und arteriell thrombotische Ereignisse (bis zu 29 %) auf. Mittlerweile werden daher niedrigereDosierungen zwischen 15 und 30 mg empfohlen.
Ruxolitinib
Ruxolitinib ist ein JAK2-Inhibitor, der bei der primären Myelofibrose mit symptomatischer Splenomegalie und rezidivierter/refraktärer Polycythaemia vera eingesetzt wird.3, 4 Bei länger behandelten Patienten traten vermehrt opportunistische Infektionen auf, wie z. B. Herpes Zoster oder Toxoplasmose. Zudem kam es zu Reaktivierungen von Hepatitis B und Tuberkulose. Daher werden vor Beginn einer Ruxolitinib-Therapie ein umfassendes infektiologisches Screening, Impfungen und entsprechende Prophylaxen empfohlen. Aufgrund seines deutlichen immunsuppressiven Potentials wird das Medikament mittlerweile erfolgreich in der Therapie der Graft-versus-Host Erkrankung nach allogener Stammzelltransplantation eingesetzt.
Ibrutinib
Ibrutinib ist ein Hemmer der Bruton’schen Tyrosinkinase (BTK) und wird höchst erfolgreich in der Behandlung von lymphatischen Systemerkrankungen, v. a. bei chronisch lymphatischer Leukämie (CLL), aber auch beim Mantelzelllymphom und beim Morbus Waldenström, eingesetzt.5 Das Medikament hat jedoch einige off target-Effekte, da es auch andere Kinasen (z. B. EGFR, ITK, TEC) hemmt. In den randomisierten klinischen Studien fiel zudem als etwas überraschende Nebenwirkung eine erhöhte Rate an Vorhofflimmern in einer Häufigkeit von ungefähr 8–10 % auf (HELIOS, RESONATE, RESONATE-2, RAY). Die Ursache dafür ist noch nicht eindeutig geklärt, es wird eine kinasevermittelte Wirkung auf die Kardiomyozyten postuliert.6 Zuletzt wurde im Mausmodell auch ein Remodelling des linken Vorhofes verbunden mit einer lokalen Kalziumdysregulation nachgewiesen.7 Die Nebenwirkung ist altersabhängig und tritt meist während der ersten 6 Monate auf, es sei denn, der Patient hatte bereits früher eine solche Rhythmusstörung, dann kann es bereits innerhalb der ersten 8 Wochen dazu kommen. Problematisch wird es, wenn der Patient in weiterer Folge (CHA2-DS2-VASc Score ≥ 2) oral antikoaguliert werden muss. Dies kann einerseits zu einer erhöhten Blutungsneigung, andererseits zu unerwünschten Medikamenteninteraktionen führen. Im klinischen Behandlungsalltag mit Ibrutinib wird Vorhofflimmern in bis zu 20 % der zumeist älteren Patienten beobachtet. Zudem besteht unter Ibrutinib ein erhöhtes Risiko, eine arterielle Hypertonie zu entwickeln, welche auch nach längerer Behandlungsdauer nicht abnimmt. Erwähnenswert ist, dass arterielle Hypertonie einen der Hauptrisikofaktoren für das Auftreten von Vorhofflimmern darstellt. Neben den kardialen Toxizitäten kommt es unter der Dauertherapie mit Ibrutinib auch zu einer erhöhten Inzidenz von Infektionserkrankungen, meist opportunistischer Natur. Es sind u. a. Pneumonien mit Pneumocystis jirovecii (PjP), Reaktivierungen von Hepatitis B und auch teilweise atypische Pilzinfektionen beschrieben. Man sollte daher bei Risikopatienten antiinfektive Prophylaxen gegen PjP und CMV erwägen. Eine Azol-Prophylaxe wird zurzeit aufgrund der zu erwartenden Medikamenteninteraktionen nicht empfohlen. Die Pilzinfektionen (Lokalisationen ZNS und Lunge) traten überwiegend bei Patienten auf, die auch Steroide erhielten, wie z. B. bei Autoimmunhämolysen oder Autoimmunthrombozytopenien. Dies soll daher tunlichst vermieden werden. Die Ursache dieser atypischen Infektionen ist nicht gänzlich geklärt, eine mögliche Erklärung ist die kürzlich nachgewiesene Hemmung der Makrophagenaktivität durch Ibrutinib.8
Idelalisib
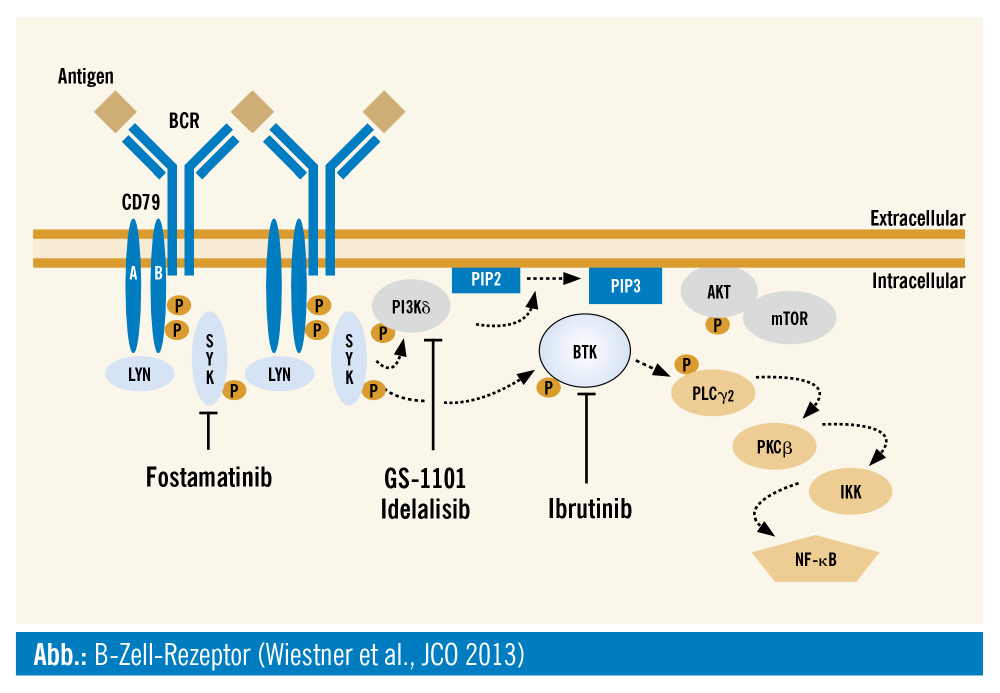
Idelalisib inhibiert spezifisch die Delta-Untereinheit der Phosphatidylinositol-3-Kinase (PI3), die eine wesentliche Rolle in der Signaltransduktion des B-Zell-Rezeptors spielt (Abb.). Das Medikament ist bei der rezidivierten CLL und beim doppelt refraktären follikulären Lymphom zugelassen.9, 10 In dem breit ausgerollten Studienprogramm zeigte sich jedoch nach kurzer Zeit, dass bei frühem Einsatz der Substanz, speziell bei CLL-Patienten, eine deutlich erhöhte Nebenwirkungsrate beobachtet wurde. Einerseits traten vermehrt opportunistische Infektionen auf, andererseits kam es durch Hemmung der regulatorischen T-Zellen zu schwerwiegenden Autoimmunphänomenen, speziell mussten Colitiden und lebensbedrohliche Pneumonitiden zur Kenntnis genommen werden. Dies führte zu einer Behördenwarnung und zu einem Abbruch eines großen Teils des Studienprogramms. Aktuell werden antiinfektive Prophylaxen gefordert, zudem ist ein Einsatz bei der CLL nur noch im späten Krankheitsverlauf, nach Versagen anderer Therapien, empfohlen. Nichtsdestotrotz ist Idelalisib bei Hochrisikopatienten ein wertvolles Reservemedikament.
Resümee
Der Einsatz von oralen Therapien bei malignen hämatologischen Systemerkrankungen stellt einen wesentlichen Fortschritt dar und ist für Patienten von großem Vorteil. Je nach Spezifität der Medikamente ist jedoch mit neuen, unerwarteten Nebenwirkungen zu rechnen, die möglicherweise auch erst nach der Zulassung evident werden. Speziell kardiologische und infektiologische Toxizitäten erfordern eine genaue Aufklärung der Patienten und eine diesbezügliche Observanz.