Translationelle Konzepte und Therapieoptimierung in klinischen Studien – Myelodysplastische Syndrome
Translationelle Konzepte
Der Kongress bot wie jedes Jahr eine Mischung aus Theorie, „Translational Research“ und klinischen Studien. Neue Erkenntnisse zu Biologie und Krankheitsmechanismen waren zu erfahren, die zum Teil bereits in Phase-I/II-Studien umgesetzt werden, deren klinischer Stellenwert aber naturgemäß noch nicht abzusehen ist.
Die modernen molekularen Methoden ermöglichen die Entwicklung einer personalisierten Medizin, dies ist insbesondere bei MDS auf Grund der großen Heterogenität und der Struktur der Patienten von besonderer Bedeutung. „Gene expression profiling“, „Next generation sequencing“, „Deep sequencing“, „Methylation profiling“ sind Schlagworte zu den eingesetzten Methoden. Eine eigene Session war dabei dem Einsatz dieser Methoden als moderne Werkzeuge zum „Molecular profiling“ gewidmet. Untersuchungsobjekte waren spezifische MDS-Typen wie CMML, Patienten mit Chromosom-7- Aberrationen oder die MDS-Stammzelle. Mittels der neuen, verfeinerten Methoden sollen neue prognostische und prädiktive Faktoren für die Klinik etabliert werden, daneben dienen sie aber der Entdeckung neuer, möglicherweise einer medikamentösen Intervention zugänglicher Pathways.
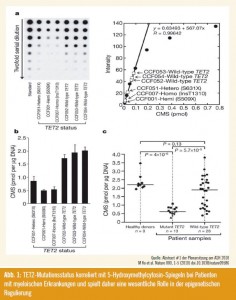
Epigenetische Regulierung mit TET2: Ein Highlight in dieser Hinsicht war die in der Plenary Session (Abstract #1) präsentierte und in der Zeitschrift Nature in Druck befindliche Arbeit zur Aufklärung der bei MDS, aber auch anderen myeloischen Erkrankungen beobachteten TET2-Mutationen. TET2 ist, wie gezeigt werden konnte, an der Umwandlung von 5-Methylcytosin zu 5-Hydroxymethylcytosin beteiligt und spielt demgemäß eine bedeutende Rolle in der epigenetischen Regulierung (Abb. 1). Bei Patienten mit Mutationen ist diese Funktion beeinträchtigt, ein Mausmodell mit Überexpression und Deletion konnte den Mechanismus einwandfrei beweisen. Interessanterweise ergibt sich bei Überexpression ein distinktes Methylierungsmuster verschiedener Promotoren mit Hypo- oder Hypermethylierung an unterschiedlichen Loci. Dieses Muster konnte auch bei MDS-Patienten gefunden werden. Die Daten bieten ein weites Feld für Forschung und neue therapeutische Entwicklungen. Insbesondere die Entwicklung einer zielgerichteten medikamentösen Beeinflussung des spezifischen Methylierungsmusters wird für die Zukunft eine Herausforderung darstellen. Weitere Präsentationen zur Genetik zeigten u.a. neue Erkenntnisse zu Genen wie ASXL-1, EZH2, UTX, zur Rolle von Micro- RNA und zur Regulation des Polycomb- Komplexes. Gemeinsam ist allen, dass sie ebenfalls einen Effekt auf epigenetische Prozesse haben, die seit kurzem auch ein Target therapeutischer Intervention darstellen.
Die Präsentationen zu Diagnostik und Patienten-Assessment wurden durch neue Daten zu Durchflusszytometrie sowie Prognose-Scores und Arbeiten zur Komorbidität abgerundet. In allen Fällen waren die Untersuchungen nicht Selbstzweck, sondern stellten eine mögliche prädiktive Rolle in den Vordergrund.
Klinische Präsentationen
Der klinische Teil der MDS-Beiträge am ASH 2010 beinhaltete zwar keine Präsentation einer Studie, die zur raschen Neuzulassung einer Substanz führen wird, beantwortete aber viele Detailfragen zur Anwendung der in den letzten Jahren eingeführten Substanzen. Followup- Daten von bereits in den Vorjahren präsentierten Studien wurden vorgestellt, Subgruppenanalysen gezeigt und eigene kleinere Studien zu praktischen Aspekten der verschiedenen Therapiemodalitäten präsentiert. Auch Kombinationstherapien verschiedener neuer Substanzen wurden erörtert.
Demethylierende Substanzen
Prädiktion des Ansprechens: Daten zum Management von Patienten unter demethylierenden Substanzen, insbesondere mit 5-Azacytidin, waren ein großer Themenbereich: Da ein Therapieansprechen erst nach einigen Zyklen beurteilt werden kann, waren prädiktive Faktoren von hohem Interesse:
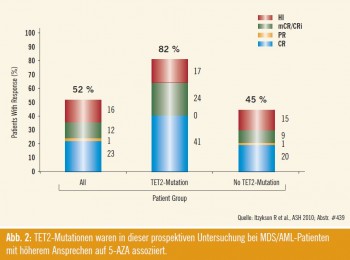
Hier wurde gezeigt, dass der Nachweis der oben erwähnten TET2-Mutation eine Bedeutung zur Vorhersage des Ansprechens auf 5-Azacytidin haben könnte (Abb. 2). Im Falle einer Validierung dieser Daten könnte dadurch eine unnötige lang dauernde Therapie bei Nonrespondern vermieden werden. Der Nachweis von TET2-Mutationen ist allerdings aufwendig und teuer, die am ASH erfolgte Aufklärung des Mechanismus könnte jedoch zur Entwicklung eines einfacheren Tests mittels Surrogatparameter führen. Als weitere prädiktive Ansätze wurden FACS-Analysen, Scores aus konventionellen MDS-Parametern (wie Blasten, Zytogenetik, Transfusionsbedarf, Performance Status) sowie Komorbidität vorgeschlagen.
Dosierung: Erneut wurde über die 5- Azacytidin-Dosierung diskutiert: Retrospektive spanische Daten sprechen für die in der AZA-001-Studie beschriebene Standarddosis von 75 mg/m2 pro Tag über 7 Tage – zumindest in der zugelassenen Indikation Hochrisiko-MDS. Zur Frage, ob nach längerer Therapie bei Vorliegen einer Remission eine Dosisreduktion oder Intervallverlängerung erfolgen kann, gibt es weiterhin keine Daten.
Seitens des Wirkmechanismus wären möglicherweise auch alternative Dosierungsschemata mit längerer Einwirkdauer sinnvoll, die subkutane Gabe limitiert dies allerdings aus praktischen Gesichtspunkten. Daten zur Dosierung mit 50 mg/m2 s.c. über 10 Tage zeigten Wirksamkeit, naturgemäß ist hier aber eine in Entwicklung befindliche orale Formulierung interessanter, von der im Rahmen einer Phase-I-Studie über eine prolongierte Gabe über 14 oder 21 Tage berichtet wurde. Erste Ergebnisse zeigen eine akzeptable Verträglichkeit bei zunächst noch präliminären Wirksamkeitsdaten, die Weiterentwicklung der Substanz ist aber sicher viel versprechend.
Therapieversagen: Ebenfalls ausgewertet wurde in mehreren Fallserien der weitere Verlauf von Patienten nach 5-Azacytidin- Versagen. Die Ergebnisse dieser Patienten sind unabhängig von den anschließend verabreichten Behandlungen generell schlecht mit kurzen Überlebenszeiten. Da weitere Therapien nach 5- Azacytidin-Versagen derzeit nur geringe Erfolgschancen haben, besteht hier eindeutig Bedarf für weitere Entwicklungen. Längeres und frühzeitigeres Ansprechen mit höheren Raten an kompletten Remissionen wäre von Kombinationstherapien zu erhoffen: als mögliche Partner für 5-Azacytidin wurden HDAC-Inhibitoren (wie Vorinostat, Entinostat oder Panobinostat) untersucht, aber auch andere Substanzen wie Lenalidomid und Erythropoetin. Die am ASH präsentierten frühen Daten sind zum Teil viel versprechend, aber naturgemäß noch unreif.
HDAC-Inhibitoren (Histondeacetylase-Inhibitoren)
Als zweiter epigenetischer Therapieansatz werden bereits seit längerem HDACInhibitoren untersucht. Hier fanden sich am ASH weitere Phase-I/II-Studien mit verschiedenen Substanzen: Viel versprechend ist zum Beispiel Panobinostat, auch wenn sich die teilweise guten Ergebnisse aus bisherigen Phase-II-Studien noch nicht in großen Studien bestätigen konnten. Die zukünftige Rolle in der Monotherapie bleibt weiter abzuwarten, vorstellbar (und von der Theorie her sinnvoll) ist ein Einsatz als Kombinationstherapie. Einzelne kleine Studien sowie das Design und Therapieschema geplanter Studien wurden diskutiert, die Ergebnisse sind allerdings noch widersprüchlich und können derzeit noch nicht abschließend bewertet werden.
Lenalidomid
Zu Lenalidomid waren 2009 die Daten der randomisierten MDS-004-Studie für Patienten mit del(5)(q) erstmals vorgestellt worden, 2010 erfolgte die Präsentation von Follow-up- Daten, die die bisherigen Ergebnisse zu hoher Effizienz und Sicherheit in diesem Setting bestätigen. Auch ein mögliches erhöhtes AML-Transformationsrisiko unter Lenalidomid wurde erneut diskutiert. In der MDS-004-Studie konnte dies nicht gesehen werden, ebenso wurden französische retrospektive Daten ohne erhöhtes Risiko präsentiert, die die Vielzahl bestehender Datensätze zu diesem Thema bestätigen.
Romiplostim
Für den TPO-Rezeptor-Agonisten Romiplostim wurden gepoolte Follow-up-Daten („extended use“) bei Respondern aus drei bereits früher vorgestellten Studien präsentiert. In allen Studien waren lediglich Niedrigrisiko-MDS-Patienten inkludiert, Romiplostim wurde alleine oder in Kombination mit Lenalidomid oder Decitabin verabreicht. Auch in der Lang zeitgabe wurde die Wirksamkeit und das Toxizitätsprofil bestätigt, Thrombozytenwerte stiegen an, Blutungsereignisse nahmen signifikant ab; die Toxizität war akzeptabel, es wurde kein über das erwartete Maß hinausgehender Krankheitsprogress beobachtet. Mit Interesse werden Ergebnisse laufender Studien zur Therapie von Hochrisiko-MDS mit Romiplostim und zur Substanz Eltrombopag erwartet.
Eisenchelation
Die bei MDS durch ineffiziente Hämatopoiese in Kombination mit Transfusionstherapie bedingte Eisenüberladung wird als pathophysiologischer Faktor für den Progress der Erkrankung in Richtung akute Leukämie diskutiert. Dazu wurde am ASH ein Mausmodell präsentiert, das diese Entwicklung nachvollzieht.
Unter Eisenchelationstherapie wurde neben der Reduktion der Eisenüberladung in Einzelfällen auch eine Verminderung des Transfusionsbedarfs beobachtet. Daher untersuchte eine Subgruppenanalyse der bereits publizierten EPIC-Studie den Anteil des hämatologischen Ansprechens unter Deferasirox. Am häufigsten wurde „erythroides Ansprechen“ beobachtet (22,6 %), die mediane Zeit bis zum Ansprechen war 113 Tage. Auch ein Ansprechen der anderen Zellreihen wurde beobachtet. Allerdings limitiert das Fehlen einer Vergleichsgruppe die Bewertung der Ergebnisse. Theoretische Modelle könnten diesen Effekt erklären, allerdings ist ein Beweis der Wirksamkeit hier ebenfalls nur durch eine placebokontrollierte Studie möglich.