Überwachung der Risikogruppen und Diagnose des HCC
Die Inzidenz des HCC steigt in den meisten Ländern der Erde an. Das HCC ist der Tumor mit der größten Zunahme in den letzten 12 Jahren; in den nächsten 20 Jahren geht man von einer weiteren Zunahme aus. Dies ist in unseren Breiten einerseits mit dem gehäuften Auftreten der chronischen Virushepatitis (v. a. Hepatitis C) assoziiert, vor allem aber der alkoholischen und nichtalkoholischen Steatohepatitis (NASH) mit Zirrhose. Eindrucksvoll ist dies an der ansteigenden HCC-Inzidenz bei Diabetikern zu sehen. Patienten mit einem einmal diagnostizierten HCC benötigen für das weitere Management ein interdisziplinäres Behandlungsteam. Für die Überwachung der Risikogruppen und die Frühdiagnostik ist jedoch der Hepatologe wegen der praktisch immer zugrunde liegenden Lebererkrankung von entscheidender Bedeutung, da diese Patienten wegen der chronischen Lebererkrankung vom Hepatologen betreut werden, was die regelmäßige Überwachung hinsichtlich des Auftretens eines HCC inkludiert.
Überwachung von Risikogruppen
Das Ziel einer Überwachung besteht in der Reduktion der HCC-assoziierten Mortalität, d. h. dass weniger Menschen an einem HCC versterben sollten. Wenn dies nicht möglich ist, sollte durch entsprechende Surveillance zumindest das Überleben der Betroffenen signifikant verlängert werden. Dies kann nur durch eine frühe Diagnostik erreicht werden, die wiederum nur durch regelmäßige Überwachung erzielt werden kann.
Die Evidenz für die HCC-Surveillance ist inzwischen ausreichend dokumentiert. In einer randomisierte Studie aus China mit 18.816 Hepatitis-B-Patienten konnte die HCC-Mortalität durch Ultraschall und AFP alle sechs Monate trotz schlechter Compliance von lediglich 60 % in der Surveillance-Gruppe um 37 % gesenkt werden. Obwohl man sich eine Bestätigung dieser Arbeit in anderen geografischen Gebieten und mit anderen Patientengruppen wünschen würde, ist dies ethisch nicht vertretbar.
HCC-Surveillance ist bereits gängige klinische Praxis und wird für bestimmte Risikogruppen klar empfohlen. Insbesondere wird dies durch die Tatsache unterstützt, dass Patienten mit einem sym p – tomatischen HCC im Gegensatz zu „frühzeitig“ entdeckten HCC mit einem 5-Jahres-Überleben von 0–10 % eine äußerst ungünstige Prognose aufweisen. Die 5-Jahres-Überlebensraten bzw. das rezidivfreie Überleben der Patientengruppe mit „kleinen“ HCC liegen sowohl für die Resektion bzw. Lebertransplantation über 50 %, sodass es klar scheint, dass in dieser Patientengruppe Überwachung die Mortalität reduzieren konnte.
Risikogruppen
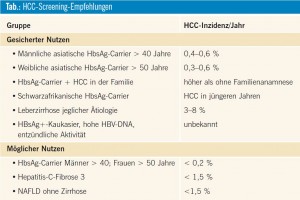
Ob ein Patient in ein Überwachungsprogramm aufgenommen werden soll, hängt ganz wesentlich von der Inzidenz innerhalb der Risikogruppe ab, ein HCC zu entwickeln. Im Folgenden sollen die einzelnen Risikogruppen dargestellt werden (Tab.).
Im Folgenden sollen die einzelnen Gruppen im Detail besprochen werden:
Hepatitis B
Für diese Patientengruppe gibt es wohl die besten Daten im Bezug auf Screening und HCC-Inzidenz. Die jährliche Inzidenz bei HbsAg-Carriern liegt bei 0,5 %/ Jahr, steigt jedoch mit dem Alter auf 1 % bei über 70-Jährigen und auf 2,5 % bei Patienten mit Leberzirrhose. Anzumerken ist hier jedoch, dass sich diese Zahlen auf asiatische Populationen beziehen. In Europa bzw. in den USA variieren die Inzidenzzahlen ganz erheblich. In Europa entwickeln sich HCC vornehmlich bei HbsAg-Carriern mit bereits etablierter Zirrhose. Dies trifft jedoch nicht für asiatische Patienten zu, bei denen unabhängig von der HBV-Replikation, ja selbst nach HbsAg loss ein signifikantes HCCRisiko besteht.
Aus diesen Daten leitet sich die Empfehlung ab, asiatische Patienten ab dem 40. (Männer) bzw. ab dem 50. (Frauen) Lebensjahr zu screenen.
Möglicherweise spielt auch der HBV-Genotyp eine Rolle, es scheint der Genotyp C mit einem erhöhten HCC-Risiko einherzugehen. Möglicherweise werden sich Risikoscores bewähren, die Faktoren wie Alter, Geschlecht, Viruslast, Mutationen, Vorhandensein einer Zirrhose berücksichtigen und so helfen, Patienten zu identifizieren, die in ein entsprechendes Überwachungsprogramm aufgenommen werden sollten.
Hepatitis C
Das höchste Risiko (2–8 %), eine HCC zu entwickeln, weisen Patienten auf, die eine HCV-Zirrhose entwickelt haben, sodass allen Patienten mit etablierter HCVZirrhose ein entsprechendes Screening empfohlen werden muss. Im Halt-C-Trial wurde die 5-Jahres-Inzidenz, ein HCC in einer nichtzirrhotischen Leber zu entwikkeln, mit 4,8 % angegeben und liegt somit unter der für eine Screening-Untersuchung geforderten Inzidenz von 1,5 %/ Jahr. Möglicherweise könnten auch hier „nichtinvasive Fibrosemarker“ (Thrombozytenzahl < 100.000) oder Risikoscores (Alter; Varizenstatus, Thrombozytenzahl, alkalische Phosphatase) helfen, Risikogruppen zu definieren, die einer besonderen Überwachung bedürfen.
Nichtvirale Leberzirrhose
In diesem Kollektiv gibt es von einigen Ausnahmen abgesehen wenige Daten.
• Die alkoholische Leberzirrhose (ALD) stellt einen klar definierten Risikofaktor dar. Bis zu einem Drittel der HCC sind durch ALD verursacht. In einer österreichischen Arbeit stellt die ALD bei 35 % der Patienten mit HCC den alleinigen Risikofaktor dar, sodass auch in dieser Gruppe ein Screening empfehlenswert scheint.
• Nichtalkoholische Steatohepatitis (NASH): Bislang gibt es keine Studien, die die HCC-Inzidenz in dieser Patientengruppe definieren.
In einer Arbeit wiesen 20 % der Patienten einen Diabetes mellitus als einzigen möglichen Risikofaktor für ein HCC auf; auch konnten NAFLD-Patienten in HCCKohorten identifiziert werden. Bislang gibt es allerdings nicht genug Daten, um ein generelles Screening in diesen Kohorten zu empfehlen.
Patienten mit einer idiopathischen Hämochromatose mit etablierter Zirrhose weisen ein HCC-Risiko von 2–4 %/Jahr auf und sollten somit einer Überwachung zugeführt werden. Patienten mit einer primär biliären Zirrhose Stadium 4 sollten ebenfalls in ein Screening-Programm aufgenommen werden, da bei ihnen die HCC-Inzidenz bei ca. 2–8 %/ Jahr liegt.
Ebenso sollten alle Patienten auf der Transplantliste einem Surveillance-Programm zugeführt werden.
Wie soll gescreent werden?
Prinzipiell stehen zur Überwachung serologische (AFP) und bildgebende Verfahren zur Verfügung.
Zur Tumor-Surveillance ist der AFP-Spiegel alleine sicher inadäquat. In mehreren Arbeiten, zuletzt im Halt-C-Trial, konnte die schlechte Performance bestätigt werden. Auch andere serologische Tests wie DCP oder Alpha-Fucosidase, Glypican 3 und HSP-70 konnten in der Überwachung von Risikopatienten bislang keinen klaren Vorteil zeigen. Der Ultraschall ist jene bildgebende Untersuchungsmethode, die am häufigsten eingesetzt wird. Die Sensitivität beträgt zwischen 65 und 80 %, die Spezifität wird mit über 90 % angegeben und ist somit derzeit die beste Screening-Methode. Auch wenn die diagnostische Sicherheit nicht ideal ist, so ist sie jedoch besser als jeder serologische Test. Die größten Schwierigkeiten weist der Ultraschall in der Untersuchung von fettleibigen Patienten auf, bislang sind auch in dieser Gruppe keine alternativen bildgebenden Verfahren adäquat evaluiert. Auch sei an dieser Stelle auf die hohe Strahlenbelastung durch CT-Screening hingewiesen.
Die Kombination Lebersonografie und AFP erhöht die HCC-Detektionsrate, aber auch – neben den Kosten – die falsch positive Rate mit bis zu 7,5 %.
Wie oft soll untersucht werden?
Als Überwachungsintervall werden 6 (Hepatitis B) und 6–12 Monate (Hepa – titis C) aufgrund der Tumorverdopplungszeit angegeben. Generell sollte man bei entsprechender Risikopopulation ein 6-monatiges Screening empfehlen.
Sollte ein Patient in einer Screening-Untersuchung auffällig werden, ist ein sorgsames Aufarbeiten der Situation mit entsprechender Diagnostik jedenfalls notwendig.
Empfehlungen:
• Surveillance sollte mittels Ultraschall erfolgen.
• Risikogruppen sollten sich alle sechs Monate einer Untersuchung unterziehen.
• Patienten mit einem hohen HCC-Risiko benötigen keine kürzeren Screening-Intervalle.
Diagnose des HCC
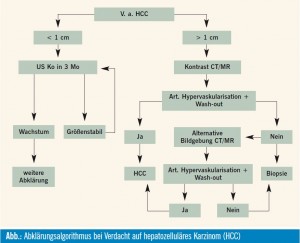
Verdächtige sonografische Raumforderungen in einer zirrhotischen Leber sollten entsprechend dem Abklärungsalgorithmus (Abb.) abgeklärt werden.
Bedeutung des Alpha-Fetoproteins: Alpha- Fetoprotein wurde lange zur Diagnostik des HCC herangezogen, leider weist der AFP-Spiegel keine ausreichende Sensitivität und Spezifität auf. Zudem kann der AFP-Spiegel auch bei cholangiozellulären Karzinomen bzw. bei manchen Metastasen bei kolorektalen Karzinomen erhöht sein. Aus diesen Gründen spricht ein erhöhter AFP-Spiegel und eine Leberraumforderung nicht automatisch für ein HCC, sodass die Diagnose eines HCC mit radiologischen bzw. histologischen Kriterien gestellt werden muss.
Radiologische Diagnostik des HCC: Die Diagnose eines HCC kann auf Basis von Radiologie alleine, ohne histologische Abklärung erfolgen. Voraussetzung dafür ist jedoch, dass sich typische bildgebende Charakteristika finden, wofür eine dynamische Kontrastuntersuchung (CT oder MR) notwendig ist. In der arteriellen Phase kommt es aufgrund der fehlenden venösen Gefäße im HCC zu einer vermehrten Anflutung in der Tumorläsion. Wegen der fehlenden portalen Gefäßanbindung des HCC kommt es anschließend in der venösen Phase zu einem vermehrten „Wash-out“.
In der Spätphase bleibt der Wash-out erhalten bzw. ist eben dieser Wash-out manchmal nur in der Spätphase zu sehen. Aus diesen Gründen ist jedenfalls eine 4-Phasen-Untersuchung mit nativer, arterieller, venöser und Spätphase zur Diagnostik des HCC zu fordern.
Die radiologische Diagnostik ist in der HCC-Diagnostik von immenser Bedeutung, umso wichtiger scheint es, dass die Untersuchung mit etablierten radiologischen Protokollen (Kontrastmittelmenge, definierte Schichtdicke, Timing der Phasen) durchgeführt wird. Der anfordernde Arzt muss sicher sein, dass diese Diagnostik adäquat einem Protokoll entsprechend durchgeführt wird.
Klarerweise sind diese Abklärungsalgorithmen nicht unfehlbar, sicherlich werden falsch negative radiologische Befunde auftreten, jedoch sollten diese Tumoren im Follow-up diagnostiziert werden, noch bevor sich die Behandlungsoptionen für den Patienten signifikant verschlechtern.
Schwierigkeiten können nach wie vor die so genannten „hypovaskularisierten“ HCC bereiten. Dies betrifft jedoch ausschließlich Tumoren < 2 cm, histologisch findet sich bei diesen Tumoren neben einer arteriellen Versorgung auch noch eine portale Blutversorgung (somit kommt es zu einer fehlenden arteriellen Hypervaskularisation in der Bildgebung). Mit zunehmendem Tumorwachstum verschwindet diese Besonderheit jedoch, und die Läsionen weisen wiederum typische diagnostische Kriterien auf.
Pathologische Diagnose von dysplastischen Knoten und „early HCC“: Die pathologischen Merkmale von hochdifferenzierten und weiter fortgeschrittenen HCC sind gut definiert und bedürfen an dieser Stelle keiner weiteren Diskussion. Durch eine konsequente Tumor-Surveillance werden jedoch immer kleinere HCC sowie dysplastische Regeneratknoten entdeckt. Je kleiner die Läsionen sind, desto schwieriger ist die Unterscheidung zwischen benigne und maligne, dies trifft sowohl für die radiologische wie auch für die histologische Diagnostik zu.
Kürzlich wurde von japanischen Pathologen der Begriff „very early HCC“ eingeführt: Sie beschreiben das „very early HCC“ als generell hypovaskularisiert mit dysplastischen Zellen. Diese Beschreibung erklärt auch die häufig fehlende arterielle Anflutung im CT bzw. im MRI. Wichtig scheint es, dass zwischen dysplastischen Knoten und HCC ein Kontinuum besteht. Immunhistologische Diagnostik (CD34, CK7, Glypican 3, HSP- 70, Glutamin-Synthetase) kann die diagnostische Sicherheit erhöhen.
Abklärungsalgorithmus (Abb.)
Bei Läsionen < 1 cm sollte zunächst keine extensive Diagnostik vorangetrieben werden, insbesondere aufgrund der Tatsache, dass es sich bei den meisten dieser Läsionen um Regeneratknoten und nicht um HCC handelt. Nichtsdestotrotz sollte ein dreimonatiges Follow-up mit jener bildgebenden Technik durchgeführt werden, mit der die Läsion initial entdeckt wurde.
Läsionen > 1 cm sollten mittels MRI oder Multidetector-CT abgeklärt werden, die Kontrastmittelsonographie ist weniger spezifisch und sollte aus diesen Grund nicht mehr zur Diagnostik herangezogen werden. Zeigen sich im CT oder MR typische HCC-Merkmale, so steht die Diagnose bereits, und es bedarf keinerlei zusätzlicher Abklärung.
Zeigen sich keine typischen HCC-Merkmale, so sind zwei Strategien denkbar: zum einen eine alternative (bisher nicht durchgeführte) Bildgebung mittels CT oder MRI – wenn sich dabei typische HCC-Merkmale zeigen, kann somit die Diagnose gestellt werden; zum anderen könnte alternativ eine atypische Bildgebung zu einer bioptischen Abklärung führen, welche jedenfalls dann durchgeführt werden sollte, wenn beide Bildgebungen (CT + MRI) keine eindeutige HCC-Diagnose erlauben.
Mit den hier vorgestellten Überwachungsstrategien bei Risikogruppen bzw. den entsprechenden diagnostischen Abklärungsmechanismen sollte es möglich sein, Patienten frühzeitig zu entdecken und sie nach entsprechendem Staging einer möglichst kurativen Therapieoption zuzuführen.
FACT-BOX
• Alle Patienten mit bestehender Leberzirrhose, unabhängig von der Ätiologie, sollten einem entsprechenden Screening- Programm zugeführt werden.
• Die Überwachung erfolgt primär mit 6-monatigen Ultraschall-Untersuchungen.
• Bei auffälligem Ultraschallbefund soll eine weitere Abklärung mittels Kontrast-CT/MR erfolgen.
• Läsionen < 1 cm müssen primär nicht weiter abgeklärt, sondern in drei Monaten kontrolliert werden.
• Bei typischen radiologischen Kriterien kann die Diagnose HCC primär ohne histologische Bestätigung erfolgen.
• Histologische Abklärung ist nur bei unklarer Radiologie zu fordern.