Die Pathologie: Schlüssel zur Therapie des Ovarialkarzinoms
Die Diagnose von Ovarialkarzinomen wird typischerweise intraoperativ mittels Schnellschnitt gestellt, da, abgesehen von Tumoren mit Peritonealkarzinose, eine präoperative Gewebsdiagnostik mittels Biopsie obsolet ist. Das Ergebnis des Schnellschnittes entscheidet somit unter anderem über die Ausdehnung der Operation.
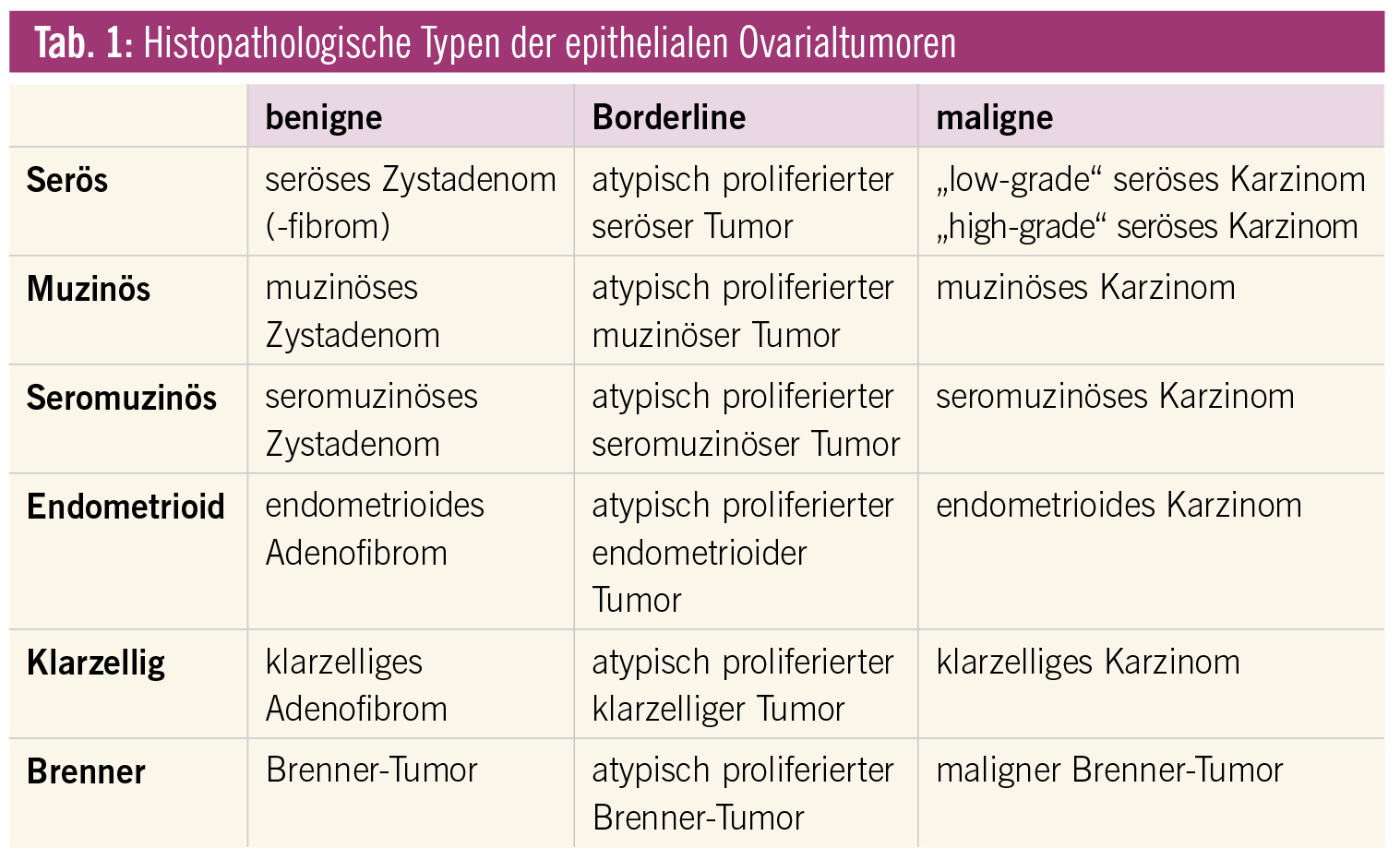
Die histopathologische Typisierung der Ovarialkarzinome, die zu den epithelialen Ovarialtumoren zählen, erfolgt auf Basis der WHO-Klassifikation, die 2014 auf der Grundlage neuer molekularpathologischer Erkenntnisse überarbeitet wurde (Tab. 1). Die epithelialen Ovarialtumoren entwickeln sich nach den derzeit gültigen histogenetischen Konzepten in erster Linie aus Einschlüssen des Tubenepithels aus dem Bereich des Fimbrienendes in das Ovar, zum Teil mit weiterführender Differenzierung, sowie aus Endometrioseherden, die insbesondere durch eine retrograde Menstruation entstehen. Bei der reifen Frau sind die epithelialen Ovarialtumoren mit 70–80 % gegenüber den Keimstrangstromatumoren und den Keimzelltumoren wesentlich häufiger. Von den primären epithelialen Ovarialtumoren sind Karzinommetastasen abzugrenzen, die mit zunehmendem Alter gehäuft vorkommen können. Die meisten epithelialen Ovarialtumoren sind zystisch gebaut, seltener sind sie exophytisch entwickelt und sitzen dem Ovar als papilläre Läsionen auf. Die häufigsten epithelialen Ovarialtumoren (etwa 50 %) sind serös differenziert, gefolgt von den muzinösen Tumoren mit einer Häufigkeit von etwa 30 %. Endometrioide, klarzellige Tumoren und Brenner-Tumoren sind demgegenüber selten. Die Gruppe der seromuzinösen Tumoren, die aus einer Mischung seröser und muzinöser Epithelien bestehen, wurde 2014 neu in die WHO-Klassifikation aufgenommen, dafür wurde der endozervikale Typ der muzinösen Tumoren gestrichen. Über die Häufigkeit seromuzinöser Tumoren liegen keine verlässlichen Daten vor. Auf Basis des biologischen Verhaltens werden benigne (Zystadenome, Zystadenofibrome, Oberflächenpapillome), maligne (Adenokarzinome) und Tumoren mit unsicherem biologischen Verhalten (atypisch proliferierte oder Borderline-Tumoren) unterschieden.
Molekulare Pathologie und Tumorgenese
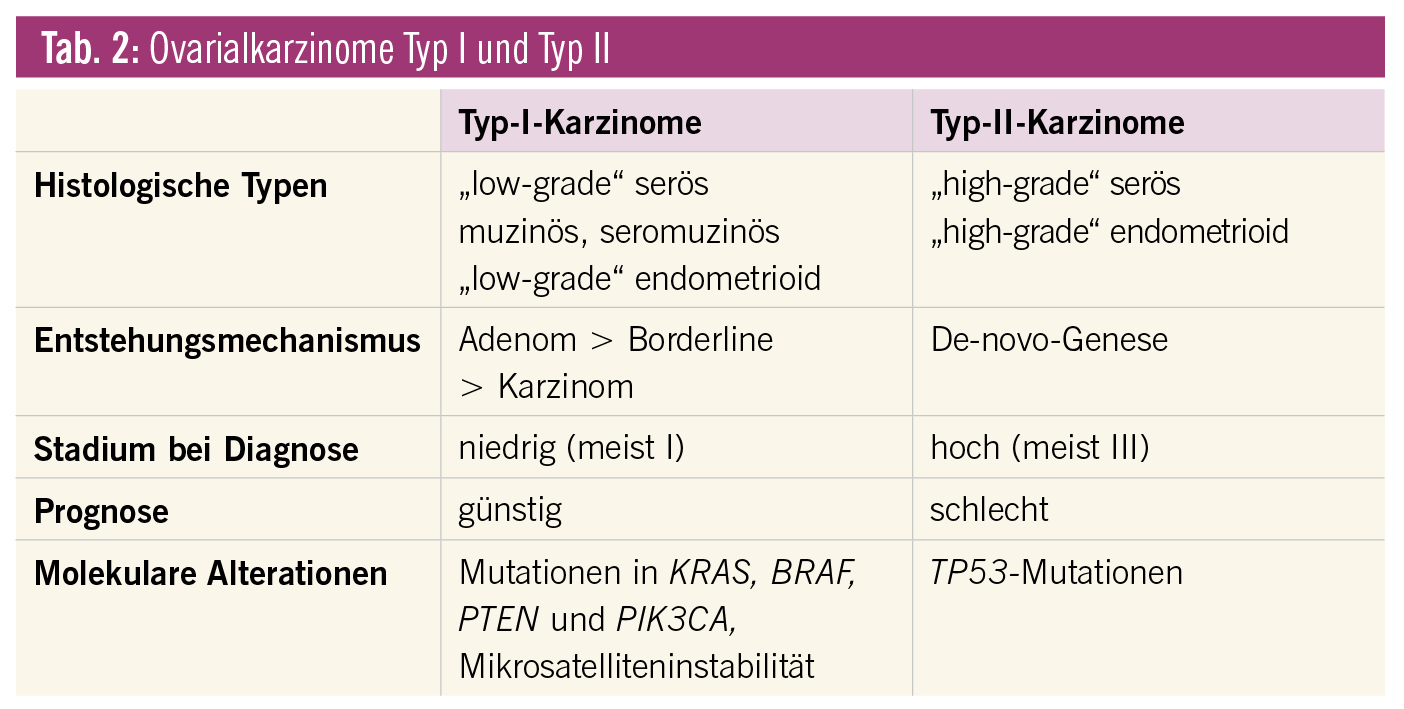
Pathogenetisch gibt es für Karzinome zwei wesentliche Entstehungsmechanismen: Gut differenzierte („low-grade“) seröse, muzinöse und endometrioide Karzinome entwickeln sich über die Zwischenstufe von Borderline-Tumoren (Typ I), schlecht differenzierte („high-grade“) seröse Karzinome de novo (Typ II) (Tab. 2). Die beiden Typen unterscheiden sich wesentlich in ihrem klinischen Verhalten. Typ-I-Karzinome verlaufen symptomarm und werden oft zufällig und im Stadium I diagnostiziert, während sich Typ-II-Karzinome mit akuten Symptomen präsentieren und ein meist bereits fortgeschrittenes Stadium aufweisen.
Typ-I- und Typ-II-Karzinome weisen auch unterschiedliche genetische Alterationen auf: Bei den niedrig differenzierten serösen, aber auch bei den niedrig differenzierten endometrioiden Karzinomen finden sich häufig p53-Mutationen, während Borderline-Tumoren und hoch differenzierte seröse Karzinome häufig KRAS- und BRAF-Mutationen sowie eine Mikrosatelliteninstabilität, jedoch nur selten p53-Mutationen aufweisen. Die Häufigkeit genetischer Alterationen und die genomische Instabilität nehmen in Karzinomen gegenüber Zystadenomen und Borderline-Tumoren zu. Die einzelnen histologischen Typen des Ovarialkarzinoms zeigen unterschiedliche Entstehungsmechanismen. Die serösen Tumoren scheinen sich aus Einschlusszysten zu entwickeln, deren Epithel wahrscheinlich aus dem Bereich des Fimbrienendes der Tube stammt. Die häufigen niedrig (schlecht) differenzierten serösen Ovarialkarzinome entwickeln sich wahrscheinlich meist aus einem In-situ-Karzinom des Tubenepithels, das als STIC (seröses intraepitheliales Karzinom der Tube) bezeichnet wird („high-grade path-way“: Typ II). Die selteneren hoch (gut) differenzierten serösen Karzinome entwickeln sich aus Zystadenomen über die Zwischenstufe eines Borderline-Tumors, entsprechend einer Adenom-Karzinom-Sequenz („low-grade pathway“: Typ I). Eine Adenom-Karzinom-Sequenz kennt man auch bei den muzinösen und den endometrioiden Karzinomen. Muzinöse Karzinome entstehen typischerweise auf dem Boden muzinöser Zystadenome über Borderline-Tumoren, endometrioide Karzinome aus endometrioiden Zystadenomen über Borderline-Tumoren oder Endometriosezysten.
Atypisch proliferierte (Borderline-)Tumoren
Die Borderline-Tumor-Kategorie ist eine Besonderheit der epithelialen Ovarialtumoren und umfasst eine Gruppe von Tumoren, die durch zelluläre Atypien charakterisiert sind, die am ehesten mit einer intraepithelialen Neoplasie oder Dysplasie vergleichbar sind. Obwohl der Begriff Borderline in der Gynäkologie stark verwurzelt ist, sollte bevorzugt die Bezeichnung atypisch proliferierte Tumoren verwendet werden. Da im Gegensatz zu Karzinomen ein invasives Wachstum fehlt, sind Borderline-Tumoren grundsätzlich gutartig. Bei etwa 10–15 % der serösen und seromuzinösen Borderline-Tumoren können aber oft erst nach vielen Jahren Rezidive auch in Form invasiver Karzinome auftreten.
Seröse Borderline-Tumoren mit mikropapillärer Morphologie nehmen eine Sonderstellung ein, da sie häufiger mit einer Invasion sowie mit extraovariellen Läsionen (zum Teil mit Invasion) einhergehen als konventionelle Borderline-Tumoren. Daher werden sie auch als spezielle, frühe Form gut differenzierter („low-grade“) seröser Karzinome angesehen und können alternativ als nichtinvasive „low-grade“ seröse Karzinome bezeichnet werden. Die Gefahr dieser Terminologie besteht aber in einer möglichen Überbehandlung dieser Tumoren, solange es keine spezielle therapeutische Option gibt. Die histomorphologischen Unterschiede beziehen sich auf eine starke epitheliale Proliferation mit Ausbildung mikropapillärer Strukturen, während beim klassischen Borderline-Tumor plumpe Papillen mit astartiger Verzweigung vorliegen.
Molekulare Typisierung der Ovarialkarzinome durch Immunhistochemie
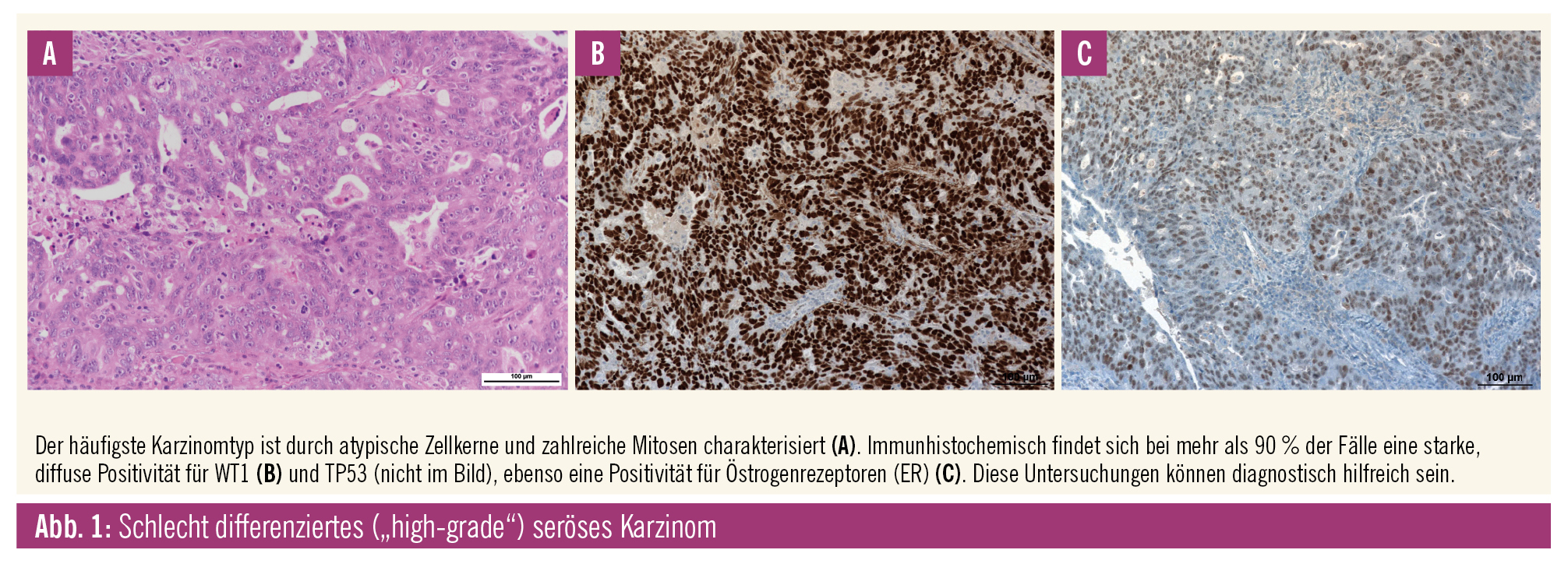
Die exakte Klassifikation der Ovarialkarzinome erfordert in einem Teil der Fälle die Durchführung immunhistochemischer Untersuchungen, da sich die Haupttypen in ihrem immunreaktiven Profil ganz wesentlich unterscheiden. Dies ist in Tabelle 3 zusammengefasst; Abbildung 1A–C zeigt Charakteristika des schlecht differenzierten („high-grade“) serösen Karzinoms. Östrogenrezeptoren und WT-1 zählen zu den wesentlichen zu untersuchenden Parametern. Muzinöse Ovarialtumoren zeigen eine unterschiedliche Expression von Zytokeratin (CK-)7, CK20 und CDX2. Häufig finden sich eine Koexpression von CK7 und CK20 und eine Positivität für CDX2. Die seromuzinösen Tumoren zeigen im Gegensatz zu den muzinösen Tumoren eine Positivität für Östrogenrezeptoren und sind teilweise positiv für WT-1. Seromuzinöse Karzinome ähneln immunhistochemisch, insbesondere, wenn WT1-negativ, aber auch durch ihre Assoziation mit Endometriose endometrioiden Karzinomen. Es wurde daher deren Existenz als eigene Kategorie infrage gestellt, aber auch eine Umbenennung in Müller’sche Tumoren diskutiert. Transitionalzellige (TCC) Karzinome werden von der WHO nicht mehr angeführt, da sie von „high-grade“ serösen Karzinomen nicht unterschieden werden können. Vielmehr gibt es eine Subgruppe der „high-grade“ serösen Karzinome, die ein transitionalzelliges Muster aufweisen. Ein Teil dieser Tumoren ist gehäuft mit BRCA-Keimbahnmutationen assoziiert.

Differenzialdiagnose: Abgrenzung von Metastasen wesentlich
Für Metastasen sind die Bilateralität und der kleine Durchmesser typisch, der in der Regel unter 10 cm beträgt, wobei diese Regel von einem Teil der Fälle gebrochen wird. Am häufigsten finden sich in den Industrieländern Metastasen von Adenokarzinomen aus dem Dickdarm. Seltener sind Metastasen von Karzinomen der Mamma, des Magens und anderer Organe des oberen Gastrointestinaltraktes. Für die Abgrenzung gegenüber Metastasen ist die Immunhistochemie hilfreich, allerdings nicht in allen Fällen zielführend. Muzinöse Ovarialtumoren zeigen meist eine kräftige Immunreaktivität für CK7 und eine variable Immunreaktivität für CK20 und CDX2, wodurch sie sich gut von Metastasen aus dem Dickdarm unterscheiden. Muzinöse Tumoren, die mit einem Teratom assoziiert sind, zeigen hingegen ein Immunprofil, das jenem von Dickdarmkarzinomen ähnelt (CK7 meist negativ, CK20 und CDX2 positiv). Deshalb ist in einer derartigen Konstellation eine Abgrenzung zu Metastasen aus dem Dickdarm schwierig. Metastasen von Tumoren aus dem oberen Gastrointestinaltrakt wiederum können schwer von primären muzinösen Ovarialtumoren abgegrenzt werden.
Grading von Ovarialkarzinomen
Es gibt verschiedene Gradingsysteme, jenes von Silverberg und Shimizu, das für alle Karzinomtypen verwendet werden kann, jenes von Malpica und Silva (MD Anderson) speziell für seröse Karzinome. Ersteres berücksichtigt Architektur, Kernatypie und Mitosegehalt und ist dreistufig, Letzteres beruht auf Kernatypie und Mitosegehalt und ist zweistufig. Klarzellige Karzinome werden nach WHO nicht graduiert, eine japanische Gruppe hat kürzlich ein eigenes Gradingsystem vorgeschlagen.
Genetik der Ovarialkarzinome
Bei familiärer Belastung ist die Wahrscheinlichkeit, ein Ovarialkarzinom zu entwickeln, bis zu 20-mal höher als im Normalfall. Etwa 5 bis 10 % aller Ovarialkarzinome sind als hereditär einzustufen. In Familien mit gehäuftem Vorkommen von Mamma- und Ovarialkarzinomen finden sich häufig Keimbahnmutationen der BRCA1- bzw. -2-Gene. Ovarialkarzinome mit BRCA1- bzw. -2-Mutationen im Tumor oder in der Keimbahn sind überwiegend serös, seltener endometrioid differenziert, muzinöse Karzinome und Borderline-Tumoren sind ungewöhnlich. Etwa ein Drittel der BRCA1/2-Mutationen in Ovarialkarzinomen sind rein somatisch, d. h. nicht mit einer Keimbahnmutation und somit einer hereditären Komponente vergesellschaftet. Der mit dem Ausfall des BRCA1/2-Gens verbundene Defekt in der DNA-Reparatur mittels homologer Rekombination wird insofern therapeutisch genützt, als PARP-Inhibitoren zur vollständigen Blockierung der DNA-Reparatur eingesetzt werden können. Die Pathologie hat eine große Bedeutung in der Bestimmung von BRCA1/2-Mutationen im Tumorgewebe. Auch das HNPCC-(Lynch-)Syndrom kann mit Ovarialkarzinomen assoziiert sein, die aber überwiegend der Gruppe der endometrioiden und klarzelligen Karzinome angehören.
Intraoperative Diagnostik: Schnellschnitt
Bei der intraoperativen Schnellschnittdiagnostik stehen die Bestimmung der Dignität und der Ausschluss von Metastasen im Vordergrund. Da aus zeitlichen Gründen nur eine begrenzte Anzahl von Proben untersucht werden kann und Zusatzuntersuchungen nicht möglich sind, hat die Schnellschnittdiagnostik allerdings ihre Grenzen. Die Ergebnisse der Schnellschnittuntersuchung variieren abhängig vom Tumortyp. Die Diagnostik eines schlecht differenzierten („high-grade“) serösen Karzinoms ist bei mehr als 90 % der Fälle möglich, die Diagnostik eines Borderline-Tumors bei etwa 80 % der Fälle. Die Diagnose von Metastasen gelingt allerdings nur bei etwa der Hälfte der Fälle.
Resümee
Bei der Typisierung der Ovarialkarzinome als therapeutische Grundlage kommt der Immunhistochemie eine wesentliche Rolle zu. Die intraoperative Diagnostik mittels Gefrierschnitt ist für den weiteren Operationsablauf oft entscheidend, präoperative Biopsien von Ovarialtumoren sind obsolet. Ovarialkarzinome kommen im Rahmen des erblichen Brust- und Eierstocksyndroms (BRCA1/2), aber auch des HNPCC/Lynch-Syndroms deutlich gehäuft vor.