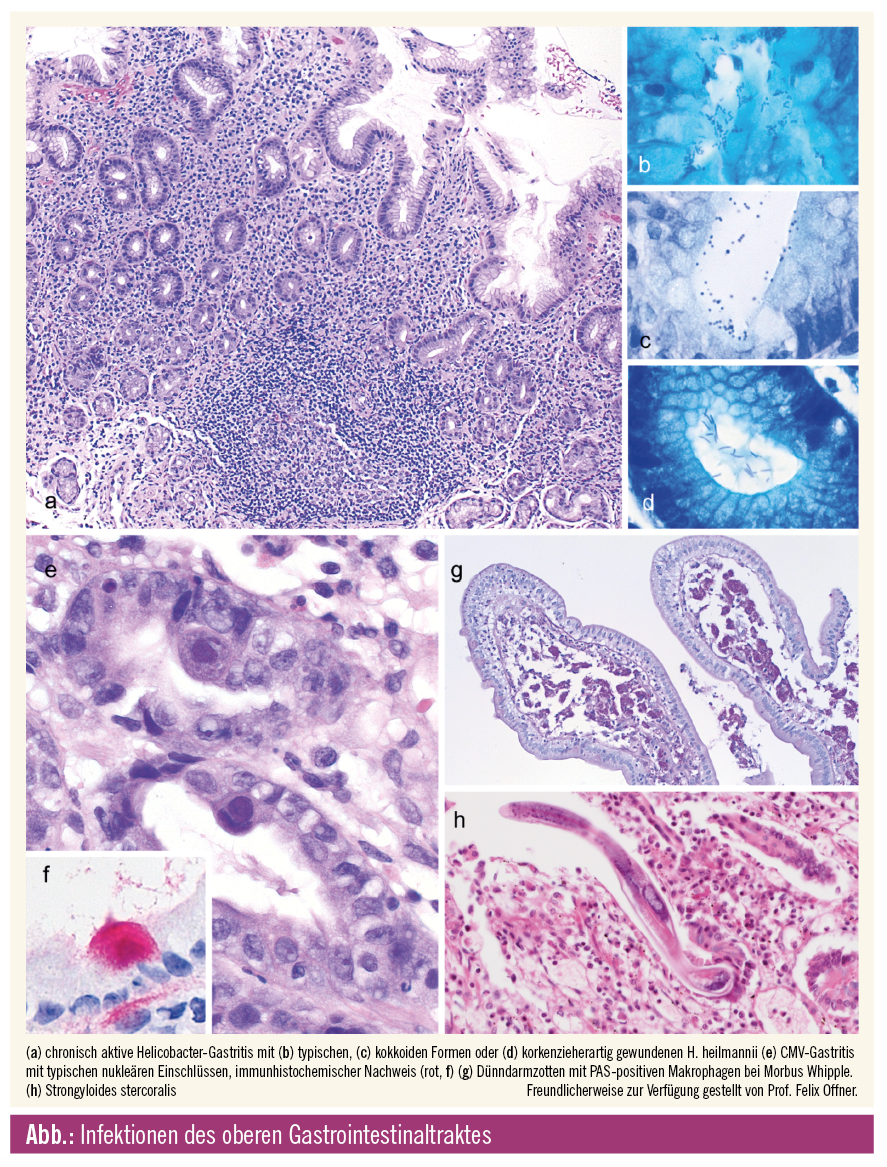
Infektionen des oberen Gastrointestinaltraktes
Der obere Gastrointestinaltrakt ist direkt mit der Außenwelt verbunden und ist daher naturgemäß durch alles, was der Mensch zu sich nimmt, einer großen Belastung durch Mikroben ausgesetzt. Aus praktischer Sicht der Pathologie kann man Infektionen allgemein in drei Gruppen einteilen: 1) häufige, durch alltägliche Erreger ausgelöste Infektionen, 2) häufige, aber nicht alltägliche Infektionen und 3) seltene oder ungewöhnliche Infektionen, mit denen Pathologen manchmal weniger vertraut sind.1
Die morphologische Diagnose einer Infektionskrankheit beruht auf dem Entzündungsmuster zusammen mit dem Nachweis des Erregers. Helminthen, Protozoen und Pilze lassen sich konventionell histologisch gut erkennen. Bakterien sind ebenfalls histologisch sichtbar, die Unterscheidung der verschiedenen Bakterienformen ist allerdings schwierig. Viren liegen formal unter der Nachweisgrenze des Lichtmikroskops, da sie aber als intrazelluläre Erreger häufig zu einer morphologischen Veränderung der Zelle führen, können sie durchaus im Mikroskop gesehen werden. Neben konventioneller Histologie und Spezialfärbungen (PAS, Ziehl-Neelsen, Versilberungen) sind Zusatzmethoden heute wichtige diagnostische Hilfsmittel. Die Immunhistochemie ist im Prinzip die beste Technik, weil sie eine Zuordnung zu der begleitenden Entzündung erlaubt und für viele Erreger gibt es heute kommerziell erhältliche monoklonale Antikörper. Molekularpathologische Untersuchungen, v. a. die Polymerase-Kettenreaktion (PCR), sind ebenfalls weit verbreitet.2 Durch die hohe Sensitivität der PCR muss allerdings berücksichtigt werden, dass der Nachweis gewisser Keime, welche auch als Kommensalen vorkommen können, eine Erkrankung nicht unbedingt beweist. Andererseits hat auch die PCR, besonders am formalinfixierten und paraffineingebetteten Gewebe eine begrenzte Sensitivität.
Im Folgenden sollen einige Beispiele von Infektionen des oberen Gastrointestinaltraktes besprochen werden.
Häufige, alltägliche Infektionen
Helicobacter-Gastritis: Die Helicobacter-Gastritis ist die häufigste Infektion des oberen Gastrointestinaltraktes und manifestiert sich histologisch als chronische aktive Gastritis und ist typischerweise im Antrum stärker ausgeprägt. Der histologische Nachweis der Erreger ist in den meisten Fällen unproblematisch und hoch sensitiv. Zusatzuntersuchungen wie z. B. die modifizierte Giemsa-Färbung erleichtern den Nachweis. Helicobacter-Bakterien können in verschiedenen Formen wie kokkoiden Varianten oder in der Korkenzieherform von Helicobacter heilmannii (Abb. a–d) vorliegen. Bei chronisch aktiver Gastritis ohne Nachweis von Helicobacter-Bakterien stellt sich aber die Frage, inwieweit der Erreger nicht erfasst wurde oder ob es sich effektiv um H.-pylori-negative Gastritis handelt. Gründe für falsch negative Untersuchungen sind z. B. spärliches Biopsiematerial oder die Einnahme von Protonenpumpenhemmern. Eine mögliche Technik zum Nachweis ist die Immunhistochemie; die Verbesserung der Sensitivität ist allerdings weniger als 10 %. In einer eigenen Untersuchung haben wir prospektiv eine PCR für H. pylori bei morphologisch verdächtigen Biopsien ohne Erregernachweis untersucht; dabei konnte bei mehr als 40 % der histologisch verdächtigen Biopsien H.-pylori-DNA mittels PCR nachgewiesen werden, aber nicht in entzündungsfreien Magenbiopsien.3
Soorösophagitis: Die Soorösophagitis zeigt sich endoskopisch als grau-weiße oder schmutzige Plaques vor allem im mittleren Ösophagusdrittel. Candidainfektionen treten gehäuft bei immunsupprimierten Patienten auf, können aber auch beim Immunkompetenten vorkommen. Eine geeignete Biopsie zeigt eine typische Schichtung mit oberflächlichen Pseudohyphen und Sporen, einer Schicht abgeschilferter und degenerierter Plattenepithelien mit infiltrierenden Pseudohyphen und basal eine gemischte, meist granulozytäre Entzündung. Bei oberflächlichen Biopsien kann die Entzündung vollständig fehlen. Andererseits sollte in Ösophagusbiopsien mit oberflächlicher granulozytärer Entzündung unbedingt aktiv nach Pilzen gesucht werden. In der HE-Färbung kann die Diagnose schwierig sein, die PAS-Färbung erlaubt eine rasche und sichere Diagnose. Schließlich sei darauf hingewiesen, dass bei Verdacht auf eine Soorösophagitis in der Endoskopie bei negativer Biopsie unbedingt weitere Schnittstufen durchgeführt werden sollten, weil die Sensitivität der endoskopischen Diagnose hoch ist.
Häufige, aber nicht alltägliche Infektionen
Mykobakteriose: Die Tuberkulose ist in den letzten Jahren in Europa wieder im Vormarsch. Der Magen-Darm-Trakt ist etwa bei 3–5 % der extrapulmonalen Tuberkulose betroffen v. a. im Ileozökalbereich.4 Der obere Gastrointestinaltrakt ist deutlich seltener betroffen und tritt dann meistens in Zusammenhang mit einer schweren, ausgedehnten Erkrankung auf. Weil dies aber dem Pathologen häufig nicht bekannt ist, sollte bei einer granulomatösen Entzündung, namentlich wenn Nekrosen auftreten, immer an eine Tuberkulose gedacht werden. Entscheidend ist natürlich der Erregernachweis. Mittels klassischer Färbungen (z. B. Ziehl-Neelsen) gelingt der Nachweis allerdings selten, wenn möglich, sollte immer eine PCR-Untersuchung durchgeführt werden.
Zytomegalovirus (CMV): CMV ist ein typischer Erreger des immunsupprimierten Patienten. Dabei sollte nicht vergessen werden, dass neben der klassischen Immunsuppression wie z. B. nach Transplantation, auch andere Formen der Immunsuppression wie Steroidtherapie oder Biologika z. B. im Rahmen einer Autoimmunerkrankung mit einer erhöhten Infektanfälligkeit einhergehen. CMV kommt im oberen Gastrointestinaltrakt am häufigsten im Magen vor und kann hier sowohl die Magenepithelien wie auch das Granulationsgewebe, hier v. a. das Endothel befallen. Die typische Morphologie mit vergrößerten Zellen, Kerneinschlüssen, der unregelmäßigen, verbreiterten Kernmembran sowie zytoplasmatischen granulären Einschlüssen ist v. a. in den Epithelien zu sehen (Abb. e–f). In den mesenchymalen Zellen des Granulationsgewebes sind die Veränderungen manchmal weniger deutlich, und generell wird eine immunhistochemische Zusatzuntersuchung empfohlen, um die Sensitivität wie auch die Spezifität zu erhöhen. Das Plattenepithel des Ösophagus ist praktisch nie befallen, wohl aber das Granulationsgewebe bei ulzeröser Ösophagitis.
Seltene oder ungewöhnliche Infektionen
Morbus Whipple: Der Morbus Whipple ist eine seltene Erkrankung, der Häufigkeit zwischen 1–3 pro 106 Einwohnern liegt.5 Im Gegensatz zum Morbus Whipple aber ist der Erreger, Tropheryma whipplei, recht häufig und kann bei bis zu 11 % der Stuhlproben nachgewiesen werden. Diese Diskrepanz entsteht dadurch, dass für die Entwicklung des Morbus Whipple eine genetische Prädisposition vorliegen muss. Diese diagnostische Unterscheidung ist wichtig, da der alleinige Nachweis von T.-whipplei-DNA mittels PCR nicht ausreicht, um die Diagnose des Morbus Whipple zu stellen. Dazu gehören auch entsprechende histologische Veränderungen, namentlich die bekannten (diastaseresistenten) PAS-positiven, schaumigen Makrophagen (Abb. g). Die große Mehrheit der Patienten mit einem Morbus Whipple haben einen intestinalen Befall, in einer kleinen Untergruppe findet sich allerdings kein entsprechender Befall, und die Erkrankung manifestiert sich primär in anderen Organen wie Herzklappe, Lunge oder Hirn. Findet sich aber eine charakteristische Histologie mit den typischen verplumpten Zotten, den PAS-positiven Makrophagen mit Fettvakuolen und entzündlichen Veränderungen, sollte die Diagnose wegen der Tragweite einer langjährigen Antibiotikatherapie mittels PCR bestätigt werden. Grundsätzlich kann auch eine Immunhistochemie durchgeführt werden, allerdings gibt es keinen kommerziell erhältlichen Antikörper. Im Weiteren sollte man wissen, dass nach erfolgreicher Therapie mit Antibiotika die PAS-positiven Makrophagen persistieren können, die PCR-Untersuchung wird allerdings negativ, was als Therapieerfolg gewertet wird. Differenzialdiagnostisch müssen vor allem atypische Mykobakterien ausgeschlossen werden.
Strongyloides stercoralis-Infektionen: Seltene und unübliche Infektionen beinhalten nicht zuletzt auch parasitäre Erreger. Die Mehrheit derselben findet sich allerdings im unteren Gastrointestinaltrakt. Relativ häufig im oberen Gastrointestinaltrakt, insbesondere im Duodenum, findet sich Strongyloides stercoralis (Abb. h). S. stercoralis tritt weltweit auf, ist allerdings in tropischen Gebieten endemisch. Histologisch finden sich adulte Würmer und Larven, Letztere typischerweise vor allem in den Drüsen. Außerdem liegt meist eine deutliche perifokale Entzündung mit eosinophilen Leukozyten vor. Differenzialdiagnostisch sind andere Parasiten in Erwägung zu ziehen, namentlich Schistosomen, diese aber sind typischerweise im Stroma und zeigen häufig eine granulomatöse Reaktion.
Resümee
Zusammenfassend kann man sagen, dass Infektionen im oberen Gastrointestinaltrakt nicht selten sind und dass der Pathologe mit der Histologie auch weniger häufigen oder gar seltenen Infektionen vertraut sein sollte. Zusatzuntersuchungen wie Immunhistochemie oder PCR sind wichtige unterstützende Techniken, müssen aber immer im klinischen Kontext gesehen werden.





















































































_Martin_Lachmair_opt.jpg)

