Aktive Überwachung: Wer, wann und wie?
Das Prostatakarzinom (PCa) ist der am häufigsten neu diagnostizierte maligne Tumor des Mannes in der westlichen Welt1. Nicht alle Patienten mit einem PCa sind jedoch in ihrer Lebenserwartung bedroht; es ist seit einiger Zeit bekannt, dass die Zahl der Karzinomträger deutlich höher ist, als die Zahl der Patienten, die an einem PCa versterben2. Durch deutliche Verbesserungen in der Vorsorge und Diagnostik in den vergangenen Dekaden werden PCa heutzutage frühzeitiger detektiert und die Karzinome weisen oft günstigere histopathologische Charakteristika auf. Es wird vermutet, dass zahlreiche gegenwärtig diagnostizierte PCa einen langsamen, unkomplizierten Erkrankungsverlauf aufweisen und daher seltener eine Bedrohung für den Patienten darstellen3. Trotz der vorhandenen Evidenz wird die Mehrheit aller PCa-Patienten einer invasiven PCa-Therapie zugeführt, so dass in den vergangenen Jahren zusehends die Gefahr der Überdiagnostik und Übertherapie diskutiert wurde.
Ein Konzept zur Vermeidung einer Übertherapie stellt die sogenannte „aktive Überwachung“ (engl.: „active surveillance“) des Patienten dar. Eine aktive Überwachung bedeutet, dass eine aktive Therapie zunächst ausgesetzt wird und durch regelmäßige Kontrollen festgestellt wird, ob ein aktiver Therapiebedarf grundsätzlich besteht und wenn dies erforderlich ist, diese dann in kurativer Intention veranlasst wird4. Dabei ist die aktive Überwachung klar vom sogenannten „watchful waiting“ abzugrenzen, bei dem der symptomatische Progress des Patienten abgewartet wird, bevor dann eine Therapie (zumeist eine palliative Hormontherapie) initiiert wird. Dieser Artikel fasst die gegenwärtigen Konzepte der aktiven Überwachung zusammen und diskutiert, welche Patienten Kandidaten für eine aktive Überwachung sind, und wie die aktive Überwachung sinnvoll umgesetzt werden kann.
Welche Patienten sind Kandidaten?
Jeder Patient mit einem wenig aggressiven PCa ist ein Kandidat für eine aktive Überwachung. Grundvoraussetzung für eine aktive Überwachung ist jedoch eine genaue Charakterisierung des PCa als wenig aggressiv, wodurch ein niedriges Risikoprofil hinsichtlich Erkrankungsprogress oder karzinomspezifischem Tod gewährleistet wird (Kriterien siehe unten3). Das Ziel der aktiven Überwachung ist nicht eine generelle Vermeidung einer Therapie, sondern vielmehr das mögliche Hinauszögern einer erforderlichen, dann aber dennoch kurativen Intervention. Vor allem die Lebenserwartung des einzelnen Patienten ist ein wesentlicher Faktor, der eine PCa-Therapieplanung wesentlich beeinflusst5. Verschiedene klinische Faktoren müssen daher bei der Planung einer aktiven Überwachung berücksichtigt werden: Neben dem Lebensalter haben Komorbiditäten einen entscheidenden Einfluss auf die Lebenserwartung. Als Kliniker ist man daher tendenziell eher geneigt, jüngeren, fitten und überwiegend gesunden Patienten eine definitive Therapie anzubieten, und bei älteren Patienten eher eine abwartende Haltung anzuraten. Das PCa wird überwiegend bei Männern über 65 Jahren diagnostiziert, und ein großer Anteil dieser Patienten weist signifikante Begleiterkrankungen auf4. Studien, welche die prognostische Relevanz von Begleiterkrankungen bei Patienten mit einem PCa analysiert haben, konnten eine klare Assoziation zwischen Komorbiditäten und einem schlechteren Gesamtüberleben feststellen6. In Österreich stellt das PCa im Jahr 2010 mit einem Anteil von 26 % das häufigste Malignom des Mannes dar; während jährlich bei ca. 5.000 Männern ein PCa diagnostiziert wird, versterben lediglich 1.100 am PCa pro Jahr in Österreich7; dies unterstreicht den Einfluss insbesondere kardiovaskulärer Erkrankungen auf das Gesamtüberleben von PCa-Patienten. Nomogramme stellen derzeit die am besten geeigneten Instrumente zur Einschätzung der Lebenserwartung von Patienten mit einem PCa dar5. Die adäquate Patientenselektion ist somit essenziell für eine möglichst sichere Durchführung einer aktiven Überwachung. Dennoch sind es primär die Tumorcharakteristika, die einen Patienten für eine aktive Überwachung qualifizieren oder diese Behandlungsform ausschließen.
Welche Kriterien?
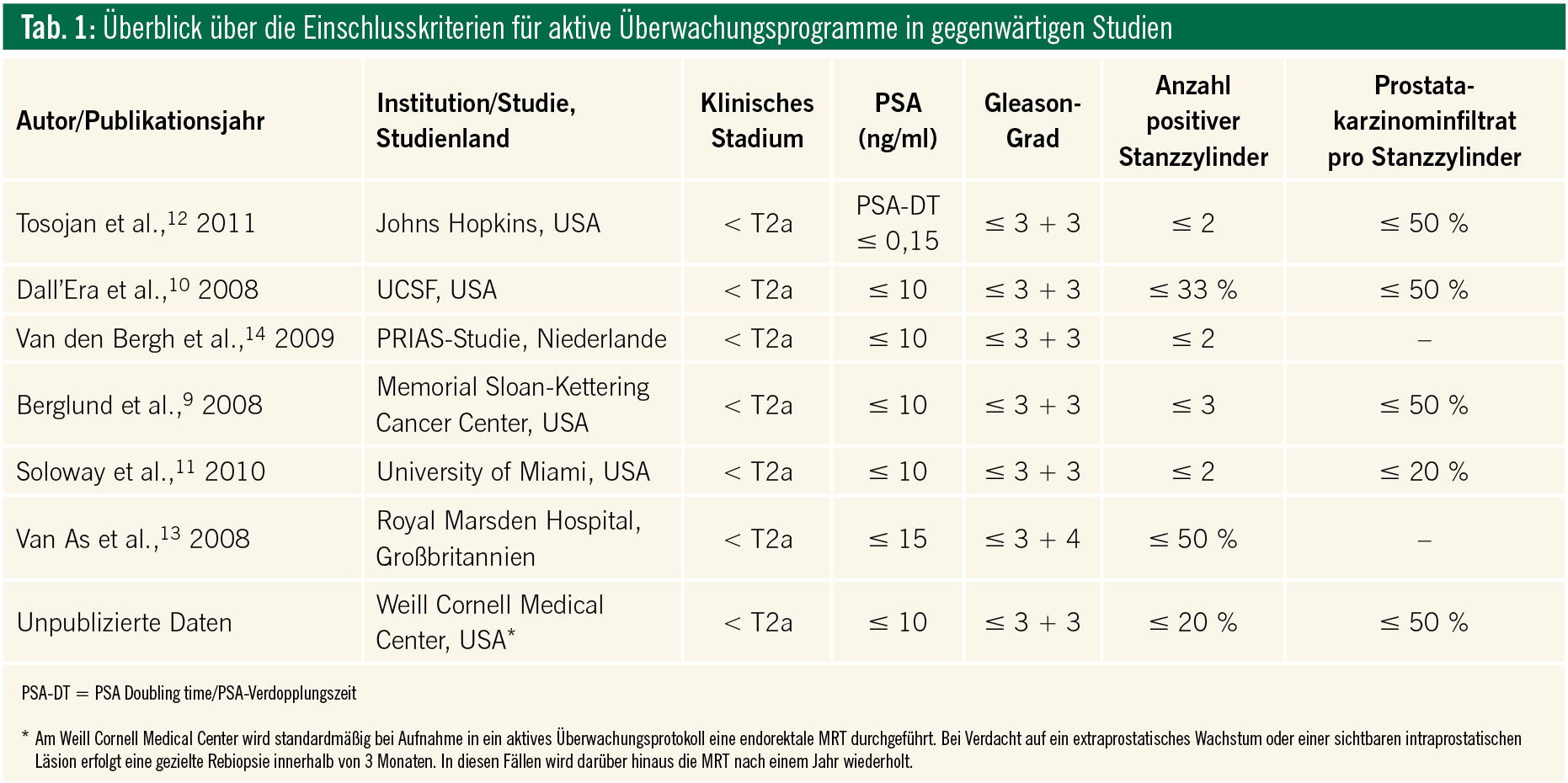
Im Jahr 1994 wurden von Epstein et al. Kriterien publiziert, die, basierend auf klinischen und pathologischen Prostatabiopsiedaten, PCa mit einem niedrigen Risikoprofil (sog. Low-Risk-PCa) selektionieren8. Die sogenannten Epstein-Kriterien wurden 2004 aktualisiert und stellen bis heute die gängigsten Kriterien zur Definition eines PCa mit niedrigem Risikoprofil dar. Die ursprünglichen Definitionskriterien für das sogenannte „insignifikante“ PCa umfassen ein klinisches T1-Stadium, einen Gleason-Grad ≤ 3 + 3 im Biopsiepräparat (Ausschluss von Gleason-4- oder -5-Anteilen), ≤ 2 positive Prostatabiopsiezylinder mit je ≤ 50 % Karzinominfiltration bei einer Mindestanzahl von 6 Biopsiezylindern sowie einer PSA-Dichte < 0,15 ng/ml/ml.
Tabelle 1 gibt einen Überblick über kürzlich publizierte Studien sowie die Definitionskriterien eines PCa mit niedrigem Risikoprofil. Die meisten Kliniker verwenden einen niedrigen Gleason-Grad (≤ 6), ein niedriges klinisches Stadium (≤ T2a) und PSA-Werte ≤ 10 ng/ml in Kombination mit einer Abschätzung des Tumorvolumens basierend auf der Anzahl der positiven Biopsien für die Patientenselektion für eine aktive Überwachung9–14. Nur wenige Studien verwendeten breitere Einschlusskriterien mit PSA-Werten ≤ 15 ng/ml oder einem Gleason-Grad ≤ 3 + 413. Die Verwendung strengerer Kriterien selektiert mehr Männer mit eindeutig insignifikanten Karzinomen15, limitiert jedoch primär die Anzahl an Patienten und schließt mögliche Kandidaten, die von einer aktiven Überwachung profitieren könnten, aus. Es bleibt jedoch unklar, inwieweit strengere Kriterien einen onkologischen Benefit offerieren. In einer kürzlich publizierten Studie von Iremashvili et al. zeigten sich keine Unterschiede im biochemischen rezidivfreien 5-Jahres-Überleben zwischen Patienten mit zuvor beschriebenen und strengeren Kriterien15.
Onkologische Ergebnisse der aktiven Überwachung
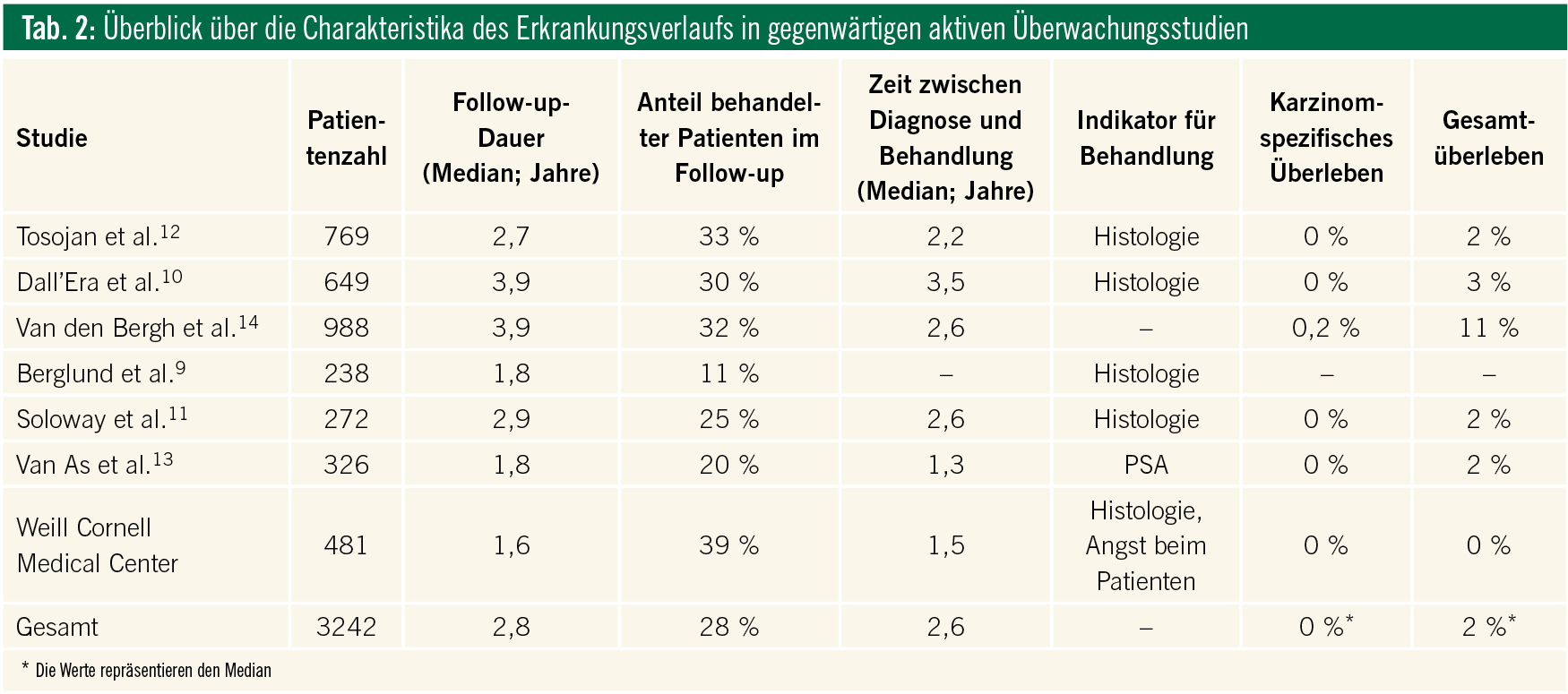
Zahlreiche Studien haben in den vergangenen Jahren den Erkrankungsverlauf von Patienten untersucht, die mit einer aktiven Überwachung behandelt wurden. Tabelle 2 gibt einen Überblick über Charakteristika für das behandlungsfreie, karzinomspezifische und Gesamtüberleben von Patienten, die in größeren, gegenwärtig aktiven Überwachungsstudien behandelt wurden9–14. Da die meisten gegenwärtigen Studien nur über eine kurze Follow-up-Zeit (Median 2,8 Jahre) verfügen, sind diese Ergebnisse zwar weiterhin als präliminär zu bewerten, zeigen jedoch überwiegend homogene Resultate. In den angegebenen Studien betrug das mediane Alter der Patienten 65 Jahre. Knapp 1/3 aller Patienten mit aktiver Überwachung wurde im Verlauf einer weiteren Behandlung zugeführt. Die Behandlung der Patienten konnte im Median um gut zweieinhalb Jahre hinausgezögert werden und der häufigste Grund einer Behandlung waren Änderungen in der PCa-Histologie bei Nachweis aggressiverer PCa-Charakteristika. Das karzinomspezifische Überleben betrug in den meisten Studien bei kurzem Follow-up knapp 100 %, das Gesamtüberleben lag bei 89–98 %. Eine Studie der University of Toronto berichtet hingegen über Patienten mit einem längeren Follow-up (Median: 6,8 Jahre). In dieser Studie waren die Männer generell älter (Median: 70 Jahre) und es wurden neben Patienten mit niedrigen Risikoprofilen auch Männer mit intermediären Risikoprofilen (30 % der Studienkohorte; Männer > 70 Jahre, PSA ≤ 15 ng/ml, Gleason-Grad ≤ 3 + 4) eingeschlossen. In dieser Studie lagen die karzinomspezifischen 5- und 10-Jahres-Überlebensraten bei 99,7 % und 97,2 %16.
Wie sollte ein Patient aktiv überwacht werden?
Hat sich ein Patient zu einer aktiven Überwachung entschlossen, werden üblicherweise regelmäßige PSA-Kontrollen verbunden mit einer digital-rektalen Untersuchung sowie regelhafte Kontrollbiopsien mit der Frage nach einem histologisch nachweisbaren Tumorprogress empfohlen4. Da die meisten Patienten mit niedrigen PCa-Risikoprofilen unauffällige transrektale Ultraschallbefunde aufweisen, wird zudem der Einsatz der Magnetresonanztomographie (MRT) in der aktiven Überwachungsdiagnostik diskutiert. In der urologischen Klinik des Weill Cornell Medical Centers in New York (USA) gehört die Durchführung einer MRT mittlerweile zu den Einschlusskriterien für ein aktives Überwachungsprogramm.
Kontrollprostatabiopsien stellen einen wichtigen Bestandteil aller aktiven Überwachungsprogramme dar. Da der Gleason-Grad einen der wichtigsten prognostischen Faktoren bei Männern mit PCa darstellt, ist es von großem Interesse, frühzeitig höhere Gleason-Grade zu detektieren, da diese Patienten potenziell keine Kandidaten für eine aktive Überwachung darstellen3. Üblicherweise stellt der Nachweis eines Gleason-Grad-4- oder -5-Musters in der Biopsie ein Kriterium dar, das als Progress gewertet wird4, 14. Es ist jedoch bekannt, dass nicht zwingend jeder Nachweis eines aggressiveren Tumorgrades einen Progress darstellt, sondern vielmehr ein Gleason-Muster, das in der Initialbiopsie nicht detektiert wurde. Die Raten für dieses sog. „undersampling“ bzw. „sampling error“ werden mit 20–30 % für 12-fach-Biopsien angegeben17. Aus diesem Grund wird diskutiert, ob Patienten, die sich zu einer aktiven Überwachung entschließen, nicht initial eine Rebiopsie bekommen sollten, um den „sampling error“ unwahrscheinlicher zu machen. Einheitliche Kriterien für den geeigneten Zeitpunkt der Kontrollbiopsie existieren nicht. In der PRIAS-Studie waren die Kontrollbiopsieintervalle 1, 4 und 7 Jahre, während von der Gruppe aus Johns Hopkins University jährliche Biopsiekontrollen durchgeführt werden.
Ein weiteres Kriterium zum Nachweis eines Tumorprogresses unter aktiver Überwachung stellt die PSA-Dynamik dar. Der Grund für ein regelmäßiges PSA-Monitoring liegt in der Korrelation einer schnellen PSA-Anstiegsgeschwindigkeit im Jahr vor der PCa-Diagnose mit einer erhöhten PCa-Mortalität nach der Behandlung18. Auch wenn das PSA-Kontrollintervall eher willkürlich gewählt erscheint, werden in den meisten Studien vierteljährliche PSA-Kontrollen durchgeführt, obgleich es keine fundierte wissenschaftliche Grundlage dafür gibt. Da die PSA-Kinetik jedoch nicht statisch ist, sollten einzelne PSA-Werte sowie bestimmte Triggerpunkte immer mit Vorsicht interpretiert werden. Eine kurze PSA-Verdopplungszeit wird generell mit einem aggressiven PCa und einer höheren tumorspezifischen Mortalität assoziiert19. Klotz et al. haben eine PSA-Verdopplungszeit von < 3 Jahren als Interventionskriterium vorgeschlagen20. Weiterhin wurde von dieser Gruppe als Interventionskriterien ein Überschreiten des PSA-Wertes von 10 ng/ml bei Patienten mit einem Ausgangs-PSA 20 ng/ml oder eine PSA-Verdopplungszeit < 3 Jahren bei beliebigem PSA-Ausgangswert vorgeschlagen, um nur die wichtigsten dieser sehr komplexen Kriterien zu nennen. Die Wissenschaftlergruppe aus Johns Hopkins University hingegen hat keine Korrelation zwischen der PSA-Verdopplungszeit und einer schlechteren Pathologie bei Überwachungsbiopsien oder bei Patienten, die mit einer radikalen Prostatektomie behandelt wurden, festgestellt21. Eine eindeutige Definition einer behandlungsbedürftigen PSA-Anstiegsgeschwindigkeit ist weiterhin ausstehend.
Das MRT bietet einige Vorteile als Bildgebungsmodalität (z. B. Überblick der pelvinen Anatomie, funktionelle Untersuchungen) im Vergleich zu anderen Modalitäten. Bei Nachweis einer im MRT anatomisch sichtbaren Läsion scheint eine Assoziation mit ungünstigen Tumorcharakteristika vorzuliegen. Der Hinweis auf ein extraprostatisches PCa bei aktiven Überwachungspatienten zum Beispiel scheint mit einer erhöhten Biopsieprogressionsrate vergesellschaftet zu sein9. Am Weill Cornell Medical Center wird im Falle des Verdachts auf eine extraprostatische Läsion oder einer sichtbaren intraprostatischen Läsion eine gezielte Rebiopsie im kurzfristigen Intervall (< 3 Monate) durchgeführt. Im Gegensatz dazu konnte die MRT nicht zu einer besseren Vorhersage von Hochrisiko-PCa bei Patienten mit niedrigem Risikoprofil beitragen22. Die kürzlich eingeführte sogenannte diffusionsgewichtete MRT stellt eine weitere hoffnungsvolle Technik dar, da es sich um eine Untersuchungsmodalität handelt, die biologisch aktive Prozesse abbilden kann23. Derzeit ist der Stellenwert der MRT bei der aktiven Überwachung noch limitiert, allerdings kann davon ausgegangen werden, dass mit zunehmenden technischen Verfeinerungen auch der Stellenwert der MRT weiter zunehmen dürfte.
Warum wird die aktive Überwachung verhältnismäßig selten durchgeführt? In der Literatur werden einige grundlegende Schwierigkeiten bei der Planung und Durchführung einer aktiven Überwachung beim Prostatakarzinom diskutiert. Wie bereits zuvor erläutert, sind die Einschlusskriterien für eine aktive Überwachung weiterhin nicht einheitlich. Darüber hinaus werden in der Literatur unterschiedliche Schemata zur Durchführung beschrieben, während uniforme Leitlinien der verschiedenen Fachgesellschaften weiterhin auf sich warten lassen3. Neue Techniken und Biomarker, die eine bessere Patientenselektion ermöglichen würden, könnten dieses Dilemma wahrscheinlich reduzieren. Obgleich eine Vielzahl an hoffnungsvollen Biomarkern existiert24, ist derzeit leider kein Biomarker in Sicht, der diese notwendige Unterscheidung speziell bei der aktiven Überwachung in naher Zukunft erleichtern wird. So konnte zum Beispiel, für den derzeit vielfach untersuchten urinbasierten PCA-3-Marker kein Vorteil in der Voraussage des aktiven Überwachungsverlaufs festgestellt werden. Der PCA-3-Wert konnte eine kurzfristige Progression in der Verlaufsbiopsie nicht vorhersagen25.
Eine weitere, kontrovers diskutierte Ursache für die Zurückhaltung bei der aktiven Überwachung ist die psychologische Belastung der Patienten. Während einige Studien keinen Unterschied in der psychologischen Belastung zwischen Patienten mit invasiver Therapie im Vergleich zur aktiven Überwachung fanden, konnten andere Studien zeigen, dass ein großer Teil der Patienten, welche zunächst eine aktive Überwachung gewählt hatten, nach einem relativ kurzen Zeitin-tervall auch ohne evidenten Progress eine definitive Therapie suchen4. Die psychische Belastung durch das Wissen, einen unbehandelten Tumor unter der aktiven Überwachung zu haben, wird teilweise äquivalent zu der Furcht des Patienten um einen Wiederanstieg des PSA-Wertes nach definitiver Therapie beschrieben26. Dennoch muss selbstverständlich eine aktive Überwachung gegenüber den Nebenwirkungen einer definitiven Therapie abgewogen werden.
Letztlich darf zudem nicht unterschlagen werden, dass die Datenlage und die sich daraus ergebenden Behandlungsvorschläge für die aktive Überwachung weltweit lediglich auf ca. 3.000 Patienten beruhen. Die aktive Überwachung ist damit die wahrscheinlich am limitiertesten untersuchte Therapieoption in unseren derzeitigen Leitlinien.
1 Siegel R et al., Cancer statistics 2012. CA Cancer J Clin 2012; 62:10–29.
2 Sakr WA et al., J Urol 1993; 150:379–85.
3 Dall’Era MA et al., Eur Urol 2012. Epub ahead of print.
4 Graefen M, Ahyai S, Heuer R et al., Urologe A 2008; 47:261–9.
5 Walz J et al., JCO 2007; 25:3576–81.
6 Froehner M et al., J Urol 2004; 171:697–9.
7 Statistik Austria. Krebsinzidenz und Krebsmortalität in Österreich 2010; 2011.
8 Epstein JI, Walsh PC, JAMA 1994; 271:368–74.
9 Berglund RK et al., J Urol 2008; 180:1964–7; discussion 1967–8.
10 Dall’Era MA et al., Cancer 2008; 112:2664–70.
11 Soloway MS et al., Eur Urol 2010; 58:831–5.
12 Tosoian JJ et al., JCO 2011; 29:2185–90.
13 van As NJ et al., Eur Urol 2008; 54:1297–305.
14 van den Bergh RC et al., Eur Urol 2009; 55:1–8.
15 Iremashvili V et al., Eur Urol 2012; 62(3):462–8.
16 Klotz L et al., JCO 2010; 28:126–31.
17 Smaldone MC et al., J Urol 2010; 183:138–43.
18 D’Amico AV et al., NEJM 2004; 351:125–35.
19 Teahan SJ, Klotz LH, BJU Int 2006; 97:451–5.
20 Klotz L, JCO 2005; 23:8165–9.
21 Ross AE et al., JCO 2010; 28:2810–6.
22 Ploussard G et al., BJU Int 2011; 108:513–7.
23 Giannarini G et al., Eur Urol 2012; 61:326–40.
24 Shariat SF et al., Arch Esp Urol 2011; 64:681–94.
25 Tosoian JJ et al., J Urol 2010; 183:534–8.
26 Klotz L, Nat Clin Pract Oncol 2007; 4:692–8.