ASCO 2012: Vakzinierung (IMA901*) bei fortgeschrittenem Nierenzellkarzinom
Die TUMAP werden intradermal appliziert, wo sie an die dendritischen Zellen binden. Die dendritischen Zellen präsentieren dann die TUMAP an T-Zellen (zytotoxische T-Zellen und THelferzellen), die nach Aktivierung in der Lage sind, Tumorzellen spezifisch zu erkennen.
Phase I: In einer multizentrischen, einarmigen Phase-I-Studie wurden zunächst bei 28 HLA-A*02- positiven Patienten mit fortgeschrittenem Nierenzellkarzinom 8 intradermale Injektionen mit IMA901 zusammen mit dem Immunmodulator GM-CSF über einen Zeitraum von 10 Wochen verabreicht. Es traten keine unerwünschten schweren Nebenwirkungen (SAE) gegen die verabreichten Substanzen auf. Patienten mit mehr als einer T-Zell-Antwort auf die verabreichte TUMAP-Kombination IMA901 wiesen einen besseren Krankheitsverlauf auf. Gleichzeitig wurden regulatorische T-Zellen (Tregs) als potenzielle Biomarker identifiziert, die negativ mit Immunantworten assoziiert waren.
Basierend auf früheren Studien diente GM-CSF zur Verstärkung der Immunantwort der intradermalen Peptidinjektion. Bei der verabreichten Dosierung von 75 μg intradermal sind weder eine direkte therapeutische Wirkung noch die für diesen Faktor typischen Nebenwirkungen zu erwarten, was sich durch diese Studie nochmals bestätigte.
Phase II: In einer darauf folgenden europäischen multizentrischen Phase-II-Studie an Patienten mit fortgeschrittenem Nierenzellkarzinom nach Versagen der Erstlinientherapie wurde das Impf-Schema mit IMA901 überarbeitet und auf 17 Impfungen auf einen Zeitraum von 35 Wochen ausgeweitet. Begleitet wurde die Behandlung unter anderem von einem aufwendigen Immunmonitoring. Bei 47/64 auswertbaren Patienten (66 %) war eine vakzineinduzierte Antwort, bei 17 Patienten (27 %) waren multiple Antworten erkennbar. Außerdem wurde bei der Hälfte dieser Patienten randomisiert Cyclophosphamid in einer sehr niedrigen Dosis (300 mg/m2) 3 Tage vor Beginn des Impfschemas verabreicht. Die einmalige intravenöse Cyclophosphamid-Infusion war nicht als Chemotherapie gedacht, sondern zur Reduktion der Zahl der regulatorischen T-Zellen (Treg) im Blut (Abb. 1). Dies konnte mittels signifikanten Abfalls der FoxP3+ Tregs bzw. des hochsignifikanten Abfalls proliferierender FoxP3+ Ki67+ Treg bereits 3 Tage nach Cyclophosphamid-Verabreichung gezeigt werden.
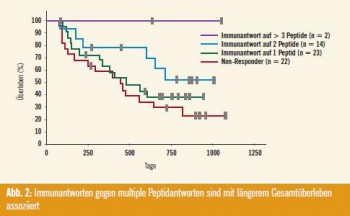
Bei den Ergebnissen bezüglich des Krankheitsverlaufes stachen vor allem diejenigen heraus, bei denen mehr als eine T-Zell-Antwort auf die zehn verabreichten TUMAP zu erkennen waren (Abb. 2), und die Patientengruppe, bei denen der Immuntherapie Cyclophosphamid vorgeschaltet war.
Deutlicher Überlebensvorteil: IMA901+Cyclophosphamid
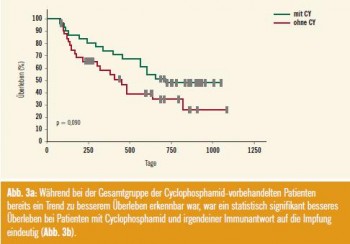
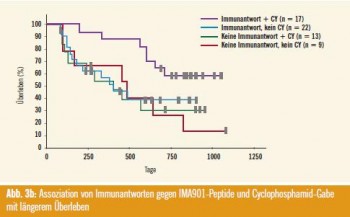
Damit konnte erstmals in einer randomisierten klinischen Studie gezeigt werden, dass eine Multipeptid-Vakzinierung beim fortgeschrittenen Nierenzellkarzinom nicht nur sicher zu applizieren ist, sondern auch einen klinisch signifikanten Überlebensvorteil bringt, wenn T-Zell-Antworten vorliegen. Deutlich verbessert werden kann das Überleben der Patienten mit einer Immunantwort durch Vorschalten einer niedrig dosierten einmaligen Cyclophosphamidgabe zur Absenkung der Treg. Am auffälligsten war der Überlebensvorteil bei Patienten mit Immunreaktionen auf IMA901 und vorgeschaltetes Cyclophosphamid (Abb. 3).
Phase III: In weiteren Laborstudien wurden mögliche synergistische Wirkungen zwischen der Peptidvakzinierung IMA901 und verschiedenen zugelassenen zielgerichteten Chemotherapiesubstanzen gegen das fortgeschrittene Nierenzellkarzinom untersucht. Die aussichtsreichste Substanz für eine Kombination mit einer Cyclophosphamid-induzierten Peptidvakzinierung war in diesen Versuchen Sunitinib. Es wurde daher jüngst eine randomisierte multizentrische Phase-IIIStudie beidseits des Atlantiks begonnen, bei der niedrig dosiertes Cyclophosphamid, IMA901 und Sunitinib bei lokal fortgeschrittenem und/oder metastasiertem Nierenzellkarzinom mit messbarer Läsion an 330 Patienten mit HLA-A*02-Status als Erstlinientherapie untersucht werden.
* immatics biotechnologies GmbH, Paul-Ehrlich-Str. 15, 72076 Tübingen