mCRPC: Die neuen Hormontherapien
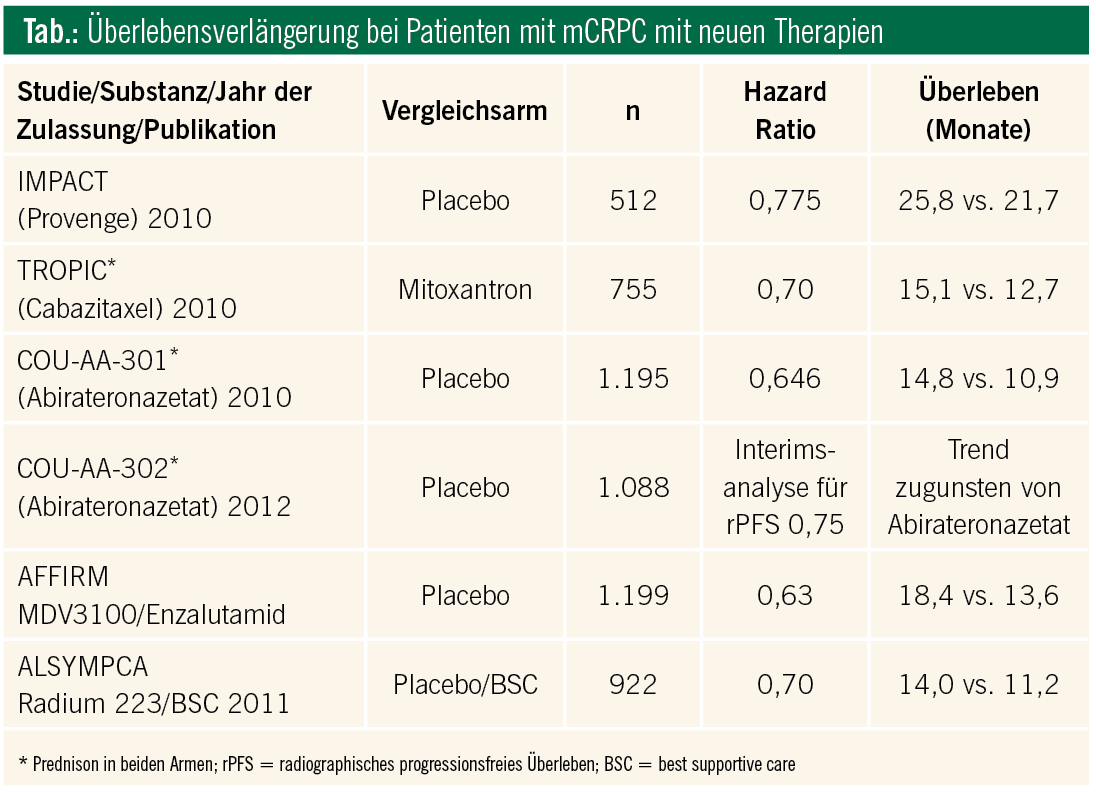
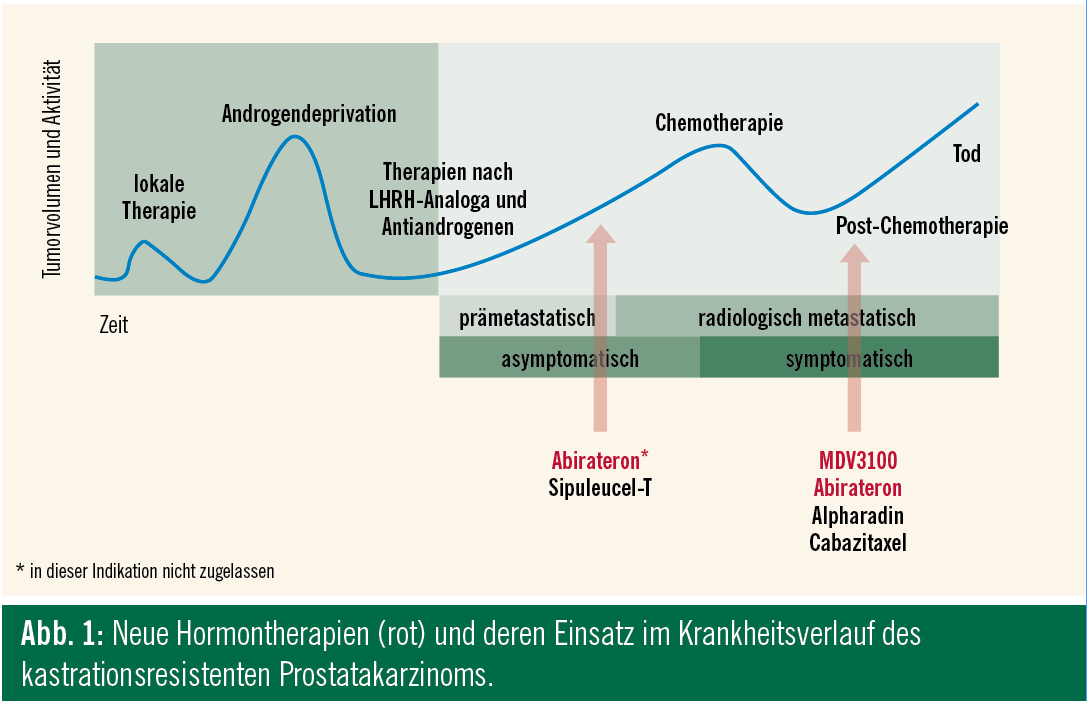
Das letzte Jahr war für die Behandlung des kastrationsresistenten Prostatakarzinoms (CRPC) von enormer Bedeutung. Insgesamt gibt es sechs positive randomisierte Phase-III-Studien (Tab.). Zwei dieser Studien überprüften neue Hormontherapien nach (Abirateronazetat, MDV3100/Enzalutamid) und eine Studie vor (Abirateronazetat) Standard-Erstlinien-Chemotherapie (Abb. 1). Bisher ist in Österreich nur Abirateronazetat nach mindestens einer Chemotherapielinie mit Docetaxel für die Behandlung des metastasierten CRPC (mCRPC) zugelassen.
Es gibt kein „hormonrefraktäres“ Prostatakarzinom
Neue Erkenntnisse über den Androgenrezeptor (AR) und die Hormonabhängigkeit der Prostatakarzinomzelle haben zur systematischen Entwicklung neuer Hormontherapien geführt. Das „kastrationsresistente“ Prostatakarzinom spricht auf neue Hormontherapien nach Chemotherapie an und neue Daten zeigen auch deren Wirksamkeit vor Chemotherapie.
Für die Entwicklung von Resistenzmechanismen gegen Hormonentzug durch alleiniges Absenken der Serumtestosteronspiegel gibt es verschiedene Erklärungsmodelle. Die medikamentöse Hormonablation eliminiert nicht die gesamte Androgenproduktion des Körpers. Nicht nur die Androgenproduktion der Nebennierenrinde bleibt unbeeinflusst, auch die intraprostatischen Androgenspiegel werden nur mäßig reduziert. Dies genügt für ein primäres Ansprechen eines unbehandelten Prostatakarzinoms. Im Laufe der Entwicklung des Tumors wird der Androgenrezeptor-Signalweg jedoch sensibilisiert. Damit genügen auch niedrige Androgenspiegel, um ein weiteres Tumorwachstum zu induzieren. Die Androgensynthese findet jedoch auch in den Tumorzellen selbst statt. Das Prostatakarzinomwachstum bleibt anscheinend auch nach der Kastrationsresistenz häufig abhängig von einer AR-Liganden-Aktivierung.
CYP17-Inhibition mit Abirateronazetat
Sowohl die adrenale Androgensynthese als auch jene durch die Tumorzellen selbst kann durch den unspezifischen p450-Inhibitor Ketoconazol oder den 17-Lyase-Inhibitor Abirateronazetat gehemmt werden.
Abirateronazetat (AA) ist eine neue, in den USA, der EU und seit 2011 auch in Österreich zugelassene Substanz. Es handelt sich dabei um einen oralen selektiven Inhibitor des Enzyms 17α-Hydroxylase/C17, 20-lyase (CYP17). Dieses Enzym wird in Hoden, Nebennieren und Prostata-Tumorgewebe exprimiert und katalysiert die Umwandlung von Pregnenolon und Progesteron in die Testosteronvorstufen DHEA und Androstendion. Die CYP17-Inhibition führt außerdem zu einer erhöhten Mineralokortikoidproduktion in den Nebennieren und ist für einige typische Nebenwirkungen der Substanz verantwortlich.
Abirateron nach Chemotherapie: In einer randomisierten Phase-III-Studie (COU-AA-301) wurde bei 1.195 Patienten mit progredientem CRPC nach Chemotherapie AA (1.000mg = 4Tabletten, 1-mal täglich) plus Prednison (5 mg, 2-mal täglich) mit Placebo plus Prednison (2 : 1-Randomisierung) verglichen. Der primäre Endpunkt war das „overall survival“ (OS). Nach einer mittleren Beobachtungszeit von 12,8 Monaten zeigte sich ein signifikanter Unterschied des OS zugunsten von AA (Tab.; Abb. 2). Auch alle sekundären Endpunkte ergaben unter AA signifikant günstigere Ergebnisse (Zeit bis zur PSA-Progression 10,2 vs. 6,6 Monate; PFS 5,6 vs. 3,6 Monate; PSA-Ansprechrate 29 % vs. 6 %; für alle p < 0,001).
Auch einige exploratorische Endpunkte zur Lebensqualität (FACT-P-Analyse), Fatigue, Schmerz und Skelettkomplikationen zeigten einen klaren Vorteil für AA. So war die Zeit bis zum ersten skelettbezogenen Ereignis unter AA signifikant länger als unter Placebo (301 vs. 150 Tage; p = 0,0006). Die Rate der Patienten, die zu Studienbeginn ≥ 4 auf dem BPI-SF-Schmerz-Score hatten und bei denen eine Besserung der Schmerzen erreicht wurde, betrug unter AA 44 %, unter Placebo nur 27 %.
Nebenwirkungen unter AA waren selten und mild. Unter AA signifikant häufiger als in der Placebogruppe wurden mineralokortikoidinduzierte Nebenwirkungen beobachtet, wie zum Beispiel Flüssigkeitsretention, Ödeme, Hypokaliämie, Hypertonie, kardiale Störungen und erhöhte Leberfunktionswerte (insgesamt 55 % vs. 43 %; p < 0,001). Die meisten dieser Nebenwirkungen waren jedoch leicht und gut beherrschbar. Die gleichzeitige Therapie mit Prednison (2-mal 5 mg täglich per os) zusammen mit AA ist obligat. Treten trotzdem mineralokortikoidbedingte Nebenwirkungen auf, kann die Kortisondosis erhöht werden oder der Aldosteronantagonist Eplerenon zum Einsatz kommen.
Unter AA-Behandlung sollen darüber hinaus die Serumtransaminasen vor Beginn der Therapie, in den ersten drei Behandlungsmonaten alle zwei Wochen und anschließend einmal im Monat bestimmt werden. Blutdruck, Serumkalium und Flüssigkeitsretention sollen einmal im Monat kontrolliert werden.
Unter der Therapie mit AA sollten die Patienten – entsprechend dem Design der Zulassungsstudie (COU-AA-301) – weiter unter Androgenentzug stehen (z. B. Therapie mit LHRH-Agonisten),
Abirateron vor Chemotherapie – erste Daten einer Interimsanalyse: Im Juni 2012 wurden erstmals die Daten einer Interimsanalyse der Phase-III-Studie (COU-AA-302) mit AA plus Prednison randomisiert gegen Placebo plus Prednison bei Patienten mit progredientem mCRPC vor Chemotherapie mit Docetaxel vorgestellt. Die 1.088 inkludierten Patienten waren asymptomatisch oder minimal symptomatisch. Primäre Endpunkte (Ko-Endpunktdesign) waren das radiologische progressionsfreie Überleben (rPFS) und das OS. Die Studie wurde bei der 2. Interimsanalyse nach Entscheidung durch ein unabhängiges Daten-Monitoring-Komitee entblindet und die Placebopatienten konnten ein Crossover in Anspruch nehmen, nachdem das rPFS unter AA signifikant besser war als unter Placebo. Das OS zeigte einen positiven Trend. Diese Daten sind sehr erfreulich und vielversprechend, die endgültigen Ergebnisse jedoch noch ausständig und AA in dieser Indikation noch nicht zugelassen.
Enzalutamid (MDV3100), ein neuartiges Antiandrogen
MDV3100 ist ein oraler Androgenrezeptor-Antagonist (Dosis der Phase-III-Studie: 1-mal täglich 160 mg), der eine komplexe Wirksamkeit in der AR-Signaltransduktion zeigt, mit einer viel höheren Affinität für den Androgenrezeptor als Bicalutamid und, im Gegensatz zu Bicalutamid, ohne partiell agonistische Wirkung auf den AR.
In einer Phase-I-/-II-Studie mit 140 progredienten mCRPC-Patienten, erreichten 56 % einen PSA-Abfall von mindestens 50 % und 22 % (13 von 59) ein messbares Ansprechen von Weichteilmetastasen.
Die Substanz wurde insgesamt ausgezeichnet vertragen. Die häufigste Nebenwirkung war Müdigkeit. Eine seltene, jedoch wichtige Nebenwirkung, die am häufigsten zum Therapieabbruch führte, waren zerebrale Krampfanfälle (0,6 % in der Phase-III-Studie).
Anfang 2012 wurde die Phase-III-Studie, die 1.199 Patienten inkludierte, präsentiert. In dieser Studie wurde zwischen Enzalutamid versus Placebo bei mCRPC-Patienten, die nach Standardchemotherapie mit Docetaxel oder auch nach mehreren Chemotherapielinien progredient waren, 2 : 1 randomisiert. Der primäre Endpunkt war das OS, welches eine 37%ige Risikoreduktion zu versterben erbrachte (HR = 0,631 [0,529, 0,752]; p < 0,0001), mit 18,4 versus 13,6 Monaten zugunsten von Enzalutamid. Prednison war in der Studie nicht obligat, jedoch erlaubt.
Enzalutamid wird das (Hormon-)Therapiespektrum des metastasierten kastrationsresistenten Prostatakarzinoms nach Chemotherapie entscheidend erweitern. Die Substanz ist noch nicht zugelassen.