Metastasiertes Urothelkarzinom − Individualisierte Therapiekonzepte
Der Einzug der Immuntherapie hat in den letzten Jahren den therapeutischen Algorithmus unserer Guidelines beim metastasierten Urothelkarzinom drastisch verändert. Im folgenden kurzen Übersichtsartikel werden die verschiedenen Therapieoptionen in der Erstlinie, Zweitlinie und folgenden Sequenzen näher erörtert. Zudem geben neue „gezielte“ Therapien („targeted therapies“) Hoffnung auf eine personalisiertere Therapie mit erstaunlichen Überlebensraten.
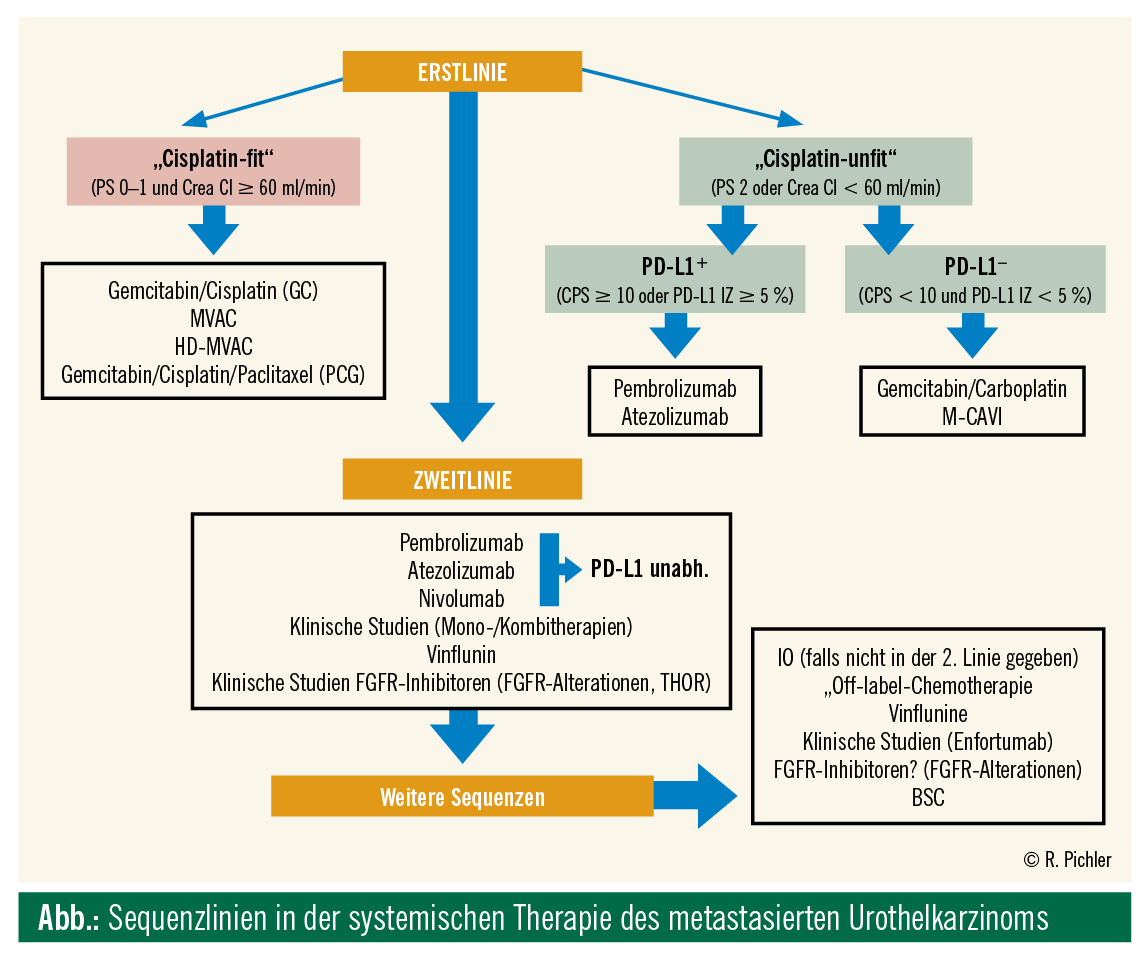
Erstlinie
„Cisplatinfit“
Hier bilden cisplatinbasierte Chemotherapien wie Gemcitabin/Cisplatin oder MVAC (Methotrexat, Vinblastin, Adriamycin und Cisplatin) seit 1980 den Goldstandard in der systemischen Erstlinientherapie beim metastasierten Urothelkarzinom (Bellmunt J et al., Semin Oncol 2012). Das mediane Gesamtüberleben kann dadurch bei gutem Ansprechen von durchschnittlich 3 bis 6 Monaten (Sternberg CN et al., Crit Rev Oncol Hematol 2003) auf 14,0 und 15,2 Monaten gesteigert werden (Von der Maase et al., JCO 2005).
Trotz der bekannten Datenlage laufen im Moment insgesamt 3 Phase-III-Studien, welche in der Erstlinientherapie Checkpoint-Inhibitoren allein oder kombiniert gegen die Standardtherapie (Gemcitabin/Cisplatin oder Gemcitabin/Carboplatin) testen. Dazu gehören die DANUBE-Studie (Durvalumab vs. Durvalumab + Tremelimumab vs. Gem/Cis oder Gem/Carbo; NCT02516241), die KEYNOTE-361-Studie (Pembrolizumab vs. Pembrolizumab + Gem/Cis oder + Gem/Carbo vs. Gem/Cis oder Gem/Carbo; NCT02853305) und die Studie IMvigor130 (Atezolizumab vs. Atezolizumab + Gem/Cis oder + Gem/Carbo vs. Gem/Cis oder Gem/Carbo; NCT02807636). Die Daten hierzu sind noch ausständig.
„Cisplatinunfit“
Im metastasierten Status sind jedoch circa 50 % aller Patienten nichtfit für eine cisplatinhaltige Chemotherapie (Galsky MD, JCO 2011), mit der Notwendigkeit von carboplatinkombinierten Chemotherapien wie Gemcitabin/Carboplatin oder M-CAVI (Methotrexat, Carboplatin, Vinblastin). Diese Kombinationen (EORTC 30986) führen jedoch zu einem geringeren Therapieansprechen mit einem medianen Gesamtüberleben von maximal 9,3 Monaten, einer objektiven Ansprechrate von 36 % und einer 2-Jahres-Gesamtüberlebensrate von nur 18 % (De Santis M, JCO 2012). Diese Tatsache bekräftigt die dringende Notwendigkeit neuer effizienter Therapien mit geringeren Toxizitäten, vor allem bei „cisplatin-unfit“ Patienten (Bellmunt J et al., Cancer Treat Rev 2017).
Aufgrund der KEYNOTE-052 (Balar AV et al., Lancet Oncol 2017) und IMvigor210 (Balar AV et al., Lancet 2017) sind derzeit Pembrolizumab und Atezolizumab in der Erstlinientherapie beim „cisplatin-unfit“ Patienten von der FDA und der EMA zugelassen. Die Follow-up-Daten zur IMvigor210 wurden am ASCO 2018 präsentiert. Das 1-Jahres- und 2-Jahres-Gesamtüberleben lag bei 58 % und 41 %. Bei einem medianen Follow-up von 29 Monaten zeigten interessanterweise &re;= 80-jährige Patienten eine besonders gute Ansprechrate mit 28 % und einer kompletten Remission von 12 % (JCO 36, 2018, suppl; abstr 4523). Die 1-Jahres-Follow-up-Daten der KEYNOTE-052 zeigten eine Ansprechrate von 28,9 % mit einem 1-Jahres-Gesamtüberleben von 47,5 % (JCO 36, 2018, suppl; abstr 4524).
Aufgrund der schlechteren Überlebensraten von Patienten mit geringer PD-L1-Expression in der laufenden KEYNOTE-361 und IMvigor130 im IO-Monotherapie-Arm ist im Moment die Anwendung von Atezolizumab und Pembrolizumab bei „cisplatin-unfit“ Patienten in der Erstlinie derzeit auf jene mit hoher PD-L1-Expression (Pembrolizumab: CPS-Score &re;= 10, Atezolizumab: &re;= 5 % PD-L1-Expression in den Immunzellen) beschränkt. http://www.ema.europa.euema/index.jsp?curl=pages/news_and_events/news/2018/05/news_detail_002964.jsp&mid=WC0b01ac 058004d5c1.
Zweitlinie
Bei Progress nach platinhaltiger Chemotherapie gibt es in der Zweitlinie unterschiedliche Therapiekonzepte. Insgesamt sind drei verschiedene Checkpoint-Inhibitoren – Atezolizumab (IMvigor211; Powles T et al., Lancet 2018), Nivolumab (CheckMate-275; Sharma P et al., Lancet Oncol 2017), Pembrolizumab (KEYNOTE-045; Bellmunt J et al., N Engl J Med 2017) – in der Zweitlinientherapie von der EMA zugelassen. Die 2-Jahres-Follow-up-Daten wurden am ASCO 2018 präsentiert. Die Kohorte 2 der IMvigor210-Studie bestätigte ein 1-Jahres- und 2-Jahres-Gesamtüberleben von 37 % und 23 % und war somit vergleichbar mit den Daten der Phase-III-Studien (J Clin Oncol 36, 2018, suppl; abstr 4523). Im Vergleich dazu zeigte die KEYNOTE-045-Studie ein 1-Jahres- und 2-Jahres-Gesamtüberleben von 44,2 % und 26,9 % (JCO 36, 2018, suppl; abstr 4521).
Neben der Immuntherapie ist die Anwendung von Vinflunin (Bellmunt J et al., J Clin Oncol 2009) oder weiteren Chemotherapeutika (z. B. Paclitaxel, nab-Paclitaxel, Docetaxel als Monotherapie oder kombiniert) im Rahmen von klinischen Studien möglich. Eine genaue Übersicht über die unterschiedlichen therapeutischen Sequenzen zeigt die Abbildung.
Neue Hoffnung „targeted therapy“
Vorherige Studien bestätigten, dass das Ansprechen auf eine IO- und Chemotherapie von der TCGA-molekularen Subtypisierung beim invasiven Blasenkarzinom abhängig ist (Sharma P et al., Lancet Oncol 2017). Der luminale papilläre Subtyp I ist beispielsweise von FGF3-Alterationen gekennzeichnet (Robertson AG et al., Cancer Cell 2017), welcher kein eindeutiges Ansprechen auf die neoadjuvante Chemotherapie zeigte (Seiler R et al., Eur Urol 2017). Zudem scheinen diese Tumoren immunologisch „kalt“ zu sein, ohne zusätzliches Ansprechen auf die Immuntherapie (McConkey DJ et al., Hematol Oncol Clin North Am 2015). Somit scheint vor allem dieser Subtyp ein idealer Kandidat für FGFR-Inhibitoren zu sein. Die ersten Phase-I- und -II-Daten von zwei FGFR-Inhibitoren (Erdafitinib und Rogaratinib) wurden am ASCO 2018 präsentiert (Joerger M et al., Abstract 4513, JCO 36, 2018; Siefker-Radtke A et al., Abstract 4503, JCO 36, 2018). Trotz mehrfacher Vortherapien (> 2 Therapielinien bei bis zu 43 %) zeigten die Patienten mit FGFR-Alterationen eine Ansprechrate von bis zu 40,4 %. Das mediane Gesamtüberleben für Erdafitinib lag bei 13,8 Monaten und war somit höher als bei Pembrolizumab (Median: 10,1 Monate; KEYNOTE-045) und Atezolizumab (Median: 11,1 Monate; IMvigor211) in der Zweitlinie.
Aufgrund dieser optimistischen Datenlage läuft derzeit eine Phase-III-Studie (THOR, NCT03390504), welche Patienten in der Zweitlinie für Erdafitinib oder Pembrolizumab oder Chemotherapie (Vinflunin, Docetaxel) randomisiert.