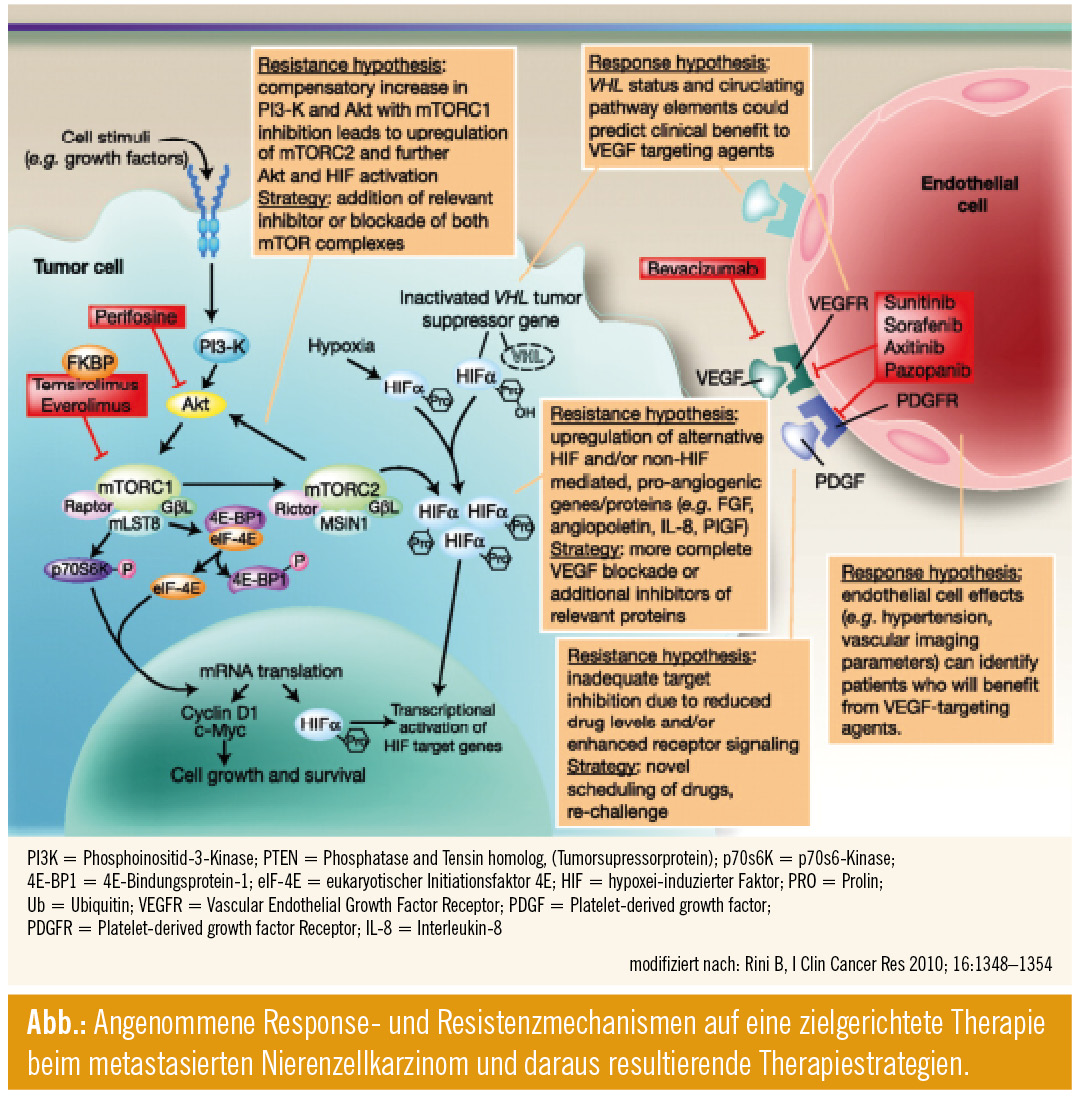
mRCC: Resistenzentwicklung unter zielgerichteter Therapie
Etwa 65–70 % der Patienten zeigen primär ein Ansprechen (überwiegend als Stabilisierung der Erkrankung), bei 30–35 % wird ein Progress unter Therapie beobachtet. Aber auch Patienten mit einem primären Ansprechen zeigen später häufig einen Progress. Entsprechend müssen zwei Formen der Resistenz unterschieden werden: primär (intrinsisch) und sekundär (adaptiv). Für eine effektive Therapiegestaltung ist es wichtig, die Mechanismen der Resistenzentwicklung zu verstehen. Es stellt sich die Frage, ob die Resistenz ähnlich wie bei der Chemo- oder Hormontherapie auf der Selektion von genetisch veränderten resistenten Zellklonen basiert. Mehr und mehr Daten deuten darauf hin, dass hier andere Mechanismen zugrunde liegen.
In-vivo-Versuche konnten in einem Xenograftmodell der Maus belegen, dass die Resistenz gegen Sorafenib umkehrbar ist. Hier wurde eine humane Nierenzellkarzinomzelllinie in die Maus gebracht und nach Wachstum mit Sorafenib behandelt. Nach primärem Ansprechen entwickelte sich eine Resistenz. Diese resistenten Tumorzellen wurden nun in neue Mäuse gebracht und nach Tumorwachstum wieder behandelt. Interessanterweise konnte ein erneutes Ansprechen verzeichnet werden.
Dies führte zu folgenden Schlussfolgerungen:
1. Die Resistenz ist umkehrbar,
2. es kann daraus folgend keine Selektion von genetisch veränderten Zellklonen stattfinden, die die Resistenz bedingen,
3. die Tumor(mikro)umgebung ist an der Resistenzentwicklung wesentlich beteiligt.
Datenlage: Um diese Hypothesen zu belegen, wurde eine genomweite Expressionsanalyse durchgeführt. Hierbei zeigte sich, dass die RNA-Expression bei Implantation in den unbehandelten und reimplantierten Tumorzellen (nach Resistenz) wie auch die Tumorzellen in der Phase des Ansprechens oder der Resistenz (Zhang et al., 2011) hoch übereinstimmten. Durch die veränderte Blutversorgung in Folge der Antiangiogenesetherapie wird im Tumor Hypoxie induziert. Dies führt zur Aktivierung von Faktoren, die die Angiogenese erneut über alternative Signalwege induzieren. Es ist wichtig zu verstehen, dass hierbei nicht nur die Tumorzellen, sondern auch Zellen der Tumormikroumgebung (z. B. Fibroblasten) proangiogenetische Faktoren produzieren. Dies führt dann zur sekundären Resistenzentwicklung. Die Umkehrbarkeit der Resistenz konnte auch in einer Studie von Hammers et al. (2010) belegt werden. Unter Behandlung mit Sunitinib konnte ein Ansprechen der Lungenmetastasen eines Nierenzellkarzinoms verzeichnet werden. Parallel entwickelte der Patient Hautmetastasen. Diese resistenten Zellen der Hautmetastasen wurden in ein Mausmodell gebracht. Nach einigen Passagen erfolgte die erneute Behandlung mit Sunitinib und es konnte ein Ansprechen verzeichnet werden. Auch hier muss der Effekt auf die Tumormikroumgebung zurückgeführt werden.
In weiteren Studien konnte die Rolle der (tumorassoziierten) Fibroblasten belegt werden. Neben VEGF wird unter Hypoxie auch der Fibroblastenwachstumsfaktor (FGF) induziert, der wiederum die Angiogenese durch Hochregulation verschiedener Rezeptoren und Faktoren auf den Endothelzellen aktiviert (Lieu et al., 2001). In einem murinen Lymphommodell konnte die Rolle der Fibroblasen eindeutig belegt werden (Crawford et al., 2009). Nach Induktion der Resistenz unter Anti-VEGF-Therapie wurden Fibroblasten der resistenten Tumoren zu Tumorzellen sensitiver Tumoren gegeben. Diese steigerten das Tumorwachstum und erzeugten eine Therapieresistenz der ursprünglich sensitiven Tumoren. Die vergleichende Expressionsanalyse der Fibroblasten sensitiver und resistenter Tumoren konnte Gene identifizieren, die mit der Resistenz assoziiert sind. Dazu gehört PDGF. PDGF induziert Angiogenese über die Aktivierung der Migration von Endothelzellen.
Diese Daten führen zu folgenden Erkenntnissen:
1. Die Resistenz ist reversibel, d. h., es macht Sinn, Patienten wiederholt mit TKI zu behandeln, das zeigen auch die klinischen Erfahrungen.
2. Die Therapie sollte nicht nur auf die Tumor- und Endothelzellen, sondern auch auf die tumorassoziierten Fibroblasten gerichtet sein.
Weitere experimentelle Daten weisen auf darauf hin, dass neoadjuvante und adjuvante Konzepte für die Therapie mit TKI unter neuen Aspekten überdacht werden müssen. So zeigten Paez-Ribes et al., dass eine Behandlung von neuroendokrinen Pankreastumoren im Mausmodell zu einer erhöhten Invasion von Primärtumoren sowie einer erhöhten Rate und Anzahl von Meta stasen führt. Offensichtlich werden durch die Hypoxie auch Signalwege aktiviert, die den Tumorzellen die Fähigkeit zur Migration und Invasion verleihen und somit eine erhöhte Aggressivität schaffen. In einer anderen Arbeit wurde der Effekt einer frühzeitigen Behandlung mit Sunitinib untersucht. Hier wurden humane Mammakarzinomzellen in die Maus injiziert. Die Mäuse wurden entweder vor oder zeitnah mit der Injektion für 7 Tage mit Sunitinib behandelt. Unerwartet führten beide Formen der Therapie zu einem gesteigerten Tumorwachstum der erzeugten Metastasen im Vergleich zu den unbehandelten Tieren. Dies führt zu dem Schluss, dass durch die frühezeitige Behandlung eine Konditionierung der Tumorumgebung durch Hochregulation zirkulierender proangiogenetischer Zytokine und Wachstumsfaktoren erfolgt, die dann zur Mobilisierung von Vorläuferzellen aus dem Knochenmark führt. Damit wird eine prämetastatische Nische geschaffen, die die Ansiedlung von Tumorzellen erleichtert. Natürlich können diese Daten, auch unter Berücksichtigung der Dosierung und Dauer der Therapie, nicht einfach auf die Patientensituation übertragen werden.
Take Home Message
Mechanismen, die zur Resistenz unter den neuen zielgerichteten Therapeutika führen, sind in wesentlichen Aspekten different zu den bisher aus der Chemo- und Hormontherapie bekannten.
Die Resistenz ist häufig umkehrbar und wird wesentlich durch die Tumorumgebung gesteuert. Basierend auf den Erkenntnissen der komplexen Wechselwirkung zwischen Tumorzellen und Stromazellen sollten Therapeutika auch gegen Zellen der Tumormikroumgebung wie die Fibroblasten gerichtet sein.
Ein wiederholter Einsatz der TKI erscheint aus den bisherigen Daten sinnvoll.
Neoadjuvante und adjuvante Therapiekonzepte sollten unter der Erkenntnis, dass eine erhöhte Aggressivität von Tumorzellen induziert werden kann, kritisch überdacht werden.