Nierenerkrankung und Diabetes – wie therapieren?
Die Bezeichnung „diabetische Nephropathie“ ist veraltet, da es weltweit keinen Konsens bezüglich einer einheitlichen Definition des Begriffs gibt. Der Begriff „diabetische Nierenerkrankung“ (Diabetic Kidney Disease) sollte ebenso nicht generell verwendet werden, da impliziert wird, dass die „klassische“ Pathophysiologie des Diabetes mellitus in jedem Fall die zugrundeliegende Ursache darstellt. Sofern die Genese jedoch ausreichend gesichert ist, kann die Bezeichnung „Diabetic Kidney Disease“ (DKD) korrekt verwendet werden.1 Diese etwas akademische Begriffsklärung soll hier als Einstieg in die Komplexität des Erkrankungsbildes dienen, denn entsprechend komplex ist die optimale Therapie (siehe Abb. 1 und 2 entsprechend den neuesten KDIGO-Leitlinien).1 Ein möglicher Grund, warum der Verlauf der Niereninsuffizienz so unterschiedlich sein kann, ist die Koexistenz verschiedener Diabetes-„Cluster“, die pathophysiologisch über die Einteilung in Typ-1- und Typ-2-Diabetes plus LADA (Latent Autoimmune Diabetes in Adults) hinausgehen (wobei bei der schwersten Form der Insulinresistenz signifikant mehr DKD auftrat).3 Unsere hier vorliegende Übersicht mit dem Fokus „Therapie“ bezieht sich auf primär nichtinsulinpflichtigen Diabetes. Die chronische Nierenkrankheit mit Diabetes mellitus (hier abgekürzt als „CKDDM“) ist insbesondere in Kombination mit Adipositas im Rahmen des metabolischen Syndroms eine Hauptursache des nierenersatztherapiepflichtigen Nierenversagens in Europa und den USA.4 Der frühzeitigen Behandlung von CKDDM zur bestmöglichen Vermeidung von Spätschäden kommt eine besonders wichtige Rolle zu, da die Nierenersatztherapie (u. a. durch Hämodialyse) mit hoher Morbidität, Mortalität und hohen Behandlungskosten verbunden ist.5
Diagnostik
Die Nierenbiopsie stellt den Goldstandard in der Abklärung der CKDDM dar, ist aufgrund eines gewissen Blutungsrisikos allerdings eine im Konsens mit dem Patienten zu treffende, ärztliche Entscheidung. Die Indikation zur Biopsie wird stärker, wenn das Ergebnis mit hoher Wahrscheinlichkeit zu einer therapeutischen Konsequenz führt. Dies ist insbesondere dann der Fall, wenn andere Ursachen als Diabetes für die Nierenfunktionsstörung vermutet werden. Konsequenterweise kommt der Nierenbiopsie somit eine wichtige Rolle in der Sicherung der Diagnose bei Vorliegen von diagnostischen Unsicherheiten zu.5 Eine weiterführende, nephrologische Abklärung ist bei einem Patienten mit CKDDM unter anderem dann besonders sinnvoll, wenn Folgendes auftritt:6
- Makroproteinurie bzw. rapides Fortschreiten der Proteinurie bei gleichzeitigem Vorliegen einer normalen Nierenfunktion oder Erstdiagnose des Diabetes mellitus vor weniger als 5 Jahren
- Vorliegen einer unerklärten Mikrohämaturie (insbesondere bei auffälligem Harnsediment)
- Auftreten einer plötzlichen Verschlechterung der Nierenfunktion
- deutliche Verschlechterung der Nierenfunktion (mehr als 30 %) innerhalb von 2–3 Monaten nach Verschreibung einer Therapie mit ACE-Hemmern oder Angiotensin-Rezeptor-Blockern (Verdacht auf Nierenarterienstenose; bei beidseitigem Vorliegen wären RAS-Blocker kontraindiziert)
- Vorliegen sonstiger Hinweise auf andere Nierenkrankheiten oder weitere diagnostische Unklarheiten
Therapie
Der frühzeitigen Erkennung des Diabetes mellitus und der raschen Etablierung einer nephroprotektiven Therapie kommt eine besondere Bedeutung zu, wobei durch die Einführung der neuen Antidiabetika (Gliflozine [SGLT-2-Hemmer] und Inkretin-Mimetika [GLP-1-Rezeptor-Agonisten]) zuvor ungeahnte Möglichkeiten entstanden sind.1
Antidiabetische Therapie
Die Optimierung der Blutzuckereinstellung (BZE) stellt eine wichtige Basis in der Prävention der CKDDM dar. Der Langzeiterfolg der BZE kann über regelmäßige Messungen des HbA1c erfolgen, wobei der individuelle Zielwert von der Lebenserwartung, dem Vorliegen von Komorbiditäten, dem Vorliegen kardiovaskulärer Risikofaktoren sowie der Hypoglykämieneigung abhängt. In jüngeren, ansonsten gesunden Diabetikern wird oft ein HbA1c < 6,5 % angestrebt, wobei die gleichzeitige Vermeidung von Hypoglykämien oberste Priorität hat. Bei multimorbiden Patienten und/oder fortgeschrittenem Alter kann dieses Ziel in Abhängigkeit vom Grad der Niereninsuffizienz, vom Risiko für Hypoglykämien, vom Vorliegen von makrovaskulären Komplikationen und von der Lebenserwartung individualisiert auf bis zu 8,0 % entspannt werden. Mit zunehmender Progredienz der CKD (GFR < 30 ml/min/ 1,73 m2) nimmt die prognostische Verlässlichkeit der HbA1c-Messung ab, sodass insbesondere bei Patienten mit höherem Risiko für Hypoglykämien eine kontinuierliche Blutglukosemessung erwogen werden kann.1
Zur Medikamentenauswahl: Metformin stellt (weiterhin) die First-Line-Pharmakotherapie des (Typ-2-)Diabetes dar, muss jedoch bei einer GFR < 45 ml/min/ 1,73 m2 dosisreduziert und bei einer GFR < 30 ml/min/1,73 m2 aufgrund des Risikos für die Entwicklung einer potenziell lebensbedrohlichen Laktatazidose abgesetzt werden. SGLT-2-Hemmer verbessern das Patienten-Überleben und führen neben einer verbesserten glykämischen Kontrolle u. a. auch zu Gewichtsverlust und einer Senkung des arteriellen Blutdruckes, wobei über die verschiedenen Wirkmechanismen (neben oder durch eine Modifikation des tubuloglomerulären Feedbacks) viel diskutiert wird. Besonders Patienten mit Herzinsuffizienz profitieren von einer SGLT-2-Hemmer-Therapie, was in den großen Studien deutlich belegbar war. SGLT-2-Hemmer führen nach einer initialen Verschlechterung der Nierenfunktion (abgeschätzt durch die eGFR) zu einer Stabilisierung der Nierenfunktion. Sowohl Metformin (Laktatazidose, s. o.) als auch SGLT-2-Hemmer (inhärentes Risiko einer Ketoazidose) sind aber „sick day drugs“, welche bei akuten Erkrankungen pausiert werden müssen.1 Da die pharmakologische SGLT-2-Hemmung bei Diabetikern eine vermehrte Glukosurie hervorruft, wird bei Patienten mit komplexer urologischer Situation eine erhöhte Inzidenz an Harnwegsinfekten befürchtet, wobei die Datenlage hierzu unseres Wissens nach noch unzureichend ist. In einer Metaanalyse von 2017 konnte (nur) ein vermehrtes Auftreten von Genitalinfektionen, nicht aber von Harnwegsinfekten gezeigt werden.7 Sollte nach Beginn einer Therapie mit SGLT-2-Hemmern ein vermehrtes Auftreten von Harnwegs- und/oder Genitalinfekten beobachtet werden, macht es aus klinischer Sicht Sinn, interdisziplinär über eine Weiterführung der Therapie zu entschieden, wobei eine urologische (und ggf. gynäkologische) Abklärung klinisch vermutlich am Wichtigsten ist.
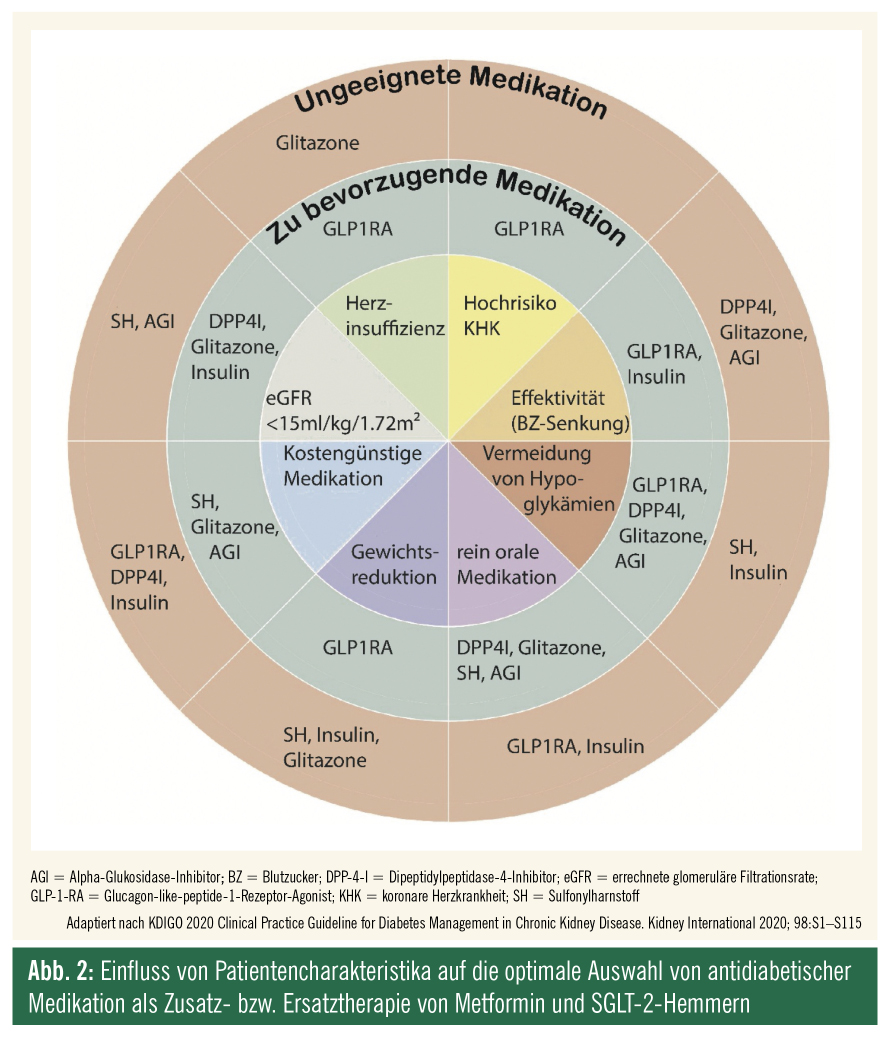
Wenn mit Metformin und SGLT-2-Hemmern keine suffiziente glykämische Kontrolle erreicht wird, sollte die antidiabetische Medikation z. B. entsprechend der in Abbildung 2 (nach KDIGO) angeführten Kriterien erweitert werden. Unter anderem aufgrund der appetitreduzierenden Wirkung und des dadurch hervorgerufenen Gewichtsverlustes profitieren insbesondere übergewichtige Patienten von einem GLP-1-Rezepter-Agonisten mit nachgewiesener Verbesserung von kardiovaskulären Outcomes (wie z. B. Liraglutid und Dulaglutid).
Auch aus nephrologischer Sicht sind die GLP-1-RA besonders interessant, da sie das Ausmaß der Proteinurie vermindern; im Gegensatz zu den SGLT-2-Hemmern führen GLP-1-RA aber nicht zu einer Stabilisierung der GFR. Sollte eine Gewichtsreduktion nicht erstrebenswert sein und aufgrund der Patientenpräferenz eine orale Therapie bevorzugt werden (wobei mit Semaglutid inzwischen auch ein oral verabreichbarer GLP-1-RA verfügbar ist), können DPP-4-Hemmer zur Anwendung kommen. Hierbei ist jedoch hervorzuheben, dass DPP-4 Hemmer – im Unterschied zu vielen GLP-1-RA – generell keinen nachgewiesenen Überlebensvorteil bringen. Sulfonylharnstoffe werden teilweise renal eliminiert, dadurch besteht die Gefahr einer Akkumulation bei CKDDM und somit Hypoglykämierisiko. Glitazone können zu Natrium- und Flüssigkeitsretention führen und bedürfen daher einer engmaschigen Kontrolle dieser Parameter.8 Bei wiederholtem Nichterreichen der individuell gesetzten Therapieziele in Hinblick auf glykämische Kontrolle trotz bestmöglicher Ausschöpfung der Therapiemöglichkeiten mittels Lebensstilmodifikation und Antidiabetika kann bzw. sollte, insbesondere bei jungen Patienten, die frühzeitige Etablierung einer Insulintherapie angedacht werden.1
Blutdrucktherapie und RAS-Modifikation
Neben der Optimierung der antidiabetischen Therapie stellt die Einstellung der arteriellen Hypertonie eine weitere grundlegende Stütze in der CKDDM-Therapie dar (siehe Abb. 1 nach KDIGO). Obgleich zahlreiche Studien einen generellen nephroprotektiven Effekt durch optimal eingestellten Blutdruck nahelegen, ist ein besonderer Vorteil einer Therapie mit Renin-Angiotensin-System-(RAS-)Blockern hervorzuheben, insbesondere bei Diabetikern mit Proteinurie. Angiotensin-converting-Enzym-(ACE-)Hemmer und Angiotensin-Rezeptor-Blocker (ARB) zeichnen sich durch einen von der reinen Blutdrucksenkung unabhängigen protektiven Effekt aus, welcher die Progredienz sowohl der Niereninsuffizienz als auch der Albuminurie verzögern kann. Ein nephroprotektiver Effekt konnte auch bei normotensiven diabetischen Patienten nachgewiesen werden. Aus diesem Grund kann eine RAS-Blockade auch bei normotensiven Patienten mit CKDDM etabliert werden und ist bei Proteinurie besonders sinnvoll. ACE-Hemmer und ARB sind in ihrer Wirkung gleichwertig, eine Kombination von beiden führt bei einer stark erhöhten Gefahr von Nebenwirkungen zu keinem zusätzlichen Benefit und ist kontraindiziert.1
Da die RAS-Blockade jedoch insbesondere bei fortgeschrittener CKDDM zu potenziell gefährlichen Hyperkaliämien führen kann, sollten regelmäßige Kontrollen der Serum-Elektrolyte erfolgen.9
Lebensstilmodifikation
Analog zu allgemeinen Strategien zur Vermeidung von Komplikationen des Diabetes mellitus ist die Lebensstiloptimierung die offenkundigste, wenngleich auch eine schwierig umzusetzende Form der Prävention. Hierbei ist Nikotinkarenz von besonderer Wichtigkeit, wobei auch der Abbau von Körperfettmasse und das Ausüben von Sport vorteilhaft sind. Empfohlen werden wöchentlich zumindest 150 Minuten moderate körperliche Aktivität. In Hinblick auf die optimale Proteinzufuhr gibt es – unseres Wissens nach – weder für eine proteinarme noch eine proteinreiche Ernährung hinreichende Evidenz für eine allgemeine Empfehlung.
Zusammenfassung
CKDDM ist ein komplexes Erkrankungsbild mit der gefürchteten Langzeitkomplikation eines nierenersatztherapiepflichtigen Nierenversagens. Bei Hinweisen auf das gleichzeitige Vorliegen einer anderen Nierenerkrankung oder Zweifeln an der Diagnose ist eine rasche nephrologische Zuweisung sinnvoll. Die RAS-Blockade und Etablierung einer Therapie mit SGLT-2-Hemmern stellt inzwischen eine wichtige Grundlage in der Pharmakotherapie zur Erhaltung der Nierenfunktion für die meisten CKDDM-Patienten dar (siehe Abb. 1 nach KDIGO). Auch eine Personalisierung der pharmakologischen Therapie ist darüber hinaus sinnvoll (siehe Abb. 2 nach KDIGO), wobei viele Patienten, insbesondere jene mit Adipositas und Hochrisiko-KHK, neben einer Lebensstilmodifikation von GLP-1-RA profitieren.1 Die hier vorliegende Übersicht ist unvollständig, insbesondere hinsichtlich weiterer, u. U. zu personalisierender Therapie (z. B. Lipidsenker, Thrombozytenaggregationshemmung, moderne diätetische Konzepte). In diesem Sinne sei auch darauf hingewiesen, dass der rezente Consensus Report der American Diabetes Association10 sich weniger strikt an fixen HbA1c-Grenzwerten orientiert, wodurch die Behandlung der Hyperglykämie beim Typ-2-Diabetes „noch personalisierter“ geworden ist. Es besteht Hoffnung, dass diese grundlegend geänderten Therapiekonzepte, insbesondere die neuen Antidiabetika, den Verlauf von CKDDM nachhaltig verbessern werden.
- KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney International 2020; 98:1–115
- Yamanouchi M et al., Clin Exp Nephrol 2020; 24:573–81
- Ahlqvist E et al., The Lancet Diabetes & Endocrinology 2018; 6:361–9
- Koye DN et al., Adv Chronic Kidney Dis 2018; 25:121–32
- Davies MJ et al., Diabetes Care 2018: dci180033
- Espinel E et al., J Clin Med 2015; 4:998–1009
- Liu J et al., Sci Rep 2017; 7:2824
- Ma Y et al., Int J Nephrol 2020; 2020:2917474
- Wang K et al., Kidney and Blood Pressure Research 2018; 43:768–79
- Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes–2020. Diabetes Care 2020; 43:S98–S110