15d-PGJ2 beim metastasierenden Melanom
Die im Journal PLoS One im September 2012 veröffentlichte Arbeit „Proteome analysis identified the PPARγ ligand 15d-PGJ2 as a novel drug inhibiting melanoma progression and interfering with tumor-stroma interaction“ beschäftigt sich mit der Analyse und Evaluierung der Substanz 15d-PGJ2 im metastasierenden Melanom. Trotz neu entwickelter und wirksamer Substanzen im Bereich des metastasierenden Melanoms besteht hier aufgrund von früher Resistenzentwicklung ein hoher Bedarf an therapeutischen Substanzen, die als interessante Kombinationspartner dienen könnten.
Hintergrund
Eine vielversprechende Substanzklasse stellen die Liganden des Peroxisome-Proliferator-aktivierenden-Rezeptors (PPAR) dar. PPAR zählen zu der nukleären Hormonrezeptor-Superfamilie und lassen sich in drei Subtypen unterteilen: PPARα, PPARγ und PPARδ/β. Die Rolle dieser Rezeptoren wurde ursprünglich dem Lipid- und Lipoproteinmetabolismus, der Glukosehomöostase und der zellulären Differenzierung zugeschrieben. In weiteren Studien konnte jedoch gezeigt werden, dass sie eine profunde antineoplastische Aktivität über Inhibierung von Zellproliferation, Blockade des Zellzyklus und Induktion von Apoptose hervorrufen.
In der Forschungsarbeit evaluierten wir die potenziell therapeutischen Effekte von PPAR-Agonisten im Melanom, indem wir in einem ersten Schritt PPARα- und -γ-Agonisten auf ihre Fähigkeit, Tumorzellproliferation in vitro zu blockieren, analysierten. Ciglitazon, Troglitazon und WY14643, ein PPARα-Agonist, zeigten nur einen moderaten Effekt, wohingegen 15d-PGJ2 in allen ausgetesteten Melanomzelllinien deutliche Antitumoreffekte erzielte.
Eine besondere Rolle in der Tumorprogression wird dem Mikroenvironment, bestehend aus Fibroblasten, Gefäßen, dem Immunsystem und der Extrazellulärmatrix (EZM), zugeschrieben. Fibroblasten als ein Bestandteil des Tumormikroenvironments stimulieren die Tumorprogression und -metastasierung, indem sie zum „Remodelling“ der Extrazellulärmatrix führen und parakrin das Tumorwachstum fördern. Es entstehen dabei synergistische Zell-Zell-Kooperationen zwischen Tumorzelle und Tumorstroma. Des Weiteren produziert der Tumor pro-angiogenetische Faktoren, die das Einsprossen von Gefäßen und damit die Zufuhr von Nährstoffen und Sauerstoff und die hämatogene Metastasierung ermöglichen.
Methodik und Ergebnisse
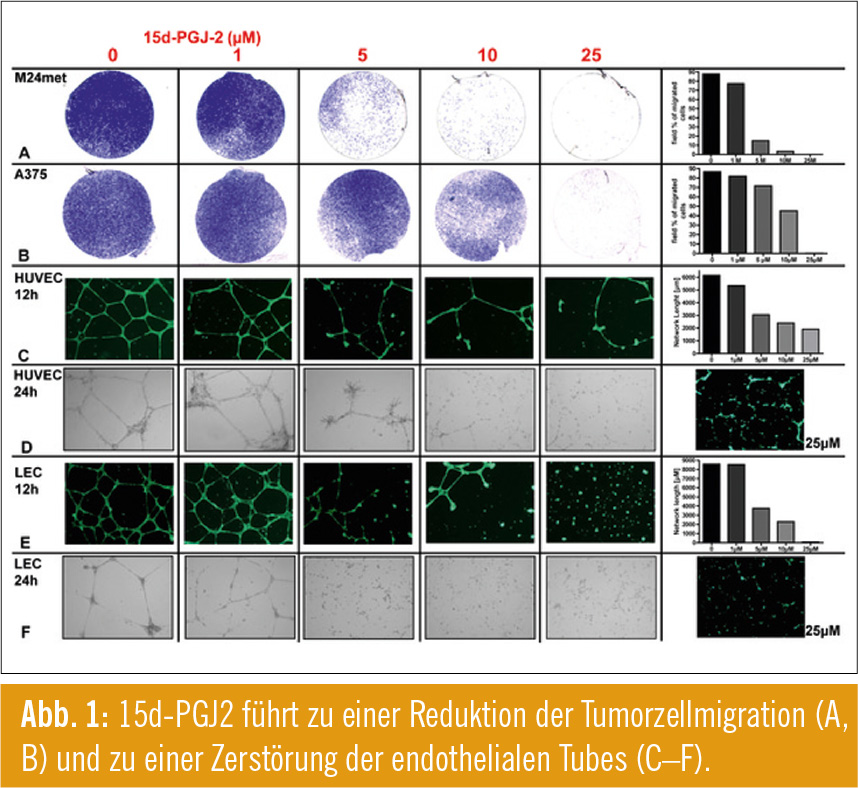
Neben der Evaluierung der Blutgefäße ist auch die Analyse der Lymphgefäßformation von hohem Interesse, da die Metastasierung des Melanoms primär hauptsächlich über den lymphogenen Weg erfolgt. Um die Wirkung von 15d-PGJ2 im Bereich des Tumormikroenvironments zu demonstrieren, führten wir u. a. Zellmigrations-Assays mit Melanomzellen und Tube-Formation-Assays mit lymph- und blutendothelialen Zellen durch. Hier konnten wir mittels Calcein-Färbungen im Tube-Formations-Assay zeigen, dass 15d-PGJ2 zur Destruktion, nicht aber zur Apoptose von endothelialen Zellen führt (Abb. 1C–F). Mittels eines Zellmigrations-Assays detektierten wir zudem eine 15d-PGJ2-induzierte Blockade der Tumorzellmigration (Abb. 1A, B).
Um weitere zugrunde liegende Mechanismen zu analysieren, führten wir in Zusammenarbeit mit Prof. Gerner Proteomanalysen durch, welche durch die Erfassung der gesamten Proteinexpression von unbehandelten und behandelten Melanomzellen ein möglichst vollständiges Bild des Wirkmechanismus ermöglichen. In diesem Ansatz analysierten wir systematisch das Profil der Melanomzellen mittels Massenspektrometrie („shotgun proteomics“) und 2-D-Gelelektrophorese.
Durch die Anwendung der rezent etablierten CPL/MUW-Datenbank und dem dort integrierten bioinformatischen Klassifikationstool war es uns möglich, Proteinsignaturen herauszuarbeiten. Wir konnten u. a. zeigen, dass Proteine reguliert wurden, die in die Angiogenese – wie das „angioassoziierte migratorische Protein“ – und Metastasierung sowie in die Zellmigration und Interaktion mit dem EZM – wie „Paxillin“ oder die „Matrix-Metalloproteinase-2 (MMP-2)“ – involviert sind (Abb. 2A–C). Matrix-Metalloproteinasen spielen eine Rolle beim Verdau der EZM und ermöglichen den Melanomzellen zu metastasieren.
Um diesen Befund zu verifizieren, führten wir einen Zymographie-Assay durch und konnten die dosisabhängige Reduktion durch 15d-PGJ2 von MMP-2 verifizieren (Abb. 2D).
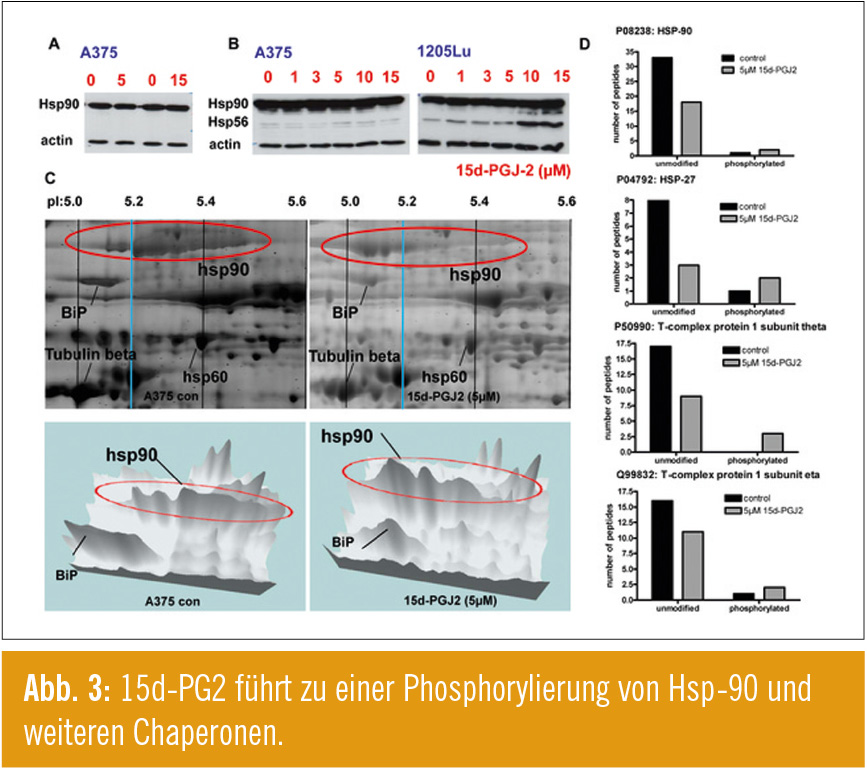
Neben diesen Befunden war insbesondere in den Proteomanalysen auffällig, dass 15d-PGJ2 Chaperone reguliert, u. a. auch das Hitzeschockprotein 90 (Hsp-90). Diese Regulation konnte jedoch im Western Blot nicht bestätigt werden (Abb. 3A, B), sodass der Verdacht einer posttranslationellen Modifizierung im Raum stand. Ein erster Hinweis hierfür konnte mittels 2-D-Gelelektrophorese erbracht werden, da es unter der Behandlung von 15d-PGJ2 zu einem pH-Shift von Hsp-90 kommt (Abb. 3C). Um diesen Befund zu verifizieren, führten wir Phosphoproteomics durch. Hier konnten wir die Hinunterregulation der Chaperone durch 15d-PGJ2 erneut aufzeigen und verifizieren, dass diese vergesellschaftet mit einer gesteigerten Phosphorylierung dieser Chaperone auftritt (Abb. 3D).
Resümee
Zusammenfassend ist es sehr bemerkenswert, dass 15d-PGJ2 als einzelne Wirksubstanz eine profunde Aktivität sowohl auf Melanomzellen und das Tumormikroenvironment zeigt und in bedeutende Prozesse wie Proliferation, Tumorzellmigration, Angiogenese und Lymphangiogenese eingreift. Hsp-90 ist bekannt dafür, dass es als zentrales Protein in diese Schlüsselprozesse der Tumorprogression eingreift. Somit könnte 15d-PGJ2 ein interessanter therapeutischer Ansatz für Kombinationstherapien beim Melanom und auch zur Überwindung von Resistenzen darstellen. Durch das Verständnis des zugrunde liegenden Mechanismus mittels Einsatz von neuen Technologien zur Evaluierung und mechanistischer Analyse innovativer Wirksubstanzen könnte es damit in Zukunft möglich sein, rationale Therapiekonzepte beim metastasierenden Melanom zu entwickeln.