Allergologie: Neues zur Insektengiftallergie
Anhand einer aktuellen Erhebung liegt die Prävalenz systemischer Stichreaktionen in Österreich bei ca. 3,3 %. Eine allergologische Abklärung erfolgte allerdings nur bei 59 % der Betroffenen und lediglich 18 % der Patienten mit schwerer Anaphylaxie wurden einer spezifischen Immuntherapie (SIT) zugeführt. Hochgerechnet leben in Österreich über 100.000 ungeschützte insektengiftallergische Personen.1
Komponentendiagnostik auf dem Vormarsch
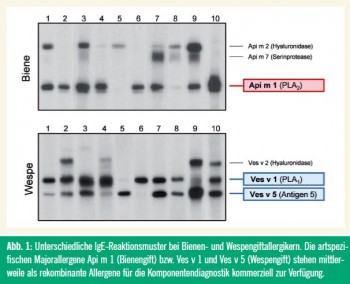
Große Fortschritte wurden im Bereich der In-vitro-Diagnostik durch die rezente Verfügbarkeit rekombinanter Insektengiftallergene gemacht. Schwachpunkt der herkömmlichen Testung mit Gesamtgiften ist die häufige Doppelpositivität auf Bienen- und Wespengift. Eine Reihe neuer Publikationen zeigt, dass die komponentenbasierte Diagnostik die Differenzierung zwischen echter Doppelsensibilisierung und Kreuzreaktivität erheblich erleichtert.2–5 Die Zahl doppelt-positiver Befunde ging dabei von über 50 % auf ca. 25 % zurück.
Probleme bestehen aber noch bei der Sensitivität dieser Tests, da noch nicht alle relevanten Komponenten verfügbar sind. Relativ unkompliziert stellt sich die Situation beim Wespengift dar, wo mit den beiden kommerziell erhältlichen Hauptallergenen Ves v 1 (Phospholipase) und Ves v 5 (Antigen 5) nahezu alle Sensibilisierten erfasst werden können.6 Die früher als wichtig erachtete Hyaluronidase (Ves v 2) repräsentiert lediglich ein Minorallergen.6
Weniger zufrieden stellend ist die Situation derzeit beim Bienengift. Während in manchen rezenten Studien bei über 95 % der Bienenallergiker IgE gegen das Majorallergen Api m 1 (Phospholipase A2) vorlag2, 3, beträgt die Sensitivität des ImmunoCAP rApi m 1 im Routinebetrieb nur 57–82 %.4, 5, 7 Ursache könnte eine suboptimale Faltung des rekombinanten Proteins sein; andererseits finden sich zunehmend Hinweise, dass die Sensibilisierungsprofile bei Bienengiftallergikern komplex sind und diverse (vermeintliche) Minorallergene wichtiger als bisher angenommen.
Eine ausreichende Sensitivität ist wohl nur durch Kombination mehrerer Einzelkomponenten zu erreichen. Ein diagnostisch wichtiges neues Allergen könnte dabei Api m 10 (carbohydrate-rich protein) sein, das von 50 % der Seren erkannt wird, aber in kommerziellen Impfstoffen offensichtlich unterrepräsentiert ist.8 Hier ergibt sich auch die Frage nach einem Zusammenhang mit dem im Vergleich zum Wespengift geringeren Therapieerfolg bei Bienengiftallergikern.
Der Basophilen-Aktivierungstest (BAT) – gut, aber nicht unfehlbar
Der BAT gilt nicht nur als sensitiver, additiver In-vitro-Test, sondern hat sich in der jüngeren Vergangenheit speziell bei doppelt- positiver Befundkonstellation wegen seiner im Vergleich zu anderen Diagnoseverfahren höheren Spezifität als hilfreich erwiesen. Eine rezente Studie konnte allerdings glaubhaft nachweisen, dass auch Basophile durch CCDs aktiviert werden (wenngleich auch schwächer als durch „echte“ Allergene) und somit auch der BAT „falsch doppelt-positive“ Ergebnisse liefern kann.9 Die teilweise unbefriedigende Kongruenz verschiedener Testverfahren führt eine Studie von STURM et al. vor Augen, in der BAT, Komponentendiagnostik und Western Blots zwar meistens, aber keineswegs immer übereinstimmende Ergebnisse lieferten.10
Monitoring und Erfolgsprädiktion bei der Immuntherapie
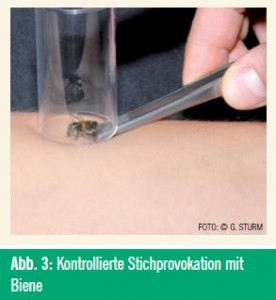
Die Stichprovokation wird in vielen Positionspapieren zur Überprüfung des Therapieerfolges ausdrücklich empfohlen, in der Praxis stößt aber deren Durchführung auf Limitationen. Als alternatives, serologisches Monitoring-Instrument wurde zuletzt mehrfach der BAT propagiert, sofern submaximale Allergenkonzentrationen für die Zellstimulation eingesetzt werden. Unter diesen Bedingungen konnte eine signifikante und möglicherweise prädiktiv nutzbare Abnahme der Stimulierbarkeit während der SIT beobachtet werden.11 Wie verlässlich die verminderte zelluläre Reaktivität mit einer negativen Stichprovokation einhergeht, ist noch offen. Entscheidend wird sein, mit welcher Wahrscheinlichkeit Aussagen über das Risiko des einzelnen Patienten getroffen werden können.
Innovativ und in puncto Erfolgsprädiktion viel versprechend sind auch Untersuch ungen zu Genexpressionsmustern bei SIT-Patienten. Demnach weisen geschützte Patienten und solche unter laufender SIT im Vergleich zu Therapieversagern konsistente Unterschiede in der Expression bestimmter Gene auf.12 Anhand solcher Expressionsprofile könnte eine individuelle Prognose über den erreichten Schutzstatus möglich werden.
Risikofaktor Mastozytose
Das schon länger bekannte erhöhte Anaphylaxierisiko bei Patienten mit Mastozytose oder erhöhter basaler Mastzelltryptase konnte in einer umfangreichen multizentrischen Studie an fast 1.000 Patienten bestätigt werden.13 Diese Assoziation scheint eine Besonderheit der Insektengiftallergie zu sein, während sie bei Nahrungsmittelund Medikamenten-induzierten Anaphylaxiefällen viel seltener zu finden ist.14
Die Durchführung einer SIT bei Mastozytosepatienten wird mittlerweile generell befürwortet.15 Bei Therapieversagern konnte nach Erhöhung der Erhaltungsdosis auf 200 μg meist ein wirksamer Schutz erreicht werden, diskutiert wird auch eine A-priori-Therapie mit 200 μg bei Vorliegen entsprechender Risikofaktoren. 15 Die kasuistisch mittlerweile gut dokumentierte Co-Medikation mit Omalizumab bei wiederholten anaphylaktischen Nebenwirkungen wird in den neuesten Leitlinien explizit als Möglichkeit angeführt, auch wenn kontrollierte Studien dazu noch fehlen.15, 16
Hinsichtlich der Therapiedauer wird bei Mastozytose- und anderen Hochrisikopatienten zunehmend eine lebenslange Behandlung empfohlen.15 Theoretisch unterstützt wird dies durch Beobachtungen von VARGA et al. an Kindern während und nach SIT, wonach die im Zuge der Therapie induzierten, mutmaßlich protektiven IgG4-Antikörper nach Therapieende rasch auf die Ausgangswerte zurückfallen.17 Der Langzeiteffekt der Insektengift-SIT könnte demnach eher im kontinuierlichen Verlust der IgE-Antikörper und weniger in einer persistierenden protektiven Immunantwort liegen. Spannende Erkenntnisse lieferten Genexpressionsanalysen bei Mastozytosepatienten mit bzw. ohne Insektengiftanaphylaxie, bei denen sich bezüglich zahlreicher, insbesondere bei der Zelldifferenzierung involvierter Gene konsistente Unterschiede fanden.18 Die Daten sprechen dafür, dass weniger die Mastzellzahl als vielmehr deren Differenzierungszustand für das Anaphylaxierisiko relevant sind. Möglicherweise können künftig durch Erstellen von Genexpressionsprofilen Patienten mit realem Anaphylaxierisiko besser identifiziert werden.
Immuntherapie: Vorstöße bei Indikation und Durchführung
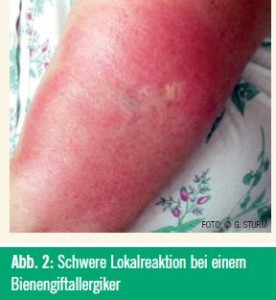
Laut Leitlinien ist die Durchführung einer SIT bei Lokalreaktionen wegen des geringen Anaphylaxierisikos nicht indiziert. In einer Pilotstudie plädiert allerdings eine renommierte amerikanische Arbeitsgruppe dafür, eine SIT ausnahmsweise auch bei ungewöhnlich starken Lokalreaktionen (> 16 cm) zu erwägen. In der kontrollierten Studie war nach einem Therapiejahr eine mittlere Reduktion der Lokalreaktionen um 50 %, nach 2–4 Jahren um 60–70 % zu beobachten.19
Ebenfalls auf eine großzügigere Indikationsstellung zielt eine holländische Studie zur Lebensqualität bei Wespengiftallergikern mit auf die Haut beschränkten Allgemeinreaktionen (Urtikaria, Angioödem) ab.20 Wurden Patienten entweder zur SIT oder einer reinen Notfallversorgung mit EpiPen® randomisiert, zeigten sich im validierten Quality-of-Life-Fragebogen bei vergleichbaren Ausgangswerten bereits nach einem Jahr signifikante Unterschiede zu Gunsten der SIT-Gruppe. Auch bei freier Therapiewahl zeigten Patienten unter SIT eine bessere Entwicklung.
Sehr kritisch zu bewerten sind Vorstöße hinsichtlich des Einsatzes der sublingualen SIT (SLIT) bei Insektengiftallergien. Studien aus Italien postulieren die potenzielle Tauglichkeit dieser Darreichungsform auch bei Insektengiftallergien21, die vorhandenen klinischen Daten lassen allerdings eine Beurteilung noch nicht zu. Hervorzuheben ist, dass es in der Studie zu keinem Anstieg spezifischer IgG-Antikörper kam, denen aber gerade hier eine zentrale protektive Rolle zugeschrieben wird.
Andere Studien beschäftigten sich mit möglichen Vereinfachungen im Routinebetrieb. So wurde eine Intervallverlängerung bei der Erhaltungstherapie in Ländern mit weitmaschiger medizinischer Versorgung oder generell zur Aufrechterhaltung der Therapieadhärenz wiederholt diskutiert. Eine rezente italienische Studie an 72 Patienten mit schweren Vorreaktionen berichtete, dass das Injektionsintervall ab dem 4. Behandlungsjahr bei unveränderter Verträglichkeit auf 12 Wochen ausgedehnt werden konnte.22 Der Impfschutz ging dabei offensichtlich nicht verloren, da es nach Feldstichen nur bei 1 von 60 Patienten zu einer allergischen Reaktion kam. Zwei nicht-kontrollierte Studien mit insgesamt 197 Kindern mit schweren Vorreaktionen befassten sich mit der Wirksamkeit einer SIT unter halbierter Erhaltungsdosis (50 μg).23, 24 Da spätere Feldstiche von 86 % bzw. 100 % der Kinder toleriert wurden, folgern die Autoren, dass die reduzierte Dosis bei Kindern vergleichbar gute Resultate liefert wie die übliche Therapie mit 100 μg.
Das Problem der latenten Sensibilisierungen
Eine wesentliche diagnostische Limitation bei der Hymenopterengift-Allergie ist die Unfähigkeit, zwischen latenter und klinisch relevanter Sensibilisierung zu unterscheiden bzw. aufgrund serologischer Parameter die Schwere zukünftiger Stichreaktionen vorherzusagen. Bis zu 27 % der Allgemeinbevölkerung sind auf Insektengifte sensibilisiert, doch welches Risiko besteht für diese Personen, beim nächsten Stich allergisch zu reagieren? Eine aufwändige Stichprovokationsstudie an der Universität Graz mit asymptomatisch Sensibilisierten hat ergeben, dass deren Anaphylaxierisiko nicht signifikant höher ist als jenes der Allgemeinbevölkerung (5,3 % vs. 3,3 %).25 Lediglich starke Lokalreaktionen traten viel häufiger auf. Die Ergebnisse bekräftigen die derzeitigen Richtlinien, Allergietests bzw. eine SIT nur bei Vorliegen einer positiven Anamnese durchzuführen.
Was gibt es Neues von Gelsen & Co?
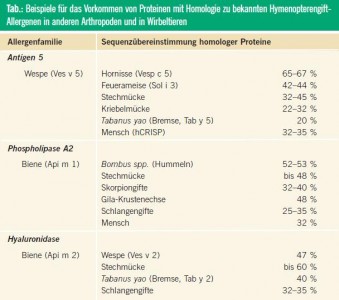
Vermutungen über eine Querverbindung zwischen Wespengiftallergie und Überempfindlichkeitsreaktionen auf Stechmücken und Bremsen („wasp-mosquitohorseflysyndrome“) wurden wiederholt geäußert. Diesbezüglich interessant sind neue Erkenntnisse über das Vorkommen von Proteinen mit zum Teil beachtlicher Sequenzhomologie zu bekannten Hymenopteren-Allergenen im Speichel von Stechmücken, Bremsen, Tsetsefliegen, Kriebelmücken und Gnitzen, die eine solche Kreuzreaktivität durchaus denkbar machen.26–28
Klinisch relevante Kreuzreaktionen könnten selbst zwischen Hymenopteren und Wirbeltieren bestehen. Beispielsweise weist das Wespen-Majorallergen Ves v 5 (Antigen 5) partielle Kreuzreaktivität mit einem homologen menschlichen Testes-Protein (hCRISP) auf. Beruhigend sind dahingehende Untersuchungen, die einen Zusammenhang zwischen Wespengiftallergie und dem Auftreten von zur Infertilität führenden Autoantikörpern gegen hCRISP ausschließen konnten.29 Jüngst wurde auch über Kreuzreaktionen auf Antikörper- und T-Zell-Ebene zwischen Bienen-Phospholipase (Api m 1) und homologen Proteinen aus Schlangengiften, Rind und Mensch berichtet.30
1 Bokanovic D, et al., Allergy 2011; 66: 1395-6
2 Müller UR, et al., Allergy 2009; 64: 543-8
3 Mittermann I, et al., J Allergy Clin Immunol 2010; 125: 1300-7
4 Hofmann SC, et al., J Allergy Clin Immunol 2011; 127: 265-7
5 Sturm GJ, et al., J Allergy Clin Immunol 2011; 128: 247-8
6 Jin C, et al., J Allergy Clin Immunol 2010; 125: 184-90
7 Korošec P, et al., J Allergy Clin Immunol 2011; 128: 671-3
8 Blank S, et al., Allergy 2011; 66: 1322-9
9 Mertens M, et al., Clin Exp Allergy 2010; 40: 1333-45
10 Sturm GJ, et al., PLoS One 2011; 6: e20842
11 Mikkelsen S, et al., Clin Mol Allergy 2010; 8: 2
12 Niedoszytko M, et al., J Allergy Clin Immunol 2010; 125: 1092-7
13 Ruëff F, et al., J Allergy Clin Immunol 2009; 124: 1047-54
14 Bonadonna P, et al., Allergy 2009; 64: 1379-82
15 Przybilla B, et al., Allergo J 2011; 20: 318-39
16 Wedi B & Ruëff F, Hautarzt 2011; 62: 663-70
17 Varga EM, et al., Clin Exp Allergy 2009; 39: 1353-7
18 Niedoszytko M, et al., Allergy 2011; 66: 648-57
19 Golden DB, et al., J Allergy Clin Immunol 2009; 123: 1371-5
20 Oude Elberink JN, et al., Clin Exp Allergy 2009; 39: 883-9
21 Patriarca G, et al., Int J Immunopathol Pharmacol 2008; 21: 669-77
22 Cavallucci E, et al., J Investig Allergol Clin Immunol 2010; 20: 63-8
23 Houliston L, et al., J Allergy Clin Immunol 2011; 127: 98-9
24 Konstantinou GN, et al., Pediatr Allergy Immunol 2011; 22: 393-7
25 Sturm GJ, et al., Allergo J 2011; 20: 195
26 Caljon G, et al., Insect Biochem Mol Biol 2009; 39: 332-41
27 Hemmer W, Allergo J 2009; 18: 359-72
28 Schaffartzik A, et al., Vet Immunol Immunopathol 2010; 137: 76-83
29 Müller L, et al., Mol Immunol 2008; 45: 3775-85 30 Sin BA, et al., Allergy 2011: Epub