Extrakorporale Photopheresefür das kutane T-Zell-Lymphom
Vor mittlerweile über 30 Jahren wurde erstmals über die Anwendung der extrakorporalen Photopherese (ECP), auch bekannt als extrakorporale Photochemo- oder Photoimmuntherapie, berichtet. Seitdem wurden zahlreiche klinische, translationale Studien für diverse Indikationen durchgeführt, die den Einsatzbereich erweiterten und die Bedeutung dieser innovativen Therapiemodalität unterstrichen. Die Universitätsklinik für Dermatologie in Wien war Teil der ersten klinischen multizentrischen Studie, bei der erstmals Patienten mit therapierefraktärem kutanen T-Zell-Lymphom (CTCL) mit ECP therapiert wurden.1 Mittlerweile liegt für diese Patientengruppe die Genehmigung der FDA (United States Food and Drug Administration) vor, und die ECP stellt nach aktuellsten Leitlinien die 1. Wahl für die Therapie der erythrodermischen Variante des CTCL, der Mycosis fungoides (MF) sowie des Sézary-Syndroms (SS) dar. Im Laufe der letzten Jahrzehnte wurden zahlreiche Experimente und klinische Studien durchgeführt, die weitere Hinweise auf den zugrundeliegenden Wirkmechanismus lieferten und zu einer Erweiterung des Indikationsspektrums führten. Studien zeigten die klinische Effizienz der ECP nicht nur beim CTCL, sondern auch bei systemischer Sklerose (SSc), Graft-versus-Host-Erkrankung (GVHD) nach allogener Stammzelltransplantation, Organtransplantation und bei Morbus Crohn. Die ECP stellt heutzutage für zahlreiche Krankheitsentitäten auch außerhalb der Dermatologie eine vielversprechende Therapieoption dar, die insbesondere auch mit anderen Therapiemöglichkeiten kombiniert werden kann.2, 3
Entwicklung und Wirkmechanismus
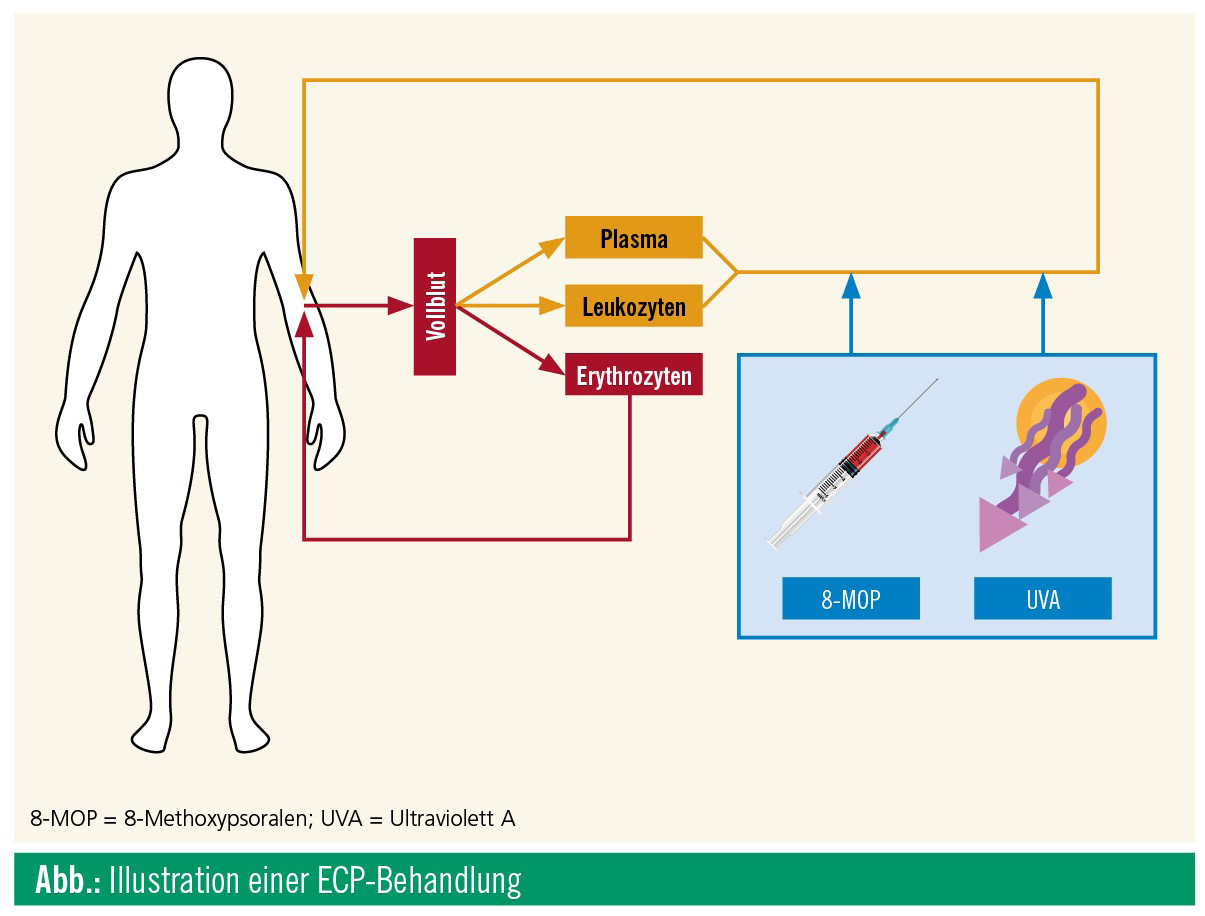
Die Entwicklung der ECP basierte initial auf dem PUVA-(Psoralen-plus-Ultraviolett-A-)Konzept, das gut bei CTCL wirkte und durch die Reinfusion der extrakorporal modifizierten Leukozyten eine vorteilhafte Immunreaktion bei Patienten mit CTCL induzieren konnte.4 Bei der ECP wird jedoch im Gegensatz zur PUVA Vollblut gesammelt und separiert. So kann der leukozytenreichen Suspension, dem sogenannten Buffy-Coat, die photosensibilisierende Substanz 8-Methoxypsoralen (8-MOP) extrakorporal hinzugefügt werden. In weiterer Folge werden die isolierten Zellen mit Ultraviolett-A (UVA) in einer maximalen Dosis von 2 J/cm2 bestrahlt, um anschließend dem Patienten wieder zurückinfundiert zu werden (Abb.). Mittels Ganzkörperszintigrafie konnten die bestrahlten Zellen durch Inidium-11-Oxin-Färbung markiert und lokalisiert werden, um die Verteilung bzw. die Zielorgane der möglichen immunologischen Reaktionen zu identifizieren.5 Nebenwirkungen wie gastrointestinale Beschwerden, die durch die herkömmliche PUVA-Therapie in Zusammenhang mit der oralen Einnahme von Psoralen bekannt waren, werden aufgrund der extrakorporalen Anwendung von 8-MOP umgangen, und zusätzlich kann eine kontrollierte Dosierung dieser Substanz erzielt werden (1/250 bis 1/550 der ursprünglichen Dosis bei PUVA).6
Seit der erstmaligen Einführung dieser innovativen Therapiemodalität hat sich das ursprüngliche Therapieschema, das eine Behandlung an zwei aufeinanderfolgenden Tagen in zwei- bis vierwöchigem Abstand vorsieht, kaum geändert. Die derzeitigen Expertenempfehlungen beinhalten das Fortführen der Therapie für mindestens vier bis sechs Monate bzw. so lange, wie es klinisch indiziert ist. Das Therapieintervall kann in weiterer Folge individuell angepasst werden. Die früher berichteten Nebenwirkungen der Therapie wie Hypotonie, Übelkeit oder Fieber konnten durch technische Weiterentwicklungen signifikant reduziert werden.
Der zugrundeliegende Wirkmechanismus ist derzeit noch nicht vollständig geklärt. Nach heutigem Wissensstand wird angenommen, dass die UVA-Bestrahlung der isolierten Zellen unter Zusatz von Psoralen ein Crosslinking der DNA bewirkt und letztendlich die Apoptose der kernhaltigen Zellen induziert. In weiterer Folge kommt es zu einer veränderten Ausschüttung von pro- und antiinflammatorischen Zytokinen. So kommt es zu einer Zunahme von Interleukin 10 (IL-10) und zu einer Abnahme des Tumornekrosefaktors α (TNF-α).7 Außerdem werden regulatorische T-Zellen (Tregs) induziert8, was den immunmodulatorischen Effekt der ECP erklären könnte. Die Bedeutung von Tregs in der ECP bestätigte sich bei diversen Indikationen wie CTCL9, GVHD10, SSc11 sowie im Organtransplantationssetting12. Zahlreiche klinische Studien konnten die Effizienz dieser Therapiemodalität zeigen und betonten vor allem die sichere und nebenwirkungsarme Anwendung.
ECP und ihr Einsatz beim CTCL
Die erste klinische Studie mit 37 Patienten zur Anwendung der ECP bei therapierefraktärem CTCL fand 1987 statt. Richard Edelson und seine Kollegen erreichten nach durchschnittlich 22 Wochen ECP-Behandlung bei 27 Patienten ein klinisches Ansprechen, wobei eine 64-prozentige Reduktion der Hautbeteiligung erreicht werden konnte.1 Seitdem wurde die ECP in zahlreichen Studien in der Therapie von MF und SS eingesetzt. Ein klinisches Ansprechen konnte bei über 60 % der Patienten erzielt werden, und die ECP bestätigte sich als nebenwirkungsarme Therapie, die auch in Kombination mit anderen wirksamen Therapiemöglichkeiten wie PUVA, Interferon oder Retinoiden (z. B. Bexaroten) sicher eingesetzt werden kann.13, 14 Laut derzeitigem Expertenkonsensus wird die ECP als 1. Wahl für die Therapie der erythrodermischen Mycosis fungoides (Stadium IIIA und IIIB) sowie des Sézary-Syndroms empfohlen.3, 15–17
Auch in Zukunft bedarf es weiterer prospektiver, randomisierter Studien, um den Einsatz der ECP in einem breiten Indikationsspektrum zu erforschen und um weitere Hinweise über den Wirkmechanismus zu erlangen. Aus diesem Grund haben sich zahlreiche Experten aus dem Gebiet der CTCL-Forschung gemeinsam mit der EORTC (European Organization for Research and Treatment of Cancer) dazu entschlossen, die sogenannte PROMPT-Studie („A Prospective, Multicenter, Single-Arm Cohort Study of Photopheresis in the Treatment of Erythrodermic MF and SS“) zu initiieren. Der Fokus dieser europaweiten multizentrischen Studie liegt in der Erforschung weiterer Biomarker, mit deren Hilfe jene Patienten identifiziert werden können, die von dieser vielversprechenden Therapie am meisten profitieren.