Das Hitzeschockprotein hsp27 und der p38-MAPK Signaltransduktionsweg – Für die reguläre epidermale Differenzierung benötigt
Hitzeschockproteine (hsp) werden von allen Zellen und Geweben exprimiert. Erhöhte Temperaturen (Hitzeschock) und andere Formen von pathophysiologischem Stress stimulieren ihre Expression. Die so genannte Hitzeschockreaktion bewirkt eine erhöhte Resistenz des betroffenen Gewebes gegenüber weiterer Stressexposition. Hsp werden intrazellulär exprimiert und sind hochkonserviert, was auf ihre grundlegende Bedeutung für ein erfolgreiches Überleben unter potenziell feindlichen Umweltbedingungen schließen lässt. Hsp lassen sich ihrem Molekulargewicht entsprechend in Familien einteilen. Die meisten hsp agieren als molekulare Chaperone (polypeptide chain binding proteins), d.h. sie binden andere Proteine und mediieren so deren Konformation, Transport und auch Interaktion mit anderen Molekülen. Die Chaperon-Funktion von hsp27 wird durch die Phosphorylierung des Proteins reguliert. Die Enzyme des p38-MAPK Signaltransduktionsweges katalysieren die stressinduzierte Phosphorylierung und Dephosphorylierung von hsp27 und somit auch seine Chaperon-Aktivität.
Rationale der Studie
Hsp27 hat ein Molekulargewicht von 27 Kilodalton und wird daher zur Gruppe der “kleinen Hitzeschockproteine” gezählt. Dieses Protein wird nahezu ubiquitär und auch in der Haut exprimiert. Epidermales hsp27 ist vorwiegend in die Regulation von Zellwachstum, Differenzierung und Tumorgenese involviert. Die Expression von hsp27 ist eng mit dem Prozess der Keratinozytendifferenzierung korreliert und analog dazu findet sich in wenig differenzierten Plattenepithel- und Basalzellkarzinomen wenig hsp27. In einer früheren Arbeit konnten wir in menschlicher Epidermis eine Co-Lokalisation von hsp27 mit Keratinen und anderen Proteinen des “cornified cell envelope” (CCE) darstellen, was in Zusammenschau mit anderen publizierten Daten die Funktion von hsp27 als Regulator in der Keratinozytendifferenzierung unterstützt.
Ziel dieser Arbeit war, die Rolle von hsp27 als Chaperon der epidermalen Differenzierung zu beleuchten. Für diese Untersuchungen wurden zwei verschiedene Modelle gewählt. Erstens wurden primäre humane Keratinozyten (KC) in unterschiedlichen Kalziumkonzentrationen kultiviert, wodurch unterschiedliche Differenzierungsstadien (niedrig bis hoch) induziert werden. In weiterer Folge wurde ein organotypisches In-vitro-Hautmodell (skin equivalent; SE) hergestellt. In beiden angeführten Modellen wurde der p38-MAPK Signaltransduktionsweg durch spezifische Inhibition mittels einer pharmakologischen Substanz (SB 203580) gehemmt. In SE wurde hsp27 durch spezifische RNA-Interferenz herunterreguliert (Knock-down).
Ergebnisse
Die Hemmung des p38-MAPK Signaltransduktionsweges reguliert die Expression von hsp27 und modifiziert die Differenzierung in KC und SE.
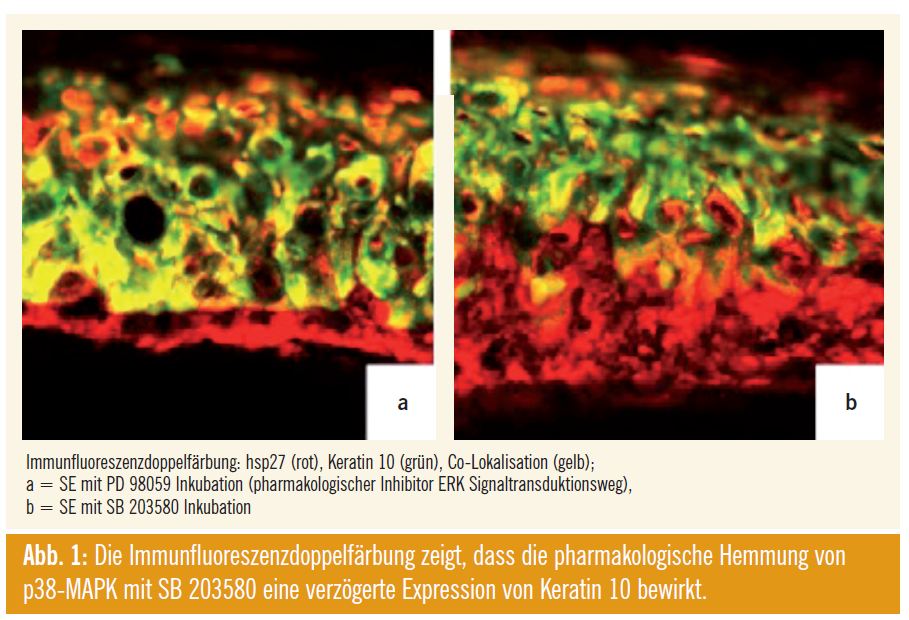
Einerseits zeigte sich durch Inhibierung von p38-MAPK die Expression von hsp27 selbst in beiden Modellen herunterreguliert. Andererseits wurde die kalziumabhängige Induktion der differenzierungsassoziierten Proteine Filaggrin und Loricrin durch pharmakologische Inhibierung des Signaltransduktionsweges gehemmt. Gleichzeitig resultierte eine Hemmung der Expression von Filaggrin, Keratin 10 und Transglutaminase 1 auf mRNA-Niveau unter den oben angeführten experimentellen Bedingungen. Die pharmakologische Hemmung von p38- MAPK in SE bewirkte auch morphologisch eine irreguläre Differenzierung, eine Zerstörung der epidermalen Schichten und eine verzögerte Expression von Keratin 10 (Abb. 1).
Der “Knock-down” von hsp27 in SE stört die epidermale Entwicklung und verzögert den “Switch” von basalen zu suprabasalen Keratinen.
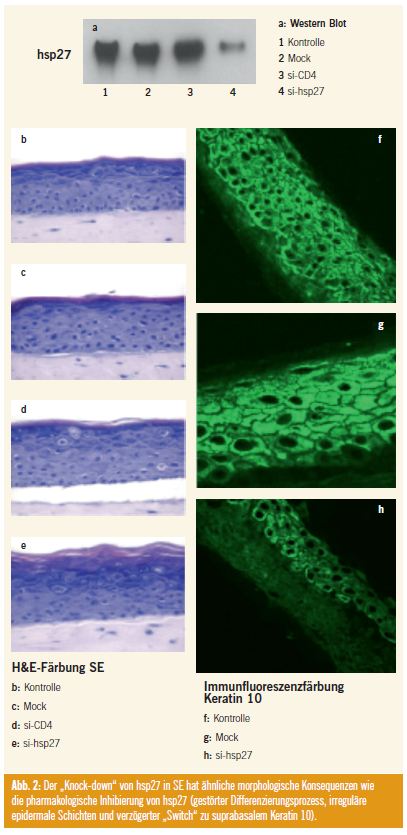
Durch eine spezifische siRNA konnte in der SE hsp27 fast komplett herunterreguliert werden. Es zeigten sich hierdurch fast idente morphologische Verhältnisse wie bei der pharmakologischen Inhibierung der hsp27-Phosphorylierung. Die Immunhistochemie der SE zeigte ebenfalls einen gestörten Differenzierungsprozess, irreguläre epidermale Schichten und einen verzögerten “Switch” zu suprabasalem Keratin 10. Zusätzlich waren histologisch eine Hyperkeratose und keine Abflachung der Keratinozyten in der oberen Epidermis ersichtlich (Abb. 2).
Diskussion und Ausblick
Unsere Ergebnisse demonstrieren, dass die Inhibierung der hsp27-Phosphorylierung über p38-MAPK mit der Keratinozytendifferenzierung interferiert und somit sowohl hsp27 als auch der p38-MAPK Signaltransduktionsweg für eine reguläre Verhornung benötigt werden. Hsp27 dürfte hier als wichtiges Substrat des p38-MAPK in differenzierenden Keratinozyten agieren, ähnlich der kürzlich pub lizierten Interaktion von hsp27 mit Filaggrin über Phosphorylierung durch die Proteinkinase Akt. Unsere Daten haben gezeigt, dass sowohl durch Hemmung der hsp27-Phosphorylierung als auch durch spezifischen hsp27-“Knockdown” die Regulation differenzierungsabhängiger Proteine wie Filaggrin, Loricrin, Transglutaminase 1 und Keratin 10 modifiziert werden. Filaggrin-Mutationen führen beim Menschen zu Ichthyosis vulgaris und werden mit der Pathogenese von atopischer Dermatitis assoziiert. Die reduzierte Filaggrin-Expression, die wir in unserem Modell über Inhibierung der hsp27-Phosphorylierung induziert haben, könnte somit für die beobachteten morphologischen Veränderungen in den SE verantwortlich sein. Gleichzeitig könnten die Hyperkeratose sowie die verzögerte Expression der suprabasalen Keratine eventuell direkt durch verminderte hsp27-Expression verursacht sein.
In einer anderen Studie konnten wir eine verminderte Expression von hsp27 in läsionaler Haut bei Patienten mit den seltenen hereditären Verhornungsstörungen bullöse ichthyosiforme Erythrodermie (BIE) und anuläre epidermolytische Ichthyose (AEI) aufzeigen. Beiden Erkrankungen liegt Mutation, Verlust oder Dysfunktion von basalen und suprabasalen Keratinen zu Grunde. Hsp27 dürfte hier an die pathogenetisch veränderten Tonofilamente nicht binden können und so subsequent abgebaut werden. Wie bereits einleitend erwähnt, konnten wir in Co-Lokalisationsstudien belegen, dass hsp27 in der oberen Epidermis vor allem mit Tonofilamenten assoziiert ist.
Zusammenfassung
Wir konnten zeigen, dass es mit dem SE-Modell möglich ist, die Funktion einzelner Gene und Proteine im Rahmen der Keratinozytendifferenzierung gleichzeitig auf molekularer und morphologischer Ebene zu untersuchen. Hsp27 besitzt mehrere Funktionen bei der Erhaltung einer regulären epidermalen Differenzierung. Mangelnde Expression oder blockierte Phosphorylierung führt zu Differenzierungsstörungen auf verschiedenen Ebenen mit resultierender Verhornungsstörung.
Hsp27 und andere epidermale Chaperone, welche mit der ständigen Erneuerung der physiologischen epidermalen Barriere assoziiert sind, könnten daher neue pharmakologische Angriffspunkte für die Behandlung von hereditären und erworbenen Verhornungsstörungen darstellen.
| The hsp27 kD heat shock protein and p38-MAPK signaling are required for regular epidermal differentiation. Constanze Jonak, Michael Mildner, Gabriele Klosner, Verena Paulitschke, Rainer Kunstfeld, Hubert Pehamberger, Erwin Tschachler, Franz Trautinger. Journal of Dermatological Science 61 (2011): 32-3 |
Literatur:
– Linquist S, Craig SA. The heat shock proteins. Annu Rev Genet 1988; 22: 631-7
– Welsh MJ, Gaestel M. Small heat shock protein family: Function in health and disease. Ann N Y Acad Sci 1998; 851: 28-35
– Trautinger F, et al., Expression of the 27kDa heat shock protein in human epidermis and in epidermal neoplasms: An immunhistological study. Brit J Dermatol 1995; 133: 194-202
– Jonak C, et al., Subcorneal colocalization of the small heat shock protein, hsp27, with keratins and proteins of the cornified cell envelope. Brit J Dermatol 2002; 147: 13-9
– O’Shaughnessy RF, et al., Akt-dependant hspB1(hsp27) activity in epidermal differentation. J Biol Chem 2007; 282: 17297-305
– Jonak C, et al., The expression of the 27kD heat shock protein in keratinization disorders: An immunhistological study. Hum Pathol 2005; 36: 686-93