Kopfhaut- und Haarerkrankungen
Kopfhaut- und Haarerkrankungen zählen zu den häufigsten Indikationen, derentwegen Patienten dermatologische Ambulanzen und Facharztordinationen aufsuchen. Das Spektrum der Trichologie ist äußerst breit und reicht vom seborrhoischen Kopfhautekzem über die vorwiegend bei Kindern auftretenden infektiösen Kopfhauterkrankungen (Pediculosis capitis, Trichomykosen) bis hin zu den seltenen genetischen Haarerkrankungen und den zahlreichen unterschiedlichen Formen der nichtvernarbenden oder vernarbenden Alopezien. Dennoch, und ein wenig paradoxerweise, nimmt die Trichologie in der deutschsprachigen Dermatologie eine eher untergeordnete Rolle ein, was auf unterschiedliche Faktoren zurückzuführen ist. Einer der Gründe ist, dass die Abklärung von trichologischen Problemen nicht nur ein entsprechendes Wissen voraussetzt, sondern meist auch viel Zeit und Einfühlungsvermögen erfordert, da Haarverlust insbesondere für Frauen oft ein sehr beunruhigendes und belastendes Ereignis darstellt.
Trichologische Grundlagen
Auf einer gesunden Kopfhaut befinden sich je nach Pigmenttyp zwischen 85.000 (rote) bis 140.000 (blonde) Haare. Die Haarfülle wird aber nicht nur von der Anzahl der Haare, sondern auch von der Haardicke, welche mit zunehmendem Alter abnimmt, bestimmt. Die Gesamtzahl der Haare (Kopfhaut und Körperhaare) beträgt in etwa 5.000.000.
Haare sind einem asynchronen Wachstumszyklus unterworfen, wobei man 3 Phasen unterscheidet: Anagen (Wachstumsphase), Katagen (Übergangsphase), Telogen (Ruhe- oder Endphase). Die Anagenphase, in der sich 85–90 % aller Haare befinden, dauert zwischen 2 und 7 Jahre und bestimmt die maximale Haarlänge. Bei einem durchschnittlichen Wachstum von 0,3 bis 0,5 mm pro Tag bzw. 15 cm pro Jahr ergibt sich daraus eine maximale Haarlänge von 1 m, die im Einzelfall allerdings auch wesentlich mehr betragen kann. Die Katagenphase dauert 2–3 Wochen, in ihr befinden sich ca. 1 % aller Haare. In dem Stadium der Telogenphase, welches 2–4 Monate dauert, sind bis zu 15 % aller Haare. Ein Haarausfall von bis zu 100 Haaren täglich wird als normal angesehen.
Die Steuerung des Haarzyklus ist extrem komplex und unterliegt neben genetischen und hormonellen Faktoren auch exogenen Einflüssen wie z. B. Toxine, Nährstoffe, Medikamente und Stress. Haarwurzelzellen sind äußerst stoffwechselaktiv, weshalb der durch zytostatische Therapien hervorgerufene (fast immer reversible) Haarverlust zu den psychisch am meisten beeinträchtigenden Nebenwirkungen von Chemotherapien gezählt werden muss.
Spezifische dermatologische Untersuchungstechniken
Trichogramm: Durch ein Trichogramm, bei dem eine definierte Anzahl von Haaren mit einer Epilierklemme ausgerissen wird, kann man lichtmikroskopisch sowohl Haarschaftanomalien erkennen als auch anhand des Aussehens der Haarwurzeln feststellen, wie viele Haare sich prozentuell in den einzelnen Wachstumsphasen befinden und dadurch einen diagnostischen Hinweis auf die Ursache eines Haarausfalles gewinnen. Trichogramme sind heutzutage weitgehend von der Trichoskopie abgelöst worden, können aber bei speziellen Fragestellungen (z. B. genetisch bedingte Haarschaftanomalien, Loose Anagen Syndrome, Verdacht auf chronisches Telogeneffluvium) diagnostisch wegweisend sein.
Trichoskopie: Analog zur Dermatoskopie, der auflichtmikroskopischen Analyse von neoplastischen oder entzündlichen Hautveränderungen, ist auch die Trichoskopie längst als essenzielles diagnostisches Verfahren zur Abklärung von Kopfhaut- und Haarerkrankungen etabliert. Die vielfache Vergrößerung der Kopfhautoberfläche und Haarschäfte erlaubt nicht nur eine Differenzierung zwischen unterschiedlichen Haardicken (Terminalhaare,intermediäre Haare und Vellushaare), was bei der Diagnostik der androgenetischen Alopezie zum Tragen kommt, sondern vermittelt auch wesentliche diagnostische Hinweise bei der Differenzialdiagnostik von entzündlichen Kopfhauterkrankungen.
Hautbiopsie: Hautbiopsien sind ein integraler Bestandteil der dermatologischen Diagnostik, haben aber bei Kopfhaut- und Haarerkrankungen nur eine untergeordnete Rolle. Sinnvoll sind Hautbiopsien mit HE-(Hämatoxylin-Eosin-)Färbung und immunhistochemischer Aufarbeitung bei unklaren vernarbenden Alopezien, Verdacht auf diffuse Alopecia areata und eventuell zur Unterscheidung einer androgenetischen Alopezie von einem chronischen Telogeneffluvium.
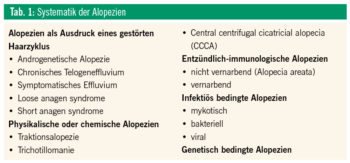
Einteilung der Alopezien
Eine Systematik der Kopfhaut- und Haarerkrankungen, die zu reversiblen oder permanenten Alopezien führt, ist in Tabelle 1 angeführt. Im Folgenden wird auf die androgenetische Alopezie, symptomatische Telogeneffluvien, Alopecia areata und vernarbende Alopezien eingegangen.
Androgenetische Alopezie (AGA)
Bei der androgenetischen Alopezie handelt es sich um eine genetisch bedingte, androgenabhängige Alopezie mit charakteristischem Muster („male oder female pattern hair loss“). AGA ist die mit Abstand häufigste Form der Alopezie. Die Prävalenz bei kaukasischen Männern mit 50 Jahren beträgt ≥ 50 %, bei Männern im höheren Alter bis zu 70 %. Die Prävalenz bei Frauen bis 50 Jahre beträgt 16 %, bei Frauen von ≥ 70 Jahren mehr als 30 %. Bei Schwarzen oder Asiaten ist die Prävalenz geringer. Der zugrunde liegende Pathomechanismus ist eine zunehmende Verkürzung der Anagenphase, welche zu einer Miniaturisierung der Haarfollikel und Übergang der Terminalhaare in intermediäre und Vellushaare führt. Eine zentrale Rolle bei der Entstehung der AGA spielt das Dihydrotestosteron (DHT), welches durch die Metabolisierung von Testosteron durch die 5α-Reduktase gebildet wird. DHT bindet intrazellulär an den Androgenrezeptor (AR), was zu einer Konformitätsänderung und Translokation des Rezeptors in den Zellkern führt, wo er als Dimer an das Androgen Response Element androgenregulierter Gene bindet und deren Transkription aktiviert.
Eine entscheidende Rolle bei der Entstehung der AGA spielen AR-Polymorphismen und eine individuell erhöhte Androgensensitivität der Haarfollikel in den Prädilektionsarealen der AGA. Zirkulierende Androgenspiegel sind praktisch immer im Normbereich, eine hormonelle Abklärung ist daher lediglich bei Frauen mit klinischem Hinweis auf eine Hyperandrogenämie (Hirsutismus, Virilisierung, Alopezie vom Male-Pattern-Typ, Zyklusunregelmäßigkeiten, metabolisches Syndrom) angezeigt.
Die klinische Diagnose der AGA ist in der Regel sehr einfach zu stellen. Bisweilen kann es schwierig sein, eine beginnende AGA vom weiblichen Typ gegen ein symptomatisches oder chronisches Telogeneffluvium oder eine Alopecia areata diffusa abzugrenzen. Charakteristisch für eine AGA ist das Vorliegen von > 20 % Intermediär- und Vellushaaren (Anisotrichose) bei der trichoskopischen Untersuchung. Auch ein lediglich mit dem Auflichtmikroskop erkennbarer brauner Hof um die Haarfollikel als Ausdruck einer perifollikulären Entzündung („peripilar sign“) gilt als Hinweis für eine AGA.
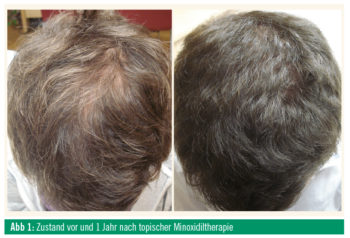
Zur Therapie der AGA stehen zwei etablierte Substanzen zur Verfügung: Minoxidil (2 %, 5 %) als topische Zubereitung (Lösung, Schaum) und Finasterid 1 mg zur peroralen Therapie. Minoxidil wurde 1988 von der FDA zur äußerlichen Behandlung der AGA bei Männern und drei Jahre später auch zur Behandlung der AGA bei Frauen zugelassen. Die Wirkung von Minoxidil auf die Haarfollikel ist noch immer nicht zur Gänze geklärt. Es wirkt als Kaliumkanalöffner und erhöht unter anderem die Synthese bzw. Aktivierung von Wachstumsfaktoren in der dermalen Papille. Neuere Befunde deuten darauf hin, dass Minoxidil auch mit dem AR interagiert und dessen Wirkung blockiert. Bei regelmäßiger täglicher Anwendung stoppt Minoxidil den Haarausfall bei 80– 90 % der Patienten, eine moderate bis deutliche Zunahme der Haardichte wird bei bis zu 50 % der Behandelten beobachtet (Abb. 1 und 2). Lokale Nebenwirkungen treten bei der äußerlichen Anwendung selten auf und sind zumeist irritativer Natur (Rötung, Schuppenbildung). In vielen Fällen ist dies auf das in den Minoxidilzubereitungen enthaltene Propylenglykol zurückzuführen und kann durch eine propylenglykolfreie Rezeptur vermieden werden. Minoxidil ist eine Dauertherapie und muss permanent durchgeführt werden, da anderenfalls der erzielte Effekt auf die Haardichte verloren geht. Zu einer Erhaltungstherapie mit verringerter Anwendungsfrequenz liegen keine Daten vor.
Finasterid ist ein 5α-Reduktase-Typ-II-Inhibitor, der die Umwandlung von Testosteron in DHT blockiert. Es ist in der Dosierung von 1 mg tgl. zur Behandlung der AGA bei Männern von 18 bis 41 Jahren zugelassen und vergleichbar wirksam wie Minoxidil. Es ist eine einfach durchzuführende Therapie, die wie Minoxidil permanent durchgeführt werden muss. Nebenwirkungen sind selten und umfassen Libidoverlust, Potenzstörungen und Depression, die bei 1–2 % der Männer auftreten können und in der Regel mit Absetzen des Präparates reversibel sind. Es sind jedoch auch Fälle beschrieben, bei denen es zu dauerhaften sexuellen, körperlichen und kognitiven Beeinträchtigungen gekommen ist, die unter dem Begriff Post-Finasterid-Syndrom zusammengefasst werden und mittlerweile auch zu Klagen geführt haben. Die tatsächliche Größenordnung dieses Syndroms wird derzeit sehr kontrovers diskutiert.
Finasterid ist bei gebärfähigen Frauen kontraindiziert, da es bei männlichen Feten zu einer Fehlbildung der Geschlechtsorgane führen kann. In der bei Männern üblichen Dosierung von 1 mg tgl. erwies sich Finasterid bei postmenopausalen Frauen mit AGA als unwirksam. Allerdings gibt es eine zunehmende Anzahl von Fallserien und retrospektiven Studien, die belegen, dass Finasterid in einer höheren Dosierung von 2,5 oder 5 mg tgl. eine wirksame Therapieoption für prä- oder postmenopausalen Frauen mit „female pattern hair loss“ darstellen kann.
Auch für die Low-Level-Laser-Therapie (LLLT) und die intraläsionale Behandlung mit autologem plättchenangereichertem Plasma („platelet rich plasma“, PRP) gibt es Hinweise auf eine haarwuchsfördernde Wirkung. Die Datenlage dazu ist jedoch immer noch unzureichend. Die Wirksamkeit von topisch angewandtem 17α-Östradiol, Cyproteronacetat oder Finasterid ist nicht oder nicht ausreichend belegt.
Symptomatisches Effluvium
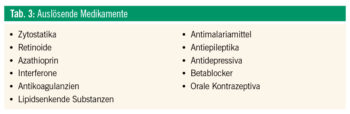
In Tabelle 2 sind mögliche Ursachen eines symptomatischen Effluviums angeführt. Zumeist handelt es sich um ein Telogeneffluvium; ein Anageneffluvium entsteht ausschließlich nach massiver toxischer Einwirkung auf die Haarwurzelzellen (z. B. nach einer Strahlen- oder Chemotherapie). Zielführender als jede undifferenzierte Laboruntersuchung sind bei diesem in der Regel passagerem Haarverlust die Erhebung einer detaillierten Anamnese und eine genaue klinisch-dermatologische Untersuchung. Tabelle 3 listet mögliche medikamentöse Auslöser eines Effluviums auf, wobei zu berücksichtigen ist, dass diese Medikamente nur fakultativ in Kombination mit individuellen prädisponierenden Faktoren zu einem Haarverlust führen. In allen Fällen kommt es nach Identifikation und Wegfall des auslösenden Agens zu einer Normalisierung des Haarwachstums.
Alopecia areata (AA)
Alopecia areata ist mit einer Prävalenz von 0,1–0,2 % und einer Lebenszeitinzidenz von ca. 1,7 % eine relativ häufige autoimmunologische Erkrankung der Kopfhaut, deren histopathologisches Korrelat in einem entzündlichen peribulbären T-Zell- Infiltrat besteht, das zu einer (zum Unterschied vom Lichen planopilaris) in der Regel komplett reversiblen Alopezie führt. AA ist eine Erkrankung des jüngeren Lebensalters: Die Erstmanifestation ist bei 60 % der Patienten vor dem 20. Lebensjahr, der Erkrankungsgipfel liegt im 2.–3. Lebensjahrzehnt. Beide Geschlechter sind gleichermaßen betroffen. Die Familienanamnese ist bei 10–42 % der Patienten positiv. AA geht gehäuft mit anderen Autoimmunerkrankungen einher, wobei die stärkste Assoziation mit der Autoimmunthyreoiditis besteht. In unterschiedlichen Studien wurden je nach AA-Typ bei bis zu 30 % der Patienten Schilddrüsenautoantikörper nachgewiesen, weshalb ein diesbezügliches Screening bei jedem AA-Patienten angezeigt ist.
Die klinische Präsentation der AA ist äußerst vielfältig und reicht von einem bis wenigen umschriebenen Herden bis hin zur AA totalis (AT; Fehlen sämtlicher Kopfhaare) oder AA universalis (AU; Fehler aller Körperhaare). Bei bis zu 80 % der Patienten mit limitierten Befall kommt es innerhalb eines Jahres zu einer Spontanremission, was bei einer allfälligen Therapieplanung berücksichtigt werden muss. Andererseits schreitet bei 14–25 % der Patienten die Erkrankung zu einer AT oder AU fort, die schwierig zu therapieren sind. Prognostisch ungünstige Faktoren sind ein ausgedehnter Befall zum Zeitpunkt der Erstmanifestation, Beginn in der Kindheit, der Ophiasis-Typ der AA (schlangenförmiger Verlust der Haare im zumeist temporalen oder occipitalen Haaransatzbereich) sowie das Vorliegen einer assoziierten Autoimmunthyreoiditis.
Therapie: Aufgrund der großen kosmetischen Bedeutung von Haaren in unserer Gesellschaft sind der durch AA verursachte Leidensdruck und die Beeinträchtigung der Lebensqualität, insbesondere bei Frauen und ausgedehntem Befall, oft enorm. Dies muss bei der Therapieplanung berücksichtigt werden. Bei limitiertem Befall und geringer bis fehlender Krankheitsaktivität sind intraläsionale oder hochpotente topische Kortikosteroide die Therapie der ersten Wahl. In einer 2015 von Chu et al. veröffentlichten intraindividuellen Vergleichsstudie wurde gezeigt, dass bei der intraläsionalen Applikation von Triamcinolon eine geringe Konzentration von 2,5 mg/ml ebenso wirksam war wie höhere Konzentrationen von 5 oder 10 mg/ml, was die Behandlung größerer alopezischer Areale bei geringerem Risiko einer steroidinduzierten Hautatrophie ermöglicht.
Alternative topische Behandlungsmöglichkeiten sind Dithranol und Minoxidil, die Datenlage dazu ist aber weniger überzeugend. Bei ausgeprägtem Befall und hoher Krankheitsaktivität kommen therapeutisch eine topische Immuntherapie mit Diphencypron, systemische Kortikosteroide und/ oder Methotrexat in Betracht. Die Verabreichung von Kortikosteroiden kann täglich, zweimal wöchentlich oder als Kurzinfusion von bis zu 500 mg Methylprednisolon tgl. an drei aufeinanderfolgenden Tagen alle 4 Wochen (Hochdosis-Puls-Steroid-Therapie) verabreicht werden. Gute Erfolge werden in erster Linie bei der multifokalen AA erzielt, während die Ergebnisse bei Ophiasis und AT/AU zumeist unbefriedigend sind. Vergleichsstudien zur Effektivität und Sicherheit der unterschiedlichen Administrationsschemata fehlen. Methotrexat (bis 25 mg einmal pro Woche) allein oder initial in Kombination mit mittelhochdosiertem Kortikosteroid wurde in mehreren kleineren Studien an Erwachsenen und Kindern eingesetzt und zeigte nicht nur bei multifokaler, sondern teilweise auch bei AT/AU gute Ergebnisse. Es kann bis zu 6 Monate dauern, bis sich ein Therapieerfolg einstellt, und die Therapie muss langzeitig (bis zu zwei Jahre nach B des Haarwiederwachstums) durchgeführt werden. Ein neuer sehr vielversprechender Therapieansatz sind die Janus-Kinase-Inhibitoren (JAKi; Ruxolitinib, Tofacitinib, Baricitinib), die bei oraler oder topischer Anwendung sowohl im Tiermodell als auch bei Patienten eine deutliche Rückbildung oder Abheilung der AA induzieren konnten. Derzeit läuft eine Reihe von Studien zur systematischen Evaluierung der Wirksamkeit von JAKi bei AA.
Vernarbende Alopezien
Vernarbende Alopezien sind für 3–7 % aller Konsultationen in großen Haarambulanzen verantwortlich und somit relativ selten. Die gängigste Einteilung der vernarbenden Alopezien richtet sich nach dem im entzündlichen Infiltrat vorherrschenden Zelltyp (Tab. 4). Angaben zur relativen Häufigkeit der einzelnen Krankheitsbilder schwanken je nach Zentrum und Zeitpunkt der Erhebung.
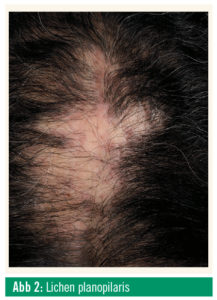
Am häufigsten ist der Lichen planopilaris, der sich anfangs als kleinfleckige, multifokale Alopezie präsentiert, die unbehandelt über Jahre voranschreiten und zu ausgedehntem irreversiblem Haarverlust führen kann. Trichoskopisch findet man typischerweise ein lividfarbenes perifollikuläres Erythem und eine follikuläre Schuppenkrause. Subjektiv besteht oft Juckreiz. Die Krankheitsaktivität kann von Patient zu Patient stark schwanken, im Extremfall kann es innerhalb von wenigen Monaten zu einer subtotalen Alopezie kommen. Da weder die Krankheitsdauer noch die Krankheitsaktivität prognostizierbar sind, sollte zum frühestmöglichen Zeitpunkt eine Systemtherapie eingeleitet werden, um das Voranschreiten der Erkrankung zu stoppen. Die systemische Standardtherapie des Lichen planopilaris sind Antimalariamittel (Hydroxychloroquin, Chloroquin), alternativ kann Mycophenolat-Mofetil (MMF) eingesetzt werden. Eine klinisch unverkennbare Variante des Lichen planopilaris ist die frontal fibrosierende Alopezie (FFA), bei der es insbesondere bei postmenopausalen Frauen zu einem bandförmigen Zurückweichen des frontotemporalen Haaransatzes kommt, zumeist in Kombination mit einem (gleichzeitigen oder vorausgehenden) Verlust der Brauen. Die Inzidenz der FFA ist im letzten Jahrzehnt aus bisher unbekannten Gründen sprunghaft angestiegen. Die Therapie ist ident mit der des Lichen planopilaris, zusätzlich existieren Berichte über den erfolgreichen Einsatz von Finasterid bei FFA.
Ein Kopfhautbefall im Rahmen eines chronisch kutanen Lupus erythematodes ist bei Vorliegen von weiteren kutanen Läsionen (z. B. im Gesicht) unschwer zu diagnostizieren, bei isoliertem Auftreten an der Kopfhaut kann die Abgrenzung gegen andere vernarbende Alopezien schwierig sein und eine Hautbiopsie erforderlich machen. Charakteristische trichoskopische Merkmale sind sogenannte „yellow dots“ (von Hornpfropfen gefüllte dilatierte Follikelostien) und arborisierende Gefäße. Bei isolierten Herden kommt eine Lokaltherapie mit Kortikosteroiden oder Calcineurininhibitoren infrage, bei Nichtansprechen oder ausgedehntem Befall eine Systemtherapie mit Antimalariamitteln, MMF, Methotrexat oder Retinoiden.
Die Follikulitis decalvans (FD) befällt bevorzugt Männer ab dem 20. Lebensjahr und ist gekennzeichnet durch umschriebene, sich allmählich zentrifugal ausdehnende Hautareale mit follikulärer Pustulation im Parietooccipitalbereich. Bei längerem Bestand kommt es zur Ausbildung von sogenannten Büschelhaaren (mehrere Haarschäfte treten büschelartig aus einem Follikelostium aus), welche aber nicht pathognomonisch für die FD sind. Die Pathogenese der FD ist immer noch nicht aufgeklärt, neuere Untersuchungen deuten auf eine mögliche kausale Rolle von bakteriellen Biofilmen im Infrainfundibulum. Die Therapie der FD gestaltet sich oft äußerst schwierig. Behandlungsmaßnahmen umfassen neben der Verabreichung von Antibiotika, Isotretinoin oder Dapson die Epilation betroffener Haare.
Die Folliculitis und Perifolliculitis capitisabscedens et suffodiens kann isoliert oder als Teil der Aknetetrade auftreten. Es ist eine seltene Erkrankung, die vorwiegend bei afrikanischen Männern im Alter von 18 bis 40 Jahren auftritt und sich in Form von entzündlich-abszedierenden Knoten im Vertex- und Occipitalbereich manifestiert. Der Verlauf ist protrahiert und resultiert in kleinfleckige Vernarbungen der Kopfhaut. Die Therapie ist ähnlich wie bei der FD und besteht in erster Linie aus der langzeitigen Verabreichung von Isotretinoin oder Dapson.
Weiters sehr selten und häufig fehldiagnostiziert ist die erosive pustulöse Dermatose (EPD). Die EPD tritt vorwiegend, aber nicht ausschließlich auf der Kopfhaut älterer Menschen nach vorausgegangenen lokalen Traumata (z. B. chronischer UV-Schaden bei kahlköpfigen Männern) auf. Klinisch findet man erosive Hautareale, die stellenweise von leicht abwischbaren gelblich-bräunlichen Krustenauflagerungen bedeckt sind. Die EPD wird nicht selten mit impetiginisierten aktinischen Keratosen verwechselt und heilt üblicherweise rasch unter einer topischen Steroidtherapie ab.