Neue Daten zur Epidemiologie und Resistenzlage: Sexuell übertragbare Infektionen
Die Weltgesundheitsorganisation (WHO) schätzt, dass sich täglich weltweit mehr als eine Million Menschen eine der vier behandelbaren, sexuell übertragbaren Infektionen (STI) – nämlich Syphilis, Gonorrhö, Chlamydien- und Trichomonaden-Infektion – zuziehen.1 Dies führt zu jährlich mehr als 350 Millionen neuen Fällen, vornehmlich in den ärmeren oder unterentwickelten Ländern der Erde. STI gelten als eine der fünf häufigsten Erkrankungen weltweit, die dazu führen, dass Erwachsene medizinische Hilfe aufsuchen.2
Syphilis
Die Syphilis nimmt in den westeuropäischen Staaten weiter zu. Obwohl es mit der Einführung des Penicillins 1943 zu einer drastischen Abnahme der Syphilis weltweit gekommen ist, kann nicht davon ausgegangen werden, dass sie heute nicht mehr existent ist. Die WHO schätzt, dass zwar global ein Rückgang zu verzeichnen ist, es allerdings weltweit jährlich zu 6 Millionen Neuinfektionen kommt, davon mehr als 90 % in den Entwicklungsländern. Der Übertragung von der Mutter auf das Kind kommt in diesen Ländern deshalb eine große Bedeutung zu: Laut WHO-Daten vom Jänner 2019 waren 2016 eine halbe Million Fälle konnataler Syphilis-Infektionen zu verzeichnen, die in über 200.000 Fällen zum intrauterinen Fruchttod oder Tod des Neugeborenen geführt haben.3
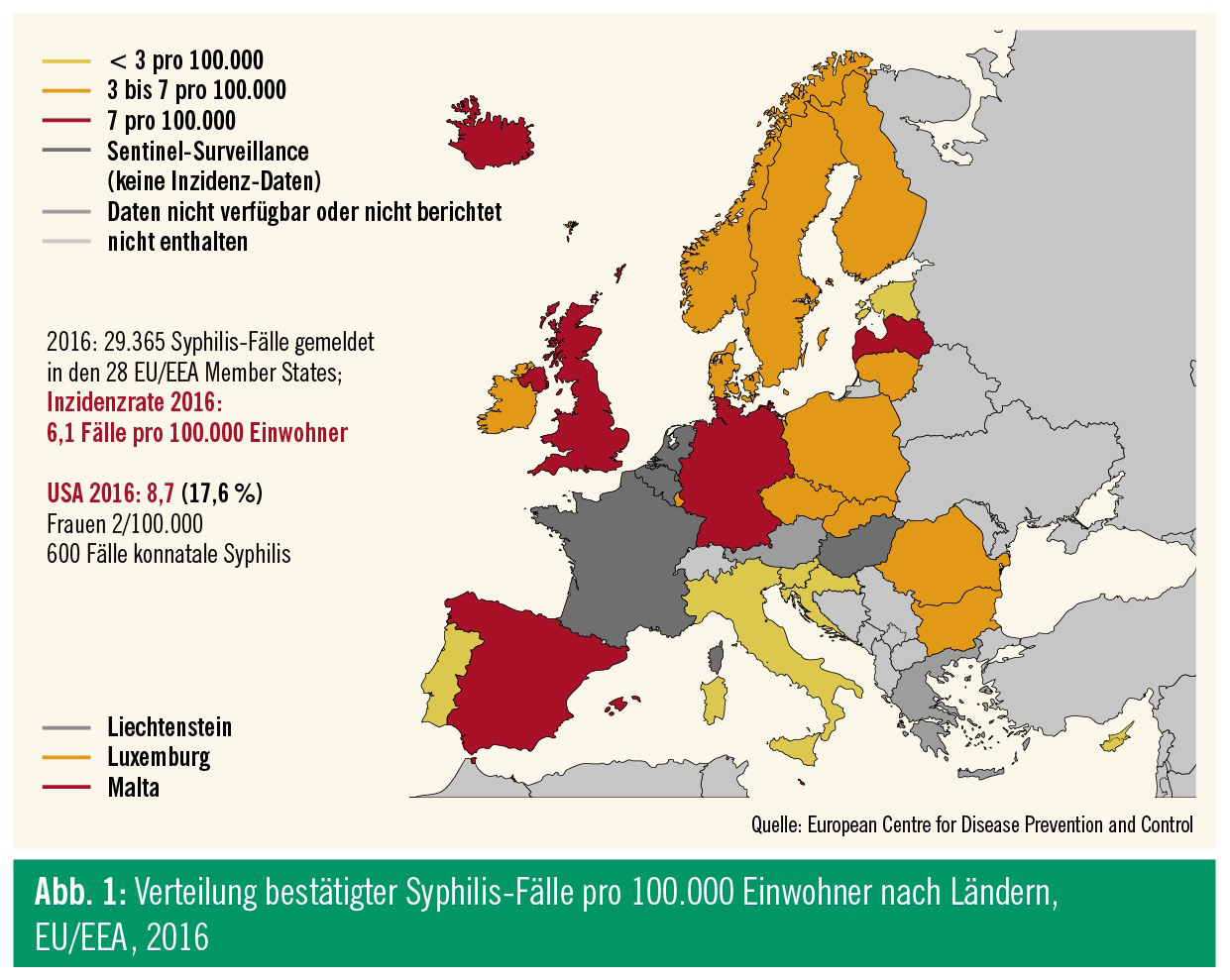
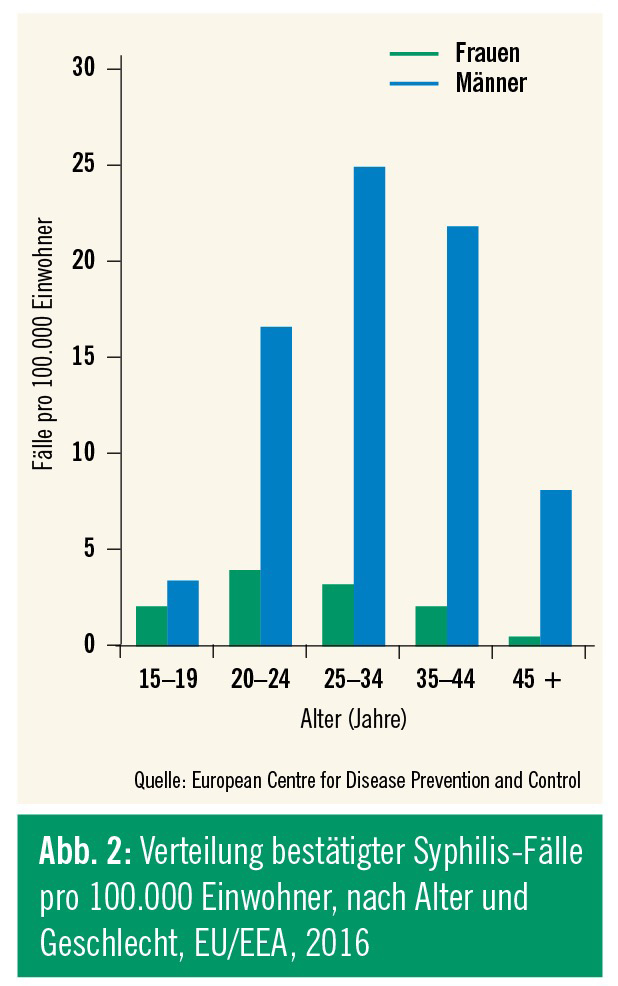
In den westeuropäischen Staaten stieg die Inzidenz ab dem Jahr 2000 deutlich an, fiel dann zwischen 2005 und 2009 wieder leicht ab. Seit 2010 ist der Trend in allen westeuropäischen Staaten – auch in Österreich – wieder steigend. Laut Meldung des Europäischen CDC (European Center for Disease Prevention and Control, ECDC) vom Juli 2018 beträgt die Inzidenzrate in den 28 EU-Ländern oder Mitgliedstaaten der European Economic Area (EEA) 6,1 (Report 2016: 5,1) pro 100.000 Einwohner, mit achtmal (Report 2016: sechsmal) höheren Infektionsraten bei Männern als bei Frauen (Abb. 1 und 2). Betroffen sind in erster Linie Männer, die Sex mit Männern haben (MSM) – 80 % aller frischen Infektionen sind hier zuzuordnen; mehr als 30 % dieser MSM sind bereits HIV-positiv. Die ECDC meldete außerdem wieder Fälle von konnataler Syphilis, womit auch steigende Zahlen von infektiöser Syphilis im heterosexuellen Bereich reflektiert werden.4
Für Österreich gibt es für die letzten Jahre keine publizierten Daten, Rückschlüsse auf die Situation hierzulande können aber durch die für Deutschland berichteten Zahlen des Berliner Robert Koch-Instituts gezogen werden. Wie bereits in den Vorjahren stieg in Deutschland auch 2017 die Zahl der erfassten Syphilis-Neuinfektionen nahezu unvermindert an, sie lag 2016 um 7 % und 2017 um 4,2 % höher als in den jeweiligen Vorjahren. Für Deutschland errechnet sich somit die seit dem Jahr 2000 bisher höchste Inzidenz von 9,1 auf 100.000 Einwohner. Mit mehr als 7.400 Neuinfektionen ist in etwa das Niveau der 1970er-Jahre erreicht.5
Für die Behandlung der Syphilis ist die intramuskuläre Applikation von 2,4 Millionen Einheiten Benzathin-Penicillin Mittel der ersten Wahl, stadiengerecht entweder ein- oder dreimal in wöchentlichem Abstand verabreicht. Eine Neurosyphilis muss intravenös mit Penicillin therapiert werden, da das Benzathin-Penicillin nicht ausreichend liquorgängig ist. Bis heute sind keine Resistenzen auf Penicillin bekannt. Alternativen bei einer Penicillinallergie sind Ceftriaxon und Doxycyclin.6, 7
Trichomonaden-Infektion
Infektionen mit Trichomonas vaginalis zählen mit mehr als 250 Millionen Infizierten pro Jahr zu den STI mit den weltweit höchsten Prävalenzen, vor allem in tropischen Ländern, wo die Prävalenz z. B. bei Frauen, je nach untersuchter Population, mit 3–48 % angegeben wird. In unseren Breiten ist die Prävalenz gering, allerdings gibt es keine Zahlen, da die Infektion nicht meldepflichtig ist. Die Trichomoniasis kann durch den Nachweis der Protozoen aus dem Vaginalsekret oder Urin oder mittels Kultur bzw. Amplifizierungsverfahren diagnostiziert werden. Die Therapie erfolgt oral mit Metronidazol in einer Einzeldosis von 2 g; der Partner muss immer auch getestet und behandelt sowie der Therapieerfolg kontrolliert werden.6, 7
Genitaler Herpes
Die genitale Herpes-Infektion ist die häufigste Ursache genitaler Ulzera infektiöser Genese. Weltweit kommt es schätzungsweise zu 23 Millionen Neuinfektionen pro Jahr, mehr als 400 Millionen Menschen haben laut WHO genitalen Herpes. Das Herpes-simplex-Virus-Typ-2 (HSV-2) wird fast ausschließlich sexuell übertragen, weshalb die HSV-2-Antikörper-Seroprävalenz synonym zur Angabe der Prävalenz der Herpes-genitalis-Infektion in der Bevölkerung herangezogen wird; sie liegt in westlichen Ländern bei etwa 20 %, bei HIV-Infizierten und Sexarbeitern sogar bei bis zu 95 %. Daten der WHO verdeutlichen den Einfluss des genitalen Herpes auf die Transmission bzw. Akquisition von HIV in Regionen hoher Prävalenz, wie etwa Afrika. Heute sind allerdings 30–50 % aller genitalen Herpes-Erstinfektionen nicht durch HSV-2, sondern durch HSV-1 bedingt, dieser Trend ist zunehmenden orogenitalen Sexualpraktiken zuzuschreiben.8 Herpes genitalis ist auch unter Menschen mit niedriger sexueller Aktivität weitverbreitet, laut einer Studie sind 18 % der US-amerikanischen Frauen mit 2–4 Lebenszeit-Partnern HSV-2-Antikörper-positiv.9
Therapeutisch stehen verschiedene Virostatika zur Verfügung, die möglichst früh im Krankheitsverlauf gegeben werden sollen. Zu diesen gehören Famciclovir, Aciclovir oder Valaciclovir, das erst im Körper in Aciclovir umgewandelt wird. Der Vorteil von Valaciclovir ist eine höhere Bioverfügbarkeit, etwa 55 % im Vergleich zu 10 % beim Aciclovir. Bei besonders schwerem Krankheitsverlauf, wie etwa bei der Primärmanifestation, wird Aciclovir intravenös verabreicht. Bei mehr als 6 Rezidiven pro Jahr ist eine Suppressionstherapie des Herpes genitalis zu erwägen.6, 7
HPV-Infektion
Die genitale Infektion mit humanen Papillom-Viren (HPV) ist die häufigste STI. Der Nachweis von genitaler HPV-DNA ist bei jungen, sexuell aktiven heterosexuellen Männern häufig, mit einer Prävalenz von 21 %. Die meisten HPV-Infektionen verlaufen allerdings subklinisch bzw. asymptomatisch und heilen innerhalb von 12–24 Monaten ab, diese spontane Regression der Infektion erfolgt durch eine zellmediierte Immunantwort. Etwa 290 Millionen Frauen sind Carrier von HPV-DNA, das entspricht einer Prävalenz genitaler HPV-DNA von 10,4 %; bei unter 25-jährigen Frauen beträgt diese 16,9 %. Bei bis zu 70 % der männlichen Partner einer Frau, die im HPV-Screening positiv getestet wurde, besteht ebenfalls eine Infektion.
„Niedrigrisiko-HP-Viren“ führen zu Kondylomen (Feigwarzen), sogenannte „Hochrisiko-Typen“ sind für insgesamt 5 % aller Malignome beim Menschen verantwortlich, wie zum Beispiel für die Entwicklung des Zervixkarzinoms und weiterer Karzinome im Genital-/Anal- oder Mund-/Rachen-Bereich. Bei 10–20 % der zervikal mit Hochrisiko-HPV-Typen Infizierten persistiert die Infektion, aber nur in 1–2 % der Fälle führt dies zu einer Progression im Sinne einer zervikalen intraepithelialen Neoplasie (CIN) oder eines Zervixkarzinoms. Dabei spielen für das Karzinom-Risiko der Virustyp und die Viruslast eine Rolle sowie das Rauchen, hormonelle Faktoren und eine Koinfektion mit HIV.10
Die Infektion selbst kann nicht kausal therapiert werden, deshalb hat sich mit der Verfügbarkeit von HPV-Impfstoffen eine neue Dimension aufgetan. Die in dem seit 2016 verfügbaren 9-fach-HPV-Impfstoff enthaltenen HPV Typen (6/11/16/18/31/33/45/52/58) sind für 90 % der Zervixkarzinome, 82 % der anogenitalen Präkanzerosen und 90 % der Genitalwarzen verantwortlich. Die Vakzine ist für Mädchen und Buben im Alter zwischen 9 und 26 Jahren zugelassen, wird bei den 9- bis 14-Jährigen in zwei Dosen im Abstand von 6 Monaten verabreicht und zeigt etwa 100 % Effizienz gegen Infektion und Erkrankung durch die inkludierten HPV-Typen bei sexuell naiven Personen. Catch-up-Vakzinierungen bis zum 26. Lebensjahr können sinnvoll sein, allerdings sollen alle Älteren (15- bis 26-Jährige) sowie immunsupprimierte Personen gemäß der CDC-Empfehlungen das ursprüngliche Dreier-Dosis-Regime (0, 2, 6 Monate) erhalten.11
Gonorrhö
Die zweithäufigste bakterielle STI ist die Gonorrhö, eine Infektion mit Neisseria gonorrhoeae. Weltweit kommt es zu über 78 Millionen neuer Erkrankungen jährlich (WHO 8/2016).12 Die in den letzten Jahrzehnten zunehmende Resistenzentwicklung der Gonokokken gegen diverse Antibiotika, bedingt durch den ungezielten Antibiotika-Einsatz, verlangt neue therapeutische Strategien.
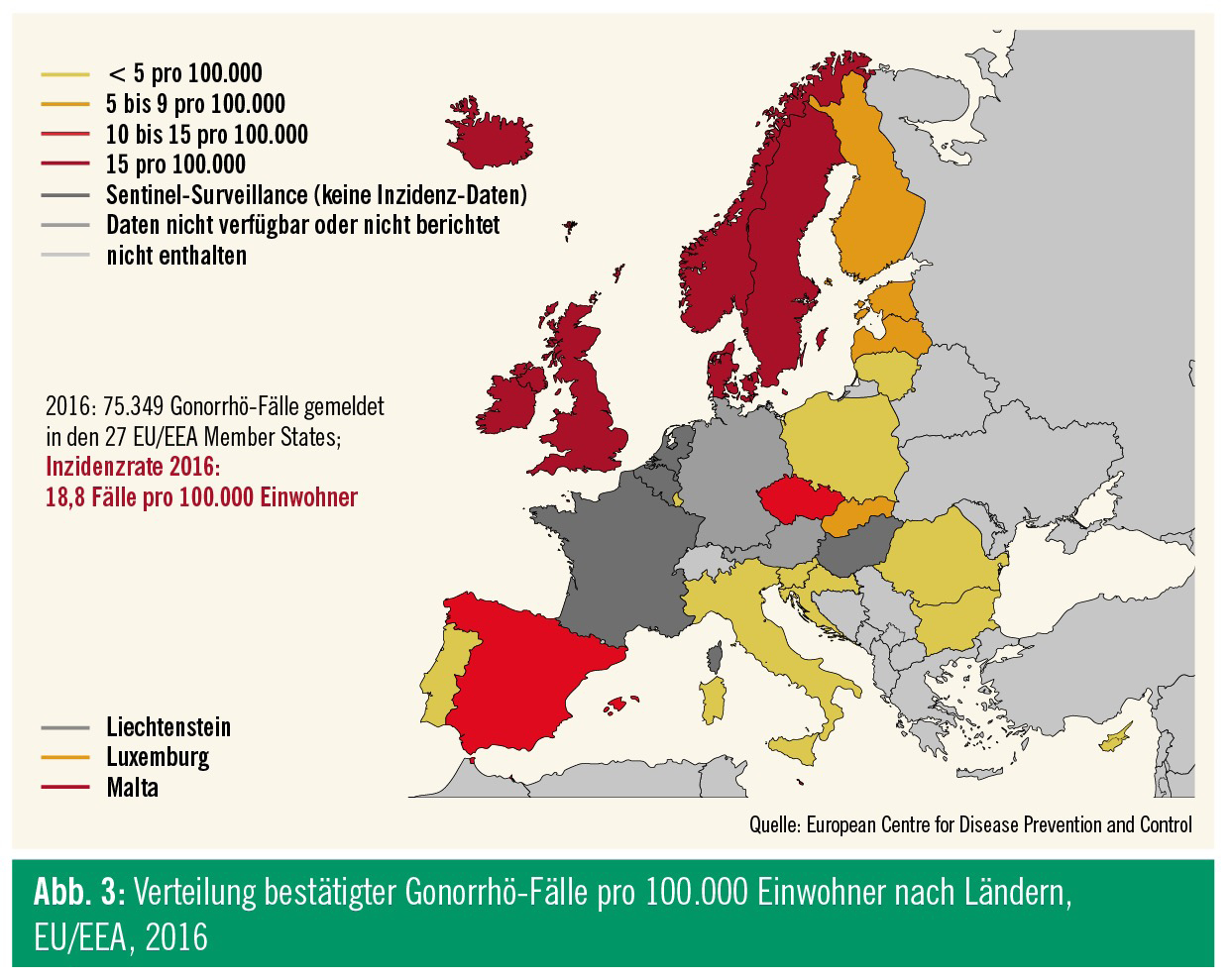
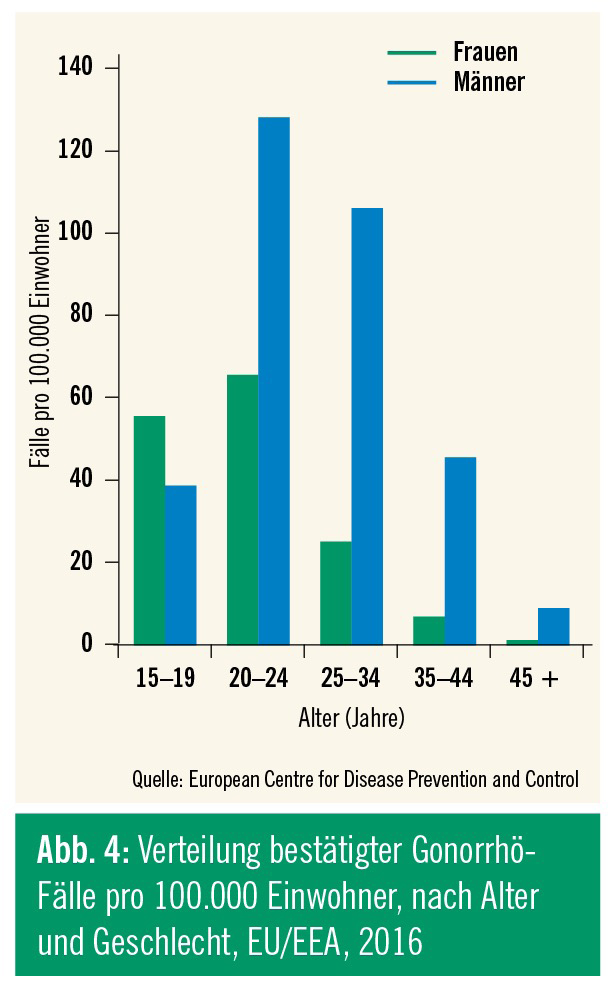
Rezenten Daten der ECDC zufolge betrug 2016 die Inzidenz der Gonorrhö in Europa 18,8 Fälle auf 100.000 Einwohner, zwar auf hohem Niveau, aber erstmals zeigte sich ein leichter Abfall verglichen zu 2015 (Abb. 3 und 4). Die Hälfte der berichteten Fälle geht auf das Konto der MSM, die restlichen auf das der heterosexuellen Männer und Frauen.13
In den letzten Jahren ist durch den unkontrollierten Einsatz von Antibiotika die Resistenzentwicklung bei Gonokokken ein globales Problem geworden. Die Prävalenz von Multi-Drug-resistenten (MDR-)Gonokokkenstämmen hat im letzten Jahrzehnt deutlich zugenommen. Als Reaktion darauf hat die WHO 2009 ein sogenanntes „Gonococcal Antimicrobial Surveillance Program“ (GASP) ins Leben gerufen, welches jährlich in Zusammenarbeit mit Referenz-Labors in 60 Ländern das Resistenzverhalten der Gonokokken-Isolate überwacht.14 High-Level-Penicillin- und -Chinolon-Resistenzen sind in 97 % der erfassten Länder verbreitet. Diese sind, ebenso wie Tetrazykline, bei der Gonorrhö als Therapie kontraindiziert.
Die im Juli 2017 von der WHO veröffentlichten GASP-Daten der Jahre 2009 bis 2014 zeigen außerdem eine zunehmende Resistenz gegen Azithromycin in 81 % der erfassten Länder. Ebenso kommt es zum Auftreten von „super bugs“. Dabei handelt es sich um einzelne Isolate, die gegen sogenannte Extended-Spectrum-Cephalosporine resistent sind. Das betrifft hauptsächlich das oral eingesetzte Cefixim, aber auch das parenteral zu verabreichende Ceftriaxon. Dieses wird derzeit als Mittel der Wahl in der Behandlung der Gonorrhö empfohlen und in den meisten Ländern als einziges noch effektiv wirksames Antibiotikum eingesetzt. Aus diesem Grund wird derzeit die duale Therapie der Gonorrhö mit einem parenteral verabreichten Cephalosporin in Kombination mit einem Azithromycin empfohlen.14 Neueste Zahlen der ECDC anhand des jährlichen Berichtes des Euro-GASP zeigen, dass sich die Resistenzproblematik von N. gonorrhoeae europaweit etwas entschärft hat; der Anteil der gegen Cefixim und Azithromycin resistenten Isolate ist leicht zurückgegangen, ebenso auch der insgesamt hohe Anteil an Ciprofloxacin-resistenten Stämmen, und es wurde kein einziger gegen Ceftriaxon resistenter Stamm gefunden.
Vor Beginn einer antibiotischen Behandlung ist immer ein direkter Erregernachweis durchzuführen. Das Anlegen einer Kultur bietet den Vorteil einer Resistenzbestimmung, allerdings kann es bei längerer Transportzeit zum Verlust von anzüchtbaren Stämmen und daher reduzierter Sensitivität kommen. Molekularbiologische Methoden (Nukleinsäureamplifikationstests, NAAT) weisen dagegen die höchste Sensitivität auf und sind auch für den Gonokokken-Nachweis aus dem Harn bzw. von Lokalisationen außerhalb des Anogenital-Bereiches geeignet.6, 7
Chlamydien-Infektion
Die häufigste bakterielle STI ist die genitookuläre Chlamydien-Infektion. Dabei handelt es sich in erster Linie um Infektionen mit den Serovaren D–K. Laut CDC-Surveillance-Report vom September 2018 erreichte die Inzidenz der Chlamydien-Infektionen in den USA 2017 mit 528 pro 100.000 Einwohner einen Höhepunkt, um fast 7 % mehr als 2016; Frauen waren im Vergleich zu Männern mehr als doppelt so häufig betroffen.15 Zwei Drittel der Infizierten sind junge Menschen im Alter von 15 bis 24 Jahren. Für Deutschland und Österreich gibt es wegen fehlender Meldepflicht keine aktuellen Zahlen zur Chlamydien-Infektion. Jährlich rechnet man allerdings in Deutschland mit etwa 300.000 Neuinfektionen. Die Infektionen treten fast ausschließlich postpubertär auf, der Altersgipfel liegt bei 15 bis 25 Jahren.16, 17
Die WHO schätzt, dass weltweit 4,2 % der Frauen und 2,7 % der Männer zwischen dem 15. und dem 49. Lebensjahr mit C. trachomatis D–K infiziert sind – in Zusammenhang mit ungeschütztem Geschlechtsverkehr und wechselnden Sexualpartnern; in den High-Income-Ländern sind in erster Linie junge Erwachsene unter 26 von einer Infektion betroffen. Bei 80 % davon, meist Frauen, verläuft die Infektion asymptomatisch. Wesentlich höhere Prävalenzen finden sich allerdings in bestimmten Entwicklungsländern; so testeten zum Beispiel 20 % der 15- bis 24-jährigen schwangeren Frauen im Südpazifik im Rahmen ihrer pränatalen Diagnostik positiv auf C. trachomatis. In Südafrika findet man ebenso hohe Zahlen.2
Beim Mann ist die sogenannte nichtgonorrhoische Urethritis (NGU) in 30 % der Fälle auf Chlamydien zurückzuführen. Der Beweis der Infektion erfolgt immer über den direkten Erregernachweis. Methode der Wahl für die Diagnostik sind NAAT, sie haben die höchste Sensitivität und eine hohe Spezifität. Der serologische Nachweis von Antikörpern ist für die Diagnostik von Chlamydien-Infektionen ungeeignet.
Entsprechend den Richtlinien erfolgt die Therapie unkomplizierter Chlamydien-Infektionen mit Doxycyclin (100 mg 2-mal täglich über 7 Tage) oder als Therapie der zweiten Wahl mit Azithromycin (1 g als Einmaldosis), alternativ auch mit Minocyclin, Josamycin oder Ofloxacin.6, 7, 17 Ein Therapieversagen ist meist auf eine Reinfektion zurückzuführen.
Mycoplasma-Infektion
Als Erreger der nichtgonorrhoischen Nicht-Chlamydien-Urethritis (NGNCU) des Mannes ist heute Mycoplasma genitalium – erst 1980 mittels Elektronenmikroskop entdeckt – in den Fokus gerückt. Die Rolle von M. genitalium bei der Frau ist nicht so klar. Es sind Assoziationen mit einer Urethritis (Odds Ratio 1,66), einer Zervizitis, Endometritis beziehungsweise Pelvic Inflammatory Disease (Odds Ratio 2,14) und auch mit einer vermehrten Frühgeburtlichkeit beziehungsweise Abort beschrieben. In Studien konnte bei 40 % aller getesteten Frauen M. genitalium vaginal isoliert werden. Da aber 40–75 % dieser Frauen asymptomatisch waren, ist bei Frauen die Rolle von M. genitalium als Pathogen zu hinterfragen.
Die Prävalenzdaten für M. genitalium liegen mit 1,9–6,6 % in vielen Ländern über jenen für Chlamydien. In einer schwedischen Studie fand sich sogar bei 16,8 % der getesteten Proben eine Infektion.18 Angesichts dieser Zahlen ist es gerechtfertigt, im Rahmen eines STI-Screenings auch gezielt nach einer Infektion mit M. genitalium zu suchen, am besten gleich kombiniert mit einer genotypischen Resistenztestung. Erst seit kurzem gibt es kommerziell erhältliche, auf NAAT beruhende Tests.
Nur 30 % der Männer mit einer M.-genitalium-assoziierten Urethritis sprechen auf das für die NGU empfohlene 7-Tage-Regime mit Doxycyclin an; dieses ist deshalb bei bekanntem Erreger nicht indiziert. Als Zweitlinie der NGU wird heute Azithromycin, 1 g oder 1,5 g (Azithromycin 1,5 g [Tag 1: 500 mg; Tage 2–5: je 250 mg]), empfohlen; damit wäre M. genitalium erfasst, allerdings zeichnet sich mit der ungezielten Gabe von Azithromycin in den letzten Jahren eine zunehmende Entwicklung von Makrolidresistenzen ab; mittlerweile sind in manchen Settings bereits 50 % der M.-genitalium-Isolate resistent gegen Azithromycin. Experten warnen bereits vor einem neuen „superbug“.19 Die Alternative besteht in Moxifloxacin 400 mg 1-mal tgl. über 10 Tage.
Resümee
Zusammenfassend kann aufgrund der steigenden Inzidenzen von STI und wegen des zunehmenden Resistenzverhaltens bestimmter Erreger nur dringend angeraten werden, dass sowohl Diagnostik als auch Therapie auf evidenzbasierten Grundlagen beruhen. Insbesondere auch, um aufsteigende Infektionen, gesundheitliche Spätfolgen und weitere Transmission zu verhin
dern. Dazu gehört auch die gezielte Untersuchung und Mitbehandlung des u. U. asymptomatischen Partners des STI-Patienten. Zudem sollte bei jedem symptomatischen Patienten aufgrund möglicher Koinfektionen das gesamte Panel der STI getestet werden.