Bronchialkarzinom – neue Strategien, neue Targets Bronchialkarzinom
Metastasiertes nicht-kleinzelliges Bronchialkarzinom, NSCLC
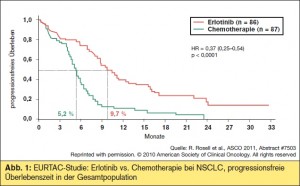
EURTAC-Studie1: Rafael Rosell hat die ersten Ergebnisse der EURTAC-Studie (> Abb. 1) präsentiert, die Erlotinib versus Chemotherapie bei Patienten mit fortgeschrittenem NSCLC und aktivierender ERGR-Mutation in der First- Line-Therapie untersuchte. Es ist die erste prospektive Studie in dieser Patientenpopulation ausschließlich mit Kaukasiern; 173 Patienten wurden eingeschlossen. Als Chemotherapiearm waren Cis- oder Carboplatin mit Docetaxel oder Gemcitabin in Standarddosierungen erlaubt, als primärer Endpunkt wurde das progressionsfreie Überleben herangezogen. Eine EGFR-Mutation musste sowohl mit DNA-Sequenzierung als auch mit PCR nachweisbar sein. Der primäre Endpunkt (PFS) wurde erreicht, und zwar mit einer HR von 0,37 und einem p-Wert von < 0,0001 (9,7 Monate versus 5,2 Monate); die Progression wurde von unabhängigen Radiologen zentral bestätigt. Die Remissionsrate lag bei 58 %, die Rate der Krankheitskontrolle bei 79 % (Chemotherapie: 15 % und 66 %). Die aktualisierte Gesamtüberlebenszeit wurde erst am WCLC in Amsterdam präsentiert, in der Interimsanalyse war sie (HR aktuell Juli 2011 = 1,01) in beiden Armen gleich, was auf die hohe Rate an Second-Line-Therapien mit Erlotinib im Chemotherapiearm zurückgeführt wurde. Wie zu erwarten war die Toxizität abgesehen von Rash und Diarrhoe bei Erlotinib deutlich geringer. Wie schon in der japanischen IPASS-Studie mit Gefitinib und der amerikanischen CALGB-30406-Studie mit Erlotinib wurde damit bestätigt, dass die Gabe eines TKI in der First-Line-Therapie des NSCLC mit aktivierender EGFR-Mutation als Standard anzusehen ist, unabhängig von der Ethnizität.
INNOVATIONS2 ist eine randomisierte Phase- II-Studie mit Erlotinib+Bevacizumab versus Cisplatin+Gemcitabin+Bevacizumab in der First-Line-Therapie des fortgeschrittenen NSCLC mit nicht plattenepithelhältiger His – tologie. Der primäre Endpunkt war das progressionsfreie Überleben. Die demografischen Daten der beiden Studienarme waren vergleichbar (mit einer etwas höheren Rate an Dosisreduktionen im Chemotherapiearm). Trotz guter Rationale für die EGFR-TKI+VEGFKombinationstherapie ist die Studie allerdings negativ ausgegangen, mit deutlich schlechteren Ergebnissen für den experimentellen Arm: medianes PFS 7,7 vs. 3,5 Monate, HR 1,77 (p < 0,0001). Das progressionsfreie Überleben nach einem Jahr betrug 23 % vs. 15 %. Negativ für den experimentellen Arm waren auch die sekundären Endpunkte (wenn auch nicht signifikant): medianes Überleben 16,3 vs. 12,6 Monate, 1-Jahres-Überlebensrate 60 % vs. 54 % (HR 1,39 [p = 0,0697]); Remissionsrate 37 % vs. 13 % und Krankheitskontrollrate 71 % vs. 56 %. Die primär geplante Analyse der EGFR-Mutationen zeigte eine weitgehend gleichmäßige Verteilung, mit einem etwas höheren Anteil an Mutationen im Arm mit Erlotinib. Eine Untersuchung nur dieser Patienten ergab keinen Unterschied hinsichtlich des PFS, aber ein besseres Gesamtüberleben für Patienten mit EGFRMutation (17 vs. 10 Monate medianes Überleben, HR 0,41 und p = 0,572) – allerdings bei schon sehr kleinen Patientenzahlen. Der Anteil an Second-Line-Therapien war in beiden Armen gleich, aber insgesamt haben nur 54 % der Patienten im experimentellen Arm irgendeine Chemotherapie erhalten. Es wurde gefolgert, dass der hypothetische Wirksynergismus eines EGFR-TKI mit einer Anti- VEGF-Strategie durch diese Studie nicht belegt werden kann, weshalb diese Kombinationstherapie bei unselektionierten Patienten auch nicht empfohlen werden kann.
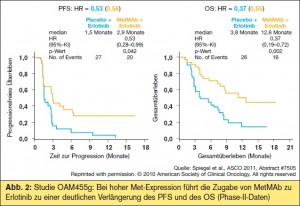
Studie OAM4558g3: Es wurden vorläufige Daten der randomisierten Phase-II-Studie OAM4558g vorgestellt, in der ein monoklonaler Antikörper gegen den Met-Rezeptor (MetMAb) in Kombination mit Erlotinib gegen Erlotinib alleine bei fortgeschrittenem NSCLC in der 2. und 3. Therapielinie geprüft wurde. Bei Patienten mit positiver Immunhistochemie (ICH) für Met konnte durch die Zugabe von MetMAb eine Halbierung des Progressionsrisikos und eine Verdreifachung der medianen Überlebenszeit erreicht werden (> Abb. 2). Dieser positive Effekt innerhalb dieser Patientengruppe war unabhängig von anderen Parametern wie EGFR-Mutation oder FISHPositivität für Met. In der Placebogruppe konnte nachgewiesen werden, dass die Met- Expression mit einer schlechteren Prognose vergesellschaftet ist. Diskutiert wurde die Tatsache, dass die Verteilung des EGFRStatus in dieser Studie nicht bekannt war und dass eine Phase-III-Studie in diesem Setting eventuell auch eine Chemotherapie enthalten sollte.
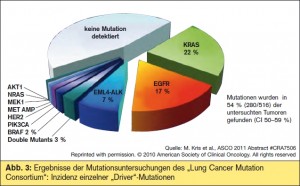
Das amerikanische „Lung Cancer Mutation Consortium“ (LCMC)4 präsentierte eine Untersuchung zur Identifikation von „driver mutations“ bei 1000 Patienten mit einem Adenokarzinom der Lunge (> Abb. 3). Bis Mai 2011 waren 1064 Patienten mit einer ausreichend großen Tumorprobe für die Mutationsanalysen registriert. Dabei konnte festgestellt werden, dass in mehr als der Hälfte der Adenokarzinome „driver mutations“ unterschiedlichster Art nachweisbar waren, zu ca. 45 % bestehend aus KRAS-, EGFR- und EML4-ALK-Mutationen. Dies erklärt die Heterogenität der Adenokarzinome, die unterschiedlichen klinischen Verläufe und die Notwendigkeit zur Selektion für bestimmte zielgerichtete Therapien. Mit dieser erworbenen Logistik konnten Patienten rasch für eine First-Line-Therapie mit Erlotinib selektioniert werden, es können aber auch rasch neue Mutationen in die Untersuchungen aufgenommen werden.
ALK, anaplastic lymphoma kinase, CD246: Der Einfluss von Crizotinib5 auf das Überleben von Patienten mit fortgeschrittenem ALK-positivem NSCLC wurde mit historischen Kontrollen verglichen, d.h. mit Patienten, die ALK-positiv waren, für die der ALK-Inhibitor Crizotinib aber noch nicht verfügbar war. Es wurden Patienten gescreent, bei welchen der ALK-Status mittels FISH ermittelt worden war. Davon wurden 82 Patienten mit dem ALK-Inhibitor behandelt – bei diesen Patienten war die mediane Überlebenszeit nach 2,5 Jahren nicht erreicht, die 1- und 2-JahresÜberlebensraten betrugen 74 % und 54 %. Im Vergleich zu den historischen Kontrollen mit ALK-positiven Patienten ohne Crizotinib sind diese Ergebnisse signifikant besser, auch die Wildtyp-EGFR- und -ALK-Patienten (ohne Mutation der entsprechenden Kinasen) schneiden deutlich schlechter ab. Insgesamt ist der Nachweis der EML4-ALK-Translokation zusätzlich ein negativer Prognoseparameter, wobei diese Mutation vor allem bei jüngeren männlichen Patienten mit Adenokarzinom nachweisbar ist.
Studie JCOG0803/WJOG4307L6: In dieser japanischen Studie wurde die Verabreichung von Docetaxel+Cisplatin wöchentlich bei älte ren Patienten (> 70a) mit fortgeschrittenem NSCLC mit der 3-wöchentlichen Docetaxel- Monotherapie verglichen. Hintergrund war unter anderem eine im Vorjahr präsentierte französische Studie, bei der ältere Patienten eindeutig von der Kombinationstherapie profitierten. Die aktuelle japanische Studie musste allerdings nach einer Interimsanalyse gestoppt werden, weil mit der Kombinationstherapie ein schlechterer Verlauf zu erwarten war. Aus der Auswertung von 259 randomisierten Patienten ging hervor, dass im Monotherapie- Arm zwar mehr Zyklen verabreicht wurden, dafür kam es häufiger zu einem Therapieabbruch wegen Tumorprogression, und es war auch die hämatologische Toxizität im Monotherapie- Arm erhöht. Das progressionsfreie und das Gesamtüberleben waren in beiden Armen (unabhängig vom Patientenalter, < 75 und ≥ 75 Jahre) vergleichbar. Auch wenn sich insgesamt kein Vorteil für die Kombinationstherapie mit fraktioniertem Cisplatin ableiten ließ, wurde in der Diskussion festgestellt, dass die Resultate nicht im Widerspruch zur erwähnten französischen IFTC-Studie von 2010 stehen, da ein anderes Regime benützt wurde. Außerdem zeigen weitere Daten, z. B. aus der SEER-Datenbank, dass eine Kombinationstherapie mit einem Platin für ältere Patienten vorteilhaft sein kann.
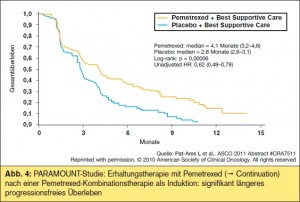
Die Ergebnisse der PARAMOUNT-Studie7 (> Abb. 4) wurden schon lange mit Spannung erwartet. Im Sinne einer Pemetrexed-„Continuation“ wurde in dieser Phase-III-Studie die Erhaltungstherapie mit Pemetrexed nach einer Induktionstherapie mit Cisplatin und Pemetrexed gegenüber Placebo verglichen. 539 Patienten mit nichtplattenepithelhältiger Histologie (in über 80 % der Fälle Adenokarzinome) konnten im Verhältnis 2 : 1 randomisiert werden. Dabei war das PFS (gemessen sowohl ab der Induktionstherapie als auch ab Beginn der Erhaltungstherapie) in der Maintenance-Gruppe signifikant überlegen (medianes Überleben 4,1 vs. 2,8 Monate, p = 0,00006, HR 0,62), dies war für alle Untergruppen in Bezug auf das Tumorstadium, Alter, Geschlecht, den Performance-Status und die Histologie gleich bleibend. Die Lebensqualität-Scores (EQ-5D) zeigten keinen Unterschied zwischen beiden Armen, bei insgesamt tolerabler Toxizität. Die Studie war für den sekundären Endpunkt Gesamtüberleben gepowert, diese Daten sind allerdings noch nicht verfügbar.
INFORM8: Auswertungen hinsichtlich Effizienz, Verträglichkeit und Biomarkerstatus einer randomisierten Phase-III-Studie mit Gefitinib als Erhaltungstherapie bei unselektionierten asiatischen Patienten mit fortgeschrittenem NSCLC nach 4 Zyklen einer platinhaltigen Induktionstherapie zeigen eine signifikante Verbesserung des PFS sowie auch der Ansprechraten und der Krankheitskontrolle. Die Ergebnisse waren für die Subgruppe der Patienten mit EGFR-Mutation am ausgeprägtesten. Dabei konnten 79 Proben (27 % der Gesamtpopulation) ausgewertet werden, davon zeigten 30 (38 %) eine Mutation (die Patientencharakteristika waren in der EGFR-Mutation- positiven und der Gesamtpopulation vergleichbar). Die Überlebenszeiten waren gegenüber dem Placeboarm nicht unterschiedlich, die Nebenwirkungen wurden als tolerabel eingestuft.
Kleinzelliges Bronchialkarzinom, SCLC
Die Phase-III-Studie ACT-19 mit Amrubicin (einem Dritte-Generation-Anthrazyklin und potentem Topoisomerase-2-Hemmer) versus Topotecan zeigte in der Second-Line-Therapie des SCLC in Hinsicht auf den primären Endpunkt Gesamtüberleben vergleichbare Ergebnisse: Ansprechraten, progressionsfreies Überleben und Symptomkontrolle sprachen für Amrubicin, die Toxizität dieser Therapie ist tolerabel.
Obatoclax10: Die randomisierte Phase-II-Studie GEM017 untersuchte die Kombination von Carboplatin/Etoposid mit dem Pan-BCL-2- Antagonisten Obatoclax bei ED-SCLC (ED, extensive disease). Der primäre Endpunkt, eine Verbesserung der Ansprechrate, wurde durch die Zugabe der neuen Therapie nicht erreicht, auch wenn ein positiver Trend zu erkennen war. Dieser zeigte sich auch für das PFS und OS, Nebenwirkungen auf das ZNS und die Leberfunktion haben den Therapieverlauf nicht beeinflusst.
Adjuvante Therapie, Biomarker, Studienkonzepte
TREAT11 ist eine randomisierte Phase-II-Machbarkeitsstudie zur Verbesserung der adjuvanten Chemotherapie des NSCLC in frühen Tumorstadien (mit Cisplatin/Navelbin, der meistverwendeten Therapiekombination, vs. Cisplatin/Pemetrexed, einer im palliativen Setting etablierten Therapieoption). Die Studienziele – eine Reduktion der Toxizität sowie eine Erhöhung der Gesamtdosis und der Compliance – konnte im Pemetrexed- Arm erreicht werden. Überlebensdaten wurden nicht präsentiert, es wurde aber in der Diskussion bemerkt, dass beinahe die Hälfte der Patienten ein Plattenepithelkarzinom hatten und ein höherer Anteil an Patienten mit Stadium-IB-Tumoren enthalten war, was die Ergebnisse sicher beeinflusst hat.
ACOSOG Z403112 ist eine prospektive Phase- II-Studie mit proteomischen Serumanalysen zur Detektion von NSCLC bei verdächtigen Lungenrundherden. Es handelt sich um die bisher größte prospektive Studie zur Sammlung biologischen Materials, leider war die prädiktive Genauigkeit des proteomischen Models nicht ausreichend für die klinische Praxis. In Zeiten der Screening-Computertomographie könnte ein Marker zur Differenzierung von malignen und benignen Knoten sinnvoll sein, andererseits würde man bei einem wachsenden Prozess in jedem Fall eine Biopsie wünschen und sich nicht auf einen Serummarker verlassen.
DFS als Surrogatparameter13: Auf Basis zweier Metaanalysen zur adjuvanten Chemotherapie bei operablem NSCLC wurde untersucht, ob man – in Analogie zum Kolorektalkarzinom – das krankheitsfreie Überleben als Surrogatparameter für das Gesamtüberleben heranziehen könnte. Dies scheint möglich, in verschiedenen Auswertungen korrelierte das krankheitsfreie Überleben mit dem Gesamtüberleben (auch in Hinsicht auf den Therapieeffekt), sodass man das DFS als Endpunkt neuer Studien heranziehen und damit die Entwicklung neuer Medikamentenstrategien, besonders im adjuvanten Setting, beschleunigen könnte – allerdings wurden in der Diskussion auch einige statistische Fallstricke aufgezeigt.
Datierung der Tumorprogression und Impact auf das PFS14: Bei Tumorerkrankungen mit schlechter Prognose ist das Gesamtüberleben sehr stark von der Dauer des progressionsfreien Überlebens bestimmt. Eine kooperative Studiengruppe der NCCTG und SWOG evaluierte den Einfluss der Datierung der Krankheitsprogression auf die Bestimmung des PFS bei fortgeschrittenem Bronchialkarzinom – eine wichtige Frage bei diesem derzeit häufig verwendeten Studienendpunkt. Es wurden unterschiedliche Zeitpunkte (Datum des letzten negativen CT, des CT mit der nachgewiesenen Progression und ein definierter Zeitpunkt dazwischen) für jeden Patienten eingesetzt und die Studienergebnisse dahingehend statistisch neu ausgewertet. Dabei wurde festgestellt, dass mit unterschiedlich erfassten Zeitpunkten der Tumorprogression auch die Studienergebnisse in ihrer Signifikanz unterschiedlich ausfielen. Daher wurde die Notwendigkeit betont, in den Studien einheitliche Standards zur Datierung der Tumorprogres – sion zu etablieren, nicht zuletzt auch deswegen, um die Studienergebnisse untereinander besser vergleichen zu können.
Erhaltungstherapie bei malignem Mesotheliom15: In der Phase-III-Studie mit Thalidomid- Erhaltungstherapie nach Induktionschemotherapie bei malignem Mesotheliom (NVALT 5 + MATES Studiengruppen) zeigte sich ein Trend zum kürzerem Überleben im Behandlungsarm gegenüber dem Beobachtungsarm. Daher scheint eine „Switch Maintenance“- Strategie mit der Substanz nicht sinnvoll. Das Ergebnis dieser Studie steht im Einklang mit ähnlich designten Studien anderer Angiogeneseinhibitoren, die leider auch negativ verlaufen sind, obwohl das Mesotheliom selbst einen hohen Spiegel an VEGF aufweist. Auch hier wird die Entwicklung von biologischen Markern zur besseren Selektion gewünscht.
Neue Therapieansätze
In einem wissenschaftlichen Symposion (Emerging Novel Targets for Lung Cancer) wurden auch erste Studienergebnisse zu völlig neuen Substanzklassen präsentiert und diskutiert, darunter der Heat-Shock-Protein-(Hsp90-)Inhibitor Ganetespib16 und der Toll-like-Rezeptor- Agonist (Mycobacterium w/CADI-05)17 als Immunotherapie. Die Patientenzahlen in diesen Auswertungen waren klein, aber es ließ sich eine Wirksamkeit in einzelnen Subgruppen erkennen, so dass eine weitere Forschung in diese Richtung berechtigt erscheint.
Die Phase III-Studie ATTRACT-118 zum „vascular- disrupting agent“ Vadimezan (ASA404) mit 700 Patienten blieb in allen Parametern negativ, auch in den Subgruppenanalysen ließ sich kein Hinweis auf eine Aktivität dieser Substanz in Kombination mit Chemotherapie nachweisen, obwohl auch hier die Phase-IIErgebnisse viel versprechend erschienen. Die weitere Entwicklung dieser Substanz wurde gestoppt, es erscheint notwendig, in diesem Fall zuerst das eigentliche Target dafür zu bestimmen.
ZUSAMMENFASSUNG: Nicht eingegangen wurde an dieser Stelle auf die Posterpräsentationen und -diskussionen, welche sich in erster Linie mit molekularen Ansätzen in vielfältigen Kombinationen und Indikationen beschäftigten, auch zum Thema Operation und Strahlentherapie gab es Beiträge mit innovativen Strategien.
Das Thema Erhaltungstherapie, ob als „Continuation“ oder „Switch“-Maintenance, bleibt weiter aktuell, solange das Gesamtüberleben damit nicht verbessert wird, werden diese Strategien aber nicht großflächig eingesetzt werden und weiterhin als Option für einige Patienten angesehen. Welche Patienten von dieser Strategie am ehesten profitieren, ist Gegenstand aktueller Diskussionen.
Es ist bestätigt worden, dass bei bekanntem positiven Mutationsstatus eine zielgerichtete Monotherapie in der Erstlinienbehandlung die beste Therapieoption ist (TKI bei EGFR-Mutation, Crizotinib bei ALK-ELM4-Mutation). Inzwischen wurden bereits zahlreiche andere Mutationen detektiert, vor allem beim Adenokarzinom, während eindeutige Daten für das kleinzellige Bronchialkarzinom und das Plattenepithelkarzinom hier noch ausstehen. Prinzipiell lassen sich daraus neue Ziele für zukünftige Medikamente generieren, Mutationen haben aber auch eine wichtige Rolle als prognostische und prädiktive Marker. Es wird auch immer klarer, dass es heute keinen Sinn mehr macht, aufwändige Studien an unselektionierten Patientengruppen durchzuführen; gefordert sind vielmehr molekulare Analysen. Mehrfach zitiert wurde in diesem Kontext eine Zusammenstellung der negativen Phase-III-Studien der letzten 10 Jahre, worin insgesamt ca. 20.000 Patienten eingeschlossen waren und das Gesamtüberleben als Studienziel untersucht, aber nicht erreicht wurde.
1 Rafael Rosell et al., ASCO 2011, Abstract #7503
2 Michael Thomas et al., ASCO 2011, Abstract #7504
3 David R. Spigel et al., ASCO 2011, Abstract #7505
4 Mark G. Kris et al., ASCO 2011, Abstract #CRA7506
5 Alice Tsang Shaw et al., ASCO 2011, Abstract #7507
6 Tetsuya Abe, ASCO 2011, Abstract #7508
7 Paz-Ares Luis, ASCO 2011, Abstract #CRA7510
8 Li Zhang, ASCO 2011, Abstract #LBA7511
9 Robert Jotte et al., ASCO 2011, Abstract #7000
10 Corey J. Langer et al., ASCO 2011, Abstract #7001
11 Michael Kreuter et al., ASCO 2011, Abstract #7002
12 David Harpole et al., ASCO 2011, Abstract #7003
13 Stefan Michiels et al., ASCO 2011, Abstract #7004
14 Sumithra J. Mandrekar et al., ASCO 2011, Abstract #7005
15 Paul Baas et al., ASCO 2011, Abstract #7006
16 Kwok-Kin Wong et al., ASCO 2011, Abstract #7500
17 Chandra Prakash Belani et al., ASCO 2011, Abstract #7501
18 Prima Lara et al., ASCO 2011, Abstract #7502