Adipositas und kardiovaskuläre Erkrankungen
Übergewicht und Adipositas betreffen sowohl Erwachsene als auch Kinder und gehören zu den wesentlichen Gesundheitsproblemen der Industrieländer. Adipositas ist eine multifaktorielle Erkrankung mit einer komplexen Pathogenese, die von biologischen, psychosozialen, sozioökonomischen und umweltbedingten Faktoren beeinflusst wird. Gemäß den Kriterien der Weltgesundheitsorganisation wird Übergewicht durch einen Body-Mass-Index (BMI) ≥ 25 und < 30 kg/m2 und Adipositas durch einen BMI ≥ 30 kg/m2 definiert. Obwohl der BMI stark mit dem prozentualen Körperfettanteil korreliert, gibt es Einschränkungen in der Abschätzung des Körperfettanteils, mit erheblichen Schwankungen aufgrund von Geschlecht, Alter und ethnischer Zugehörigkeit. Die mittels Taillenumfangs gemessene abdominelle Adipositas (≥ 88 cm bei Frauen bzw. ≥ 102 cm bei Männern) ist ein vom BMI unabhängiger Risikofaktor für kardiovaskuläre Erkrankungen.
Epidemiologie: Schätzungen zufolge sind knapp 40 % bis 50 % der Weltbevölkerung übergewichtig oder adipös.1 Nach der Global Burden of Disease Study 2017 hat sich die Adipositasprävalenz zwischen 1980 und 2015 verdoppelt und steigt in den meisten Ländern weiter kontinuierlich an.2 Schätzungen zufolge war im Jahr 2015 ein erhöhter BMI weltweit für 4,0 Millionen Todesfälle verantwortlich, von denen mehr als zwei Drittel auf Herz-Kreislauf-Erkrankungen zurückzuführen waren.2 Auch in Österreich hat Adipositas mittlerweile ein endemisches Ausmaß angenommen. Laut Daten der Statistik Austria gelten 34 % der ÖsterreicherInnen über 15 Jahre als übergewichtig, und 17 % leiden bereits an Adipositas.
Erhöhtes Risiko für kardiovaskuläre Erkrankungen
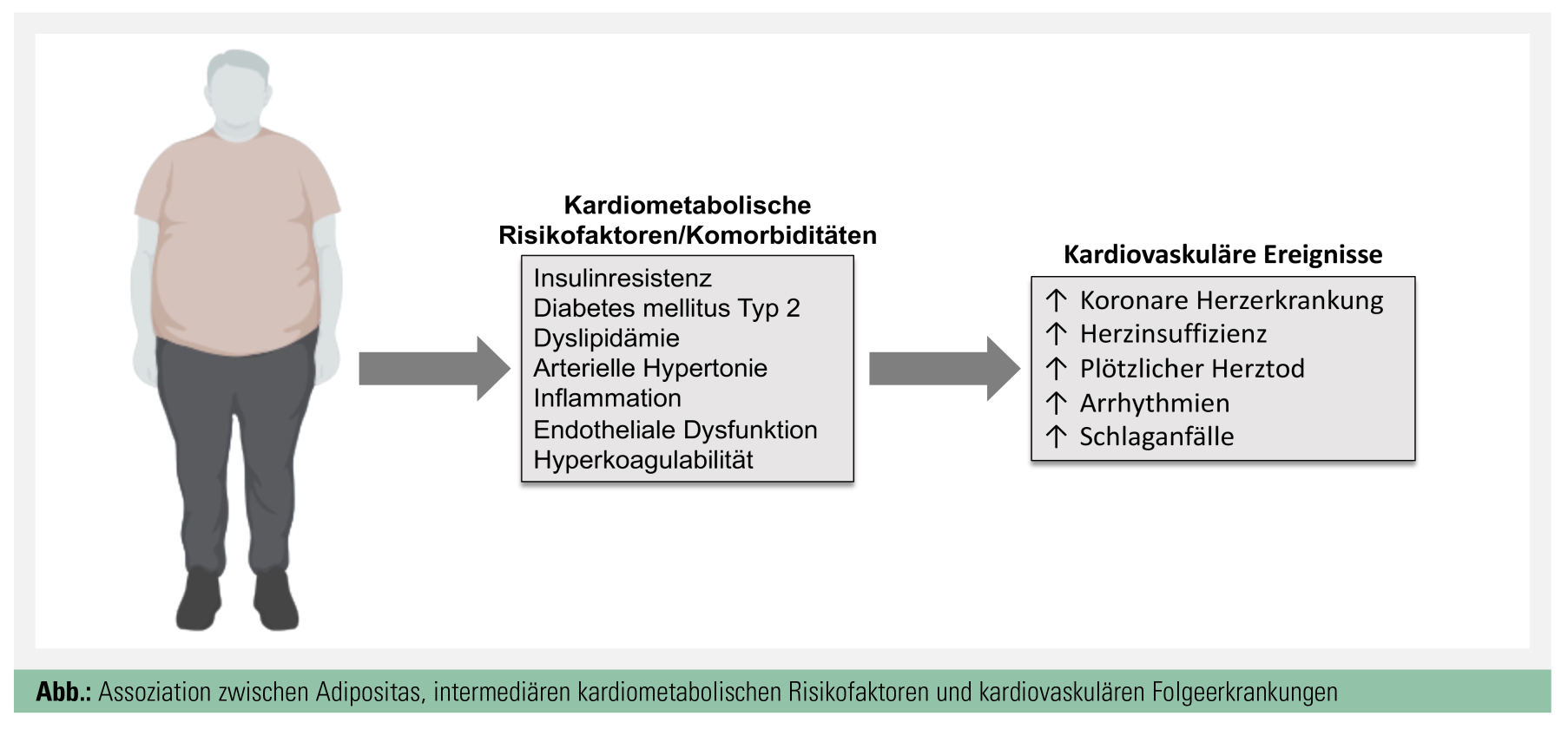
Zahlreiche prospektive Studien haben eine enge Assoziation zwischen einem erhöhten BMI und zahlreichen Komorbiditäten, einschließlich kardiovaskulärer Erkrankungen, arterieller Hypertonie, einigen onkologischen Erkrankungen und dem Schlafapnoe-Syndrom belegt (Abb.).1 Adipositas gilt als wesentliche Hauptkomponente für das metabolische Syndrom, welches mit einem zweifach erhöhten Risiko für kardiovaskuläre Komplikationen verbunden ist.3 In einer britischen Kohortenstudie mit 3,5 Millionen TeilnehmerInnen konnte gezeigt werden, dass Erwachsene mit Übergewicht bzw. Adipositas selbst dann ein erhöhtes Risiko für kardiovaskuläre Erkrankungen hatten, wenn keine metabolischen Auffälligkeiten vorlagen.4 Neuroendokrine Faktoren, wie eine verstärkte Aktivierung des Renin-Angiotensin-Aldosteron-Systems und des sympathischen Nervensystems sowie metabolische Veränderungen, wie Insulinresistenz, Hyperlipoproteinämie und Inflammation, spielen eine wesentliche Rolle bei der Entwicklung kardiovaskulärer Folgeerscheinungen der Adipositas. Das Fettgewebe speichert nicht nur Fett, sondern stellt ein endokrin aktives Organ dar. Es synthetisiert eine Vielzahl von Peptiden und Nicht-Peptid-Verbindungen (u. a. TNF-alpha, Interleukin-6, Plasminogen Activator Inhibitor-1, Resistin, Lipoproteinlipase, Leptin, Angiotensinogen, Adiponectin, Insulin-like Growth Factor-I etc.) und setzt diese in den Blutkreislauf frei, die in weiterer Folge eine Rolle in der kardiovaskulären Homöostase spielen. Zudem begünstigen Adipozytokine und weitere proinflammatorische Botenstoffe die Entstehung von endothelialer Dysfunktion, Hyperkoagulabilität und systemischer Inflammation. Ein Ungleichgewicht zugunsten dieser Faktoren führt zu einem drastischen Anstieg der kardiovaskulären Mortalität und Morbidität.
Adipositas und Herzinsuffizienz
Bereits in der Framingham-Studie konnte gezeigt werden, dass ein Anstieg des BMI mit einem erhöhten Risiko einer Herzinsuffizienz assoziiert ist.5 Demnach haben adipöse PatientInnen ein 2-fach höheres Risiko als Normalgewichtige, eine Herzinsuffizienz zu entwickeln. Bei Männern erhöht ein Anstieg des BMI pro Einheit das Risiko einer Herzinsuffizienz um 5 % und bei Frauen um 7 %. Der gesteigerte metabolische Bedarf bei Adipositas führt zu hämodynamischen Veränderungen, die mit einer Zunahme des zirkulierenden Blutvolumens und erhöhten Blutdruckwerten einhergehen und letztendlich zu einer gesteigerten myokardialen Belastung führen. Chronisch erhöhte Füllungsdrücke begünstigen wiederum eine myokardiale Dysfunktion. Neben diesen direkten Effekten begünstigen auch andere adipositasassoziierte Komorbiditäten wie koronare Herzerkrankung, obstruktives Schlafapnoesyndrom, Diabetes mellitus sowie arterieller Hypertonus die Entwicklung einer Herzinsuffizienz. Die Prävalenz von Fettleibigkeit und Herzinsuffizienz mit erhaltener linksventrikulärer Funktion (HFpEF) gilt als besonders hoch. Einer Studie zufolge leiden 80 % der PatientInnen mit HFpEF auch an Übergewicht oder Adipositas.6 Seltener findet sich eine systolische Herzinsuffizienz als unmittelbare Folge von Adipositas und wird in der Regel nur bei PatientInnen mit einem BMI > 40 beobachtet.
Adipositas und Vorhofflimmern
Mehr als 7 Millionen EuropäerInnen leiden an Vorhofflimmern. Diese Zahl wird sich laut Schätzungen in den nächsten vierzig Jahren verdoppeln.7 Gewichtszunahme und ein erhöhter BMI im mittleren Lebensalter korrelieren stark mit dem Auftreten von Vorhofflimmern. Jede Erhöhung des BMI um 5 Einheiten ist mit einem um rund 29 % höheren Risiko für Vorhofflimmern assoziiert.1 Übergewicht und Adipositas erhöhen das Risiko für Vorhofflimmern durch zahlreiche Mechanismen, einschließlich struktureller und elektrischer Remodeling-Prozesse im Herzen, die zur Entwicklung eines proarrhythmogenen Substrats beitragen. Im Rahmen des BiomarCaRE-Consortium-Projekts (Biomarker for Cardiovascular Risk Assessment in Europe) wurde der Frage nachgegangen, welche Risikofaktoren maßgeblich am Auftreten von Vorhofflimmern beteiligt sind.8 Hierbei wurden die Daten von 79.793 TeilnehmerInnen analysiert, die anfangs frei von Vorhofflimmern waren. Es konnte eindrücklich gezeigt werden, dass etwa 20 % des in dieser Kohorte beobachteten Risikos auf einen erhöhten BMI zurückzuführen waren.
Adipositas und koronare Herzerkrankung
Prospektive epidemiologische Studien haben wiederholt gezeigt, dass Adipositas mit einem erhöhten Risiko für das Auftreten einer koronaren Herzkrankheit verbunden ist.1 In einer 2017 in JAMA Cardiology publizierten Studie konnte gezeigt werden, dass jeder Anstieg des BMI um 4,8 Einheiten mit einem um 35 % erhöhten Risiko für das Auftreten einer koronaren Herzkrankheit assoziiert war.9 Neben dem BMI scheint aber auch die Verteilung des Fettgewebes eine wichtige Rolle zu spielen: In mehreren Studien konnte nachgewiesen werden, dass epikardiales und perikardiales Fettgewebe mit der Progression von koronarem Plaque korreliert.10, 11
Als pathophysiologische Bindeglieder zwischen Adipositas und koronarer Herzkrankheit gelten die systemischen Auswirkungen eines chronisch erhöhten Plasmaglukose- und Insulinspiegels, ein Anstieg der peripheren Insulinresistenz sowie ein gestörter Lipidstoffwechsel. Zudem fördert viszerales Fettgewebe die systemische und vaskuläre Inflammation, die für alle Aspekte der Atherogenese – von der Entwicklung von Fatty Streaks bis hin zur Atherothrombose – von grundlegender Bedeutung ist.
Adipositas bei bestehender kardiovaskulärer Erkrankung
Während Adipositas als eine der wichtigsten Risikofaktoren für das Entstehen von kardiovaskulären Erkrankungen gilt, ist es möglich, dass sich die Beziehung zwischen kardiovaskulärem Risiko und Sterberisiko bei bereits etablierter kardiovaskulärer Erkrankung ändert: Eine Vielzahl von epidemiologischen Studien suggerierte, dass übergewichtige PatientInnen mit kardiovaskulärer Erkrankung möglicherweise einen Überlebensvorteil verglichen mit Normalgewichtigen haben.1 Eine solche Verschiebung des Sterberisikos wird in der Literatur auch als „Adipositas-Paradoxon“ beschrieben. Für die Erklärung des „Adipositas-Paradoxons“ wurden zahlreiche methodische Kritikpunkte erhoben, wie die nicht ausreichende Berücksichtigung möglicher relevanter Einflussfaktoren (Confounder). Als mögliche Confounder wurden in der Literatur oft Alter und Rauchstatus diskutiert. RaucherInnen haben meist ein niedrigeres Gewicht, und ein jüngeres PatientInnenkollektiv weist meist einen höheren BMI auf. Auch Faktoren wie krankheitsbedingte Gewichtsverluste sowie selektives Überleben sind als mögliche Confounder diskutiert worden. Letzteres konstatiert, dass adipöse Menschen mit schwerer Erkrankung früher sterben und eine gesündere selektive Bevölkerungsgruppe überbleiben würde. Ein anderes Erklärungsmodell für das Adipositas-Paradox stellt die „Lead-time-bias“-Theorie dar: Demnach würde bei übergewichtigen PatientInnen beispielsweise die Diagnose einer Herzinsuffizienz früher gestellt werden, da es zu einem früheren Auftreten von Symptomen kommt. Wird die Erkrankung früher erkannt, ist der Beobachtungszeitraum länger, was fälschlicherweise als bessere Prognose interpretiert wird.
Pharmakologische Interventionen
Neben Lebensstilmaßnahmen sind in den letzten Jahren immer mehr pharmakologische Interventionen zur Gewichtsreduktion in den Vordergrund gerückt. Bisher waren in Europa drei Wirkstoffe zur Adipositastherapie zugelassen: Orlistat (Lipasehemmer), Naltrexon/Bupropion (µ-Opioidrezeptor-Antagonist/Dopamin-Noradrenalin-Reuptake-Inhibitor) sowie Liraglutid (GLP-1-Rezeptor-Agonist). Anfang dieses Jahres hat die europäische Arzneimittelbehörde nun auch grünes Licht für den GLP-1-Rezeptor-Agonisten Semaglutid als Antiadipositum gegeben. Während Semaglutid bereits bei PatientInnen mit Typ-2-Diabetes zu einer signifikanten Reduktion von kardiovaskulären Ereignissen führte, konnte nun in den Studien des STEP-(Semaglutide Treatment Effect in People with obesity-)Programms eindrücklich gezeigt werden, dass Semaglutid zur Gewichtsabnahme bei nichtdiabetischen übergewichtigen oder adipösen Erwachsenen hochwirksam ist. Zudem verbesserten sich unter Semaglutid-Therapie auch andere kardiometabolische Risikofaktoren wie Taillenumfang, Lipidwerte, Glukosewerte und Blutdruck.12, 13 Welche Effekte Semaglutid auf das kardiovaskuläre Risiko bei übergewichtigen/adipösen PatientInnen hat, wird derzeit in der SELECT-Studie untersucht.14