Aktuelle Therapiestrategien beim Mantelzell-Lymphom
Das Mantelzell-Lymphom (MCL) ist ein vergleichsweise seltener Subtyp der B-Zell Non-Hodgkin-Lymphome (etwa 8%), das am häufigsten im höheren Lebensalter auftritt (medianes Alter bei Diagnosestellung 65-70 Jahre). Männer sind häufiger als Frauen betroffen; die überwiegende Mehrzahl der Patienten befindet sich bei Diagnosestellung bereits im Stadium IV der Erkrankung. Typisch für das MCL ist die häufige Beteiligung des Knochenmarks, des Gastrointestinaltrakts sowie weiterer extranodaler Regionen. Das MCL ist durch einen charakteristischen Immunphänotyp gekennzeichnet: Neben den B-Zell-Markern CD19 und CD20 wird das CD5-Antigen exprimiert, CD23 fehlt jedoch. Diagnostisch bedeutsam ist die starke Expression von Cyclin-D1, das auf Grund der spezifischen chromosomalen Translokation t(11;14) (q13;q32) vorhanden ist.
Prognose
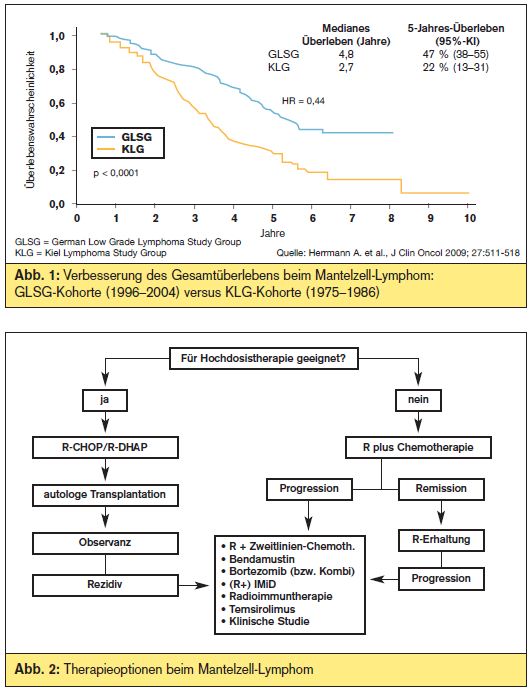
Klinisch weist das MCL meist einen aggressiven Verlauf auf, es zählt zu den Lymphomen mit der ungünstigsten Prognose. Noch vor wenigen Jahren betrug die mittlere Überlebenszeit lediglich 3 Jahre, durch neue Therapiekonzepte konnte die Prognose zuletzt allerdings deutlich verbessert werden (> Abb. 1). Dennoch gibt es ganz unterschiedliche Verläufe, der kürzlich definierte “mantle cell lymphoma international prognostic index” (MIPI) unterscheidet Patienten mit niedrigem, intermediärem und hohem Risiko und entsprechend unterschiedlicher Überlebenszeit. Daneben ist eine gesteigerte Proliferationsaktivität (z. B. Ki-67-Index) bzw. Überexpression von Genen, welche mit der Proliferationsaktivität assoziiert sind (sog. “proliferation signature”), mit einem ungünstigen Verlauf assoziiert.
Eine Subgruppe von Patienten mit MCL zeigt einen klinisch indolenten Verlauf (“smoldering mantle cell lymphoma”), bei dem initial eine abwartende therapeutische Haltung eingeschlagen werden kann. Diese Fälle sind häufig durch die fehlende Expression von SOX11 gekennzeichnet.
Therapie
Ein Algorithmus über das therapeutische Vorgehen beim MCL ist in > Abb. 2 dargestellt. Weiterhin besteht ein großer Bedarf für neue Therapiestrategien, die Behandlung von
Patienten mit MCL sollte daher möglichst im Rahmen von klinischen Studien erfolgen. Außerhalb von Studien sind bei der therapeutischen Entscheidung das Alter und der Allgemeinzustand sowie mögliche Begleiterkrankungen von großer Wichtigkeit.
Hochdosistherapie bei jüngeren Patienten: Mehrere Studien belegen mittlerweile den Vorteil der Hochdosistherapie für jüngere Patienten mit MCL. Kürzlich erfolgte der prospektive Vergleich von 6-mal R-CHOP versus die alternierende Gabe von R-CHOP und RDHAP (jeweils 3 Zyklen) vor autologer Stammzelltransplantation bei bislang unbehandelten Patienten mit MCL im Alter unter 65 Jahren. R-CHOP/R-DHAP führte zu einer signifikant höheren Rate an CR/CRu (60% vs. 41%, p = 0,0003) am Ende der Induktionstherapie. Nach autologer Transplantation waren die Gesamtansprechraten (97% in beiden Armen) und die Raten an CR/Cru (65% vs. 63%) vergleichbar. Dennoch zeigte sich im Behandlungsarm mit R-CHOP/R-DHAP eine signifikant verlängerte Remissionsdauer sowie Zeit bis zum Therapieversagen (median nicht erreicht vs. 49 Monate; p = 0,0384). Toxizitäten waren vergleichbar. Aufgrund dieser Daten sollte Ara-C in
die Induktionstherapie von jüngeren Patienten mit MCL integriert werden.
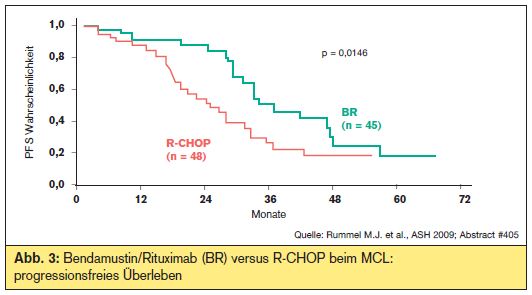
Erstlinientherapie beim älteren Patienten: Überlange Zeit wurde CHOP als Erstlinientherapie verwendet, wobei Remissionsraten von ca. 80% erzielt wurden (CR Abb. 3). Auch beim Nebenwirkungsprofil erwies sich Bendamustin als vorteilhaft, weshalb dieses Schema gerade beim älteren Patienten mit MCL eine neue Therapieoption darstellt.
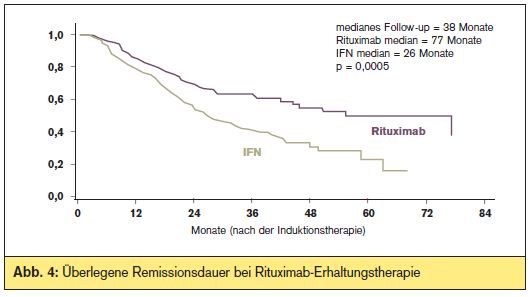
Erhaltungstherapie: Rezente Studiendaten des “European MCL Network” belegen erstmals den Nutzen einer Erhaltungstherapie beim MCL: 560 Patienten mit neudiagnostiziertem Mantelzell-Lymphom im Stadium II-IV und einem Alter > 60 Jahre wurden zunächst zwischen R-CHOP (8 Zyklen zu je 3 Wochen) und R-FC (6 Zyklen zu je 4 Wochen) randomisiert. Patienten mit zumindest einer PR auf die Induktionstherapie wurden ein zweites Mal randomisiert (n = 316): Interferon alpha versus Rituximab (alle 2 Monate bis zur Progression). > Abb. 4 zeigt die mediane Remissionsdauer ab der zweiten Randomisierung (nach Induktionstherapie), welche bei Rituximab-Erhaltung 77 Monate betrug, bei Interferon alpha hingegen nur 26 Monate (p = 0,0005). Dieser remissionsverlängernde Effekt von Rituximab war bei R-CHOP-Vorbehandlung, nicht jedoch im R-FC-Studienarm zu beobachten. Hinsichtlich des Gesamtüberlebens zeigt sich bislang ein deutlicher Trend zugunsten der Patienten im Behandlungsarm mit Rituximab, wenn auch derzeit noch nicht mit statistischer Signifikanz (4-Jahres-Überleben von 77% bei Rituximab versus 62% bei Interferon; p = 0,17). Die besten Daten hinsichtlich der Überlebenszeit fanden sich bei Patienten mit R-CHOP-Induktionstherapie gefolgt von Rituximab-Erhaltung. Dabei wurde das mediane Überleben noch nicht erreicht, die projizierte Überlebensrate bei 72 Monaten lag bei ca. 80%.
Aufgrund dieser Daten, welche einen Vorteil für die R-CHOP-Induktionstherapie sowie eine
Verdoppelung der Remissionsdauer bei Patienten mit Ansprechen auf die Induktionstherapie zeigen, wird vom “European MCL Network” die Therapie mit R-CHOP, gefolgt von Rituximab-Erhaltungstherapie, als neuer Standard bei älteren Patienten mit Mantelzell-Lymphom angesehen. Therapie im Rezidiv: Bei Wiederauftreten des MCL stehen heute mehrere Therapieoptionen zur Verfügung. Dabei gibt es eine Reihe von neuen Substanzen, welche sich in klinischer Prüfung befinden.
• Zweitlinien-Chemotherapie: Bendamustin und Purin-Analoga (Fludarabin, Cladribin) besitzen eine dokumentierte Aktivität. Rituximab + Bendamustin zeigte sich in einer randomisierten Studie der Kombination von Rituximab + Fludarabin signifikant überlegen.
• Radioimmuntherapie: Studien mit Radioimmuntherapie (RIT) als Einzelsubstanz bei Patienten mit rezidiviertem Mantelzell-Lymphom wurden bislang nur an kleinen Patientengruppen durchgeführt. Vorliegende Daten (v. a. mit 90Yttrium-Ibritumomab) zeigen Ansprechraten beim rezidivierten MCL in der Größenordnung von Rituximab (30-35%) mit kurzer Remissionsdauer.
• Bortezomib: Phase-II-Studien dokumentierten die Aktivität von Bortezomib beim rezidivierten Mantelzell-Lymphom mit Ansprechraten zwischen 41% und 50%, die Remissionsdauer wurde mit 6-19 Monaten angegeben. Das Nebenwirkungsprofil entsprach den Erfahrungen aus den Myelomstudien (Polyneuropathie, Diarrhöen, passagere Thrombopenie, Reaktivierung von Herpes zoster). Eigene Daten zeigen eine besondere Wirksamkeit von Bortezomib in Kombination mit Rituximab und Dexamethason (BORID).
• Lenalidomid: Für das Thalidomid-Analogon Lenalidomid liegen beim Mantelzell-Lymphom Phase-II-Daten vor, welche ein Ansprechen in bis zu 50% der Fälle mit rezidiviertem bzw.
chemotherapierefraktärem MCL dokumentieren.
• Temsirolimus: Die m-TOR-Kinase (mammalian target of rapamycin) ist an der gesteigerten Translation von Cyclin-D1 beteiligt. Die Aktivität von m-TOR kann durch das Rapamycinanalogon Temsirolimus blockiert werden. In einer Phase-III-Studie wurde Temsirolimus bei Patienten mit stark vorbehandeltem, rezidiviertem MCL untersucht. Dabei zeigte sich ein verlängertes, progressionsfreies Überleben gegenüber dem Kontrollarm, weshalb Temsirolimus von der EMA die Zulassung für die Therapie in diesem Setting erhielt.
Ausblick
Das Mantelzell-Lymphom bleibt aufgrund der eigenen Biologie und des besonderen Verlaufs eine große klinische Herausforderung. Aufgrund der nach wie vor ungünstigen Prognose besteht ein großer Bedarf an neuen Therapiestrategien, weshalb der Behandlung im Rahmen von klinischen Studien Priorität einzuräumen ist. Gerade durch die Verfügbarkeit von neuen, effektiven Substanzen bestehen heute verbesserte Behandlungsmöglichkeiten, wodurch die berechtigte Hoffnung auf eine weitere Verbesserung des Überlebens von Patienten mit MCL besteht.