Allergie und Atemwege – Allergische Rhinitis und Asthma bronchiale
Allergien sind erblich. Wenn beide Elternteile Atopiker sind, so besteht für Kinder eine zumindest 40- bis 70-prozentige Wahrscheinlichkeit, ebenfalls an einer Allergie zu erkranken. Auch ist unser westlicher Lebensstil mit dem Auftreten von Allergien assoziiert. Bei allergischer Rhinitis zählt vor allem die spezifische Immuntherapie zu den präventiven Maßnahmen, dass kein Asthma bronchiale entstehen kann. Zusätzlich verbessert die Immuntherapie den Verlauf des Asthmas.
Detektion allergischer Ursachen
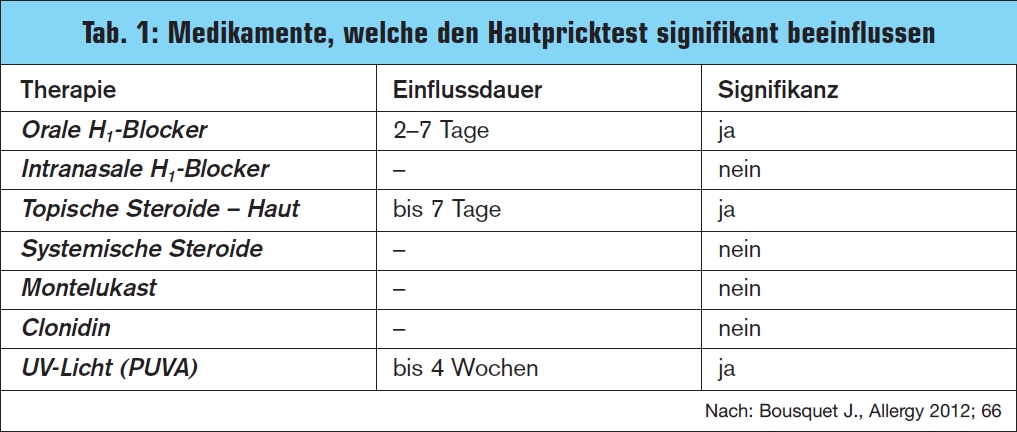
Um Allergien rechtzeitig und korrekt behandeln zu können, muss die Diagnostik bei Verdacht auf eine Allergie unverzüglich begonnen werden. Dazu wird nach ausführlicher Anamnese ein Hautpricktest durchgeführt. In der Jännerausgabe des Journals „Allergy“ wurden neue Richtlinien zur Durchführung des Hauttests abgedruckt. In > Tab. 1 finden Sie Medikamente, die das Hauttestergebnis beeinflussen können. Zur weiteren Verfeinerung der Diagnostik wird im Blut spezifisches IgE bestimmt. Dank der modernen Komponentendiagnostik können die Major- und Minorallergene und somit die Eignung für eine spezifische Immuntherapie bestimmt werden. Eine alleinige Blutabnahme ist als Allergiescreening ungeeignet.
Die Lungenfunktionstestung ist ein fixer Bestandteil der Allergietestung. Da saisonales Asthma bronchiale naturgemäß nur während der Expositionszeit vorkommt, muss die Lungenfunktion unmittelbar nach geschilderten Symptomen durchgeführt werden. Bei Kindern kann die Diagnose Asthma bronchiale schwierig sein, zumal virale Infekte asthmaähnliche Symptome hervorrufen können und Lungenfunktionen erst ab dem 5. Lebensjahr durchgeführt werden können.
Das Geschlecht des Patienten spielt eine wesentliche Rolle in der Abschätzung des Allergie-/ Asthmarisikos. Buben haben häufiger Asthma als Mädchen, mit der Geschlechtsreife ändert sich dieser Trend. Insbesondere eine frühe Menarche – vor dem 12. Lebensjahr – ist mit einem erhöhten Asthmarisiko verbunden. Rezente Daten zeigen auch, dass eine frühe Menarche einen Risikofaktor für eine eingeschränkte Lungenfunktion (FEV1, FVC) darstellt. Des Weiteren können perimenstruelle oder periovuläre Hormonschwankungen Asthmaanfälle auslösen. Eine prophylaktische Adaptie – rung der Therapie erscheint sinnvoll. Letztlich kann auch eine postmenopausale Hormonersatztherapie zu Asthma bronchiale führen.
Therapie der allergischen Rhinitis
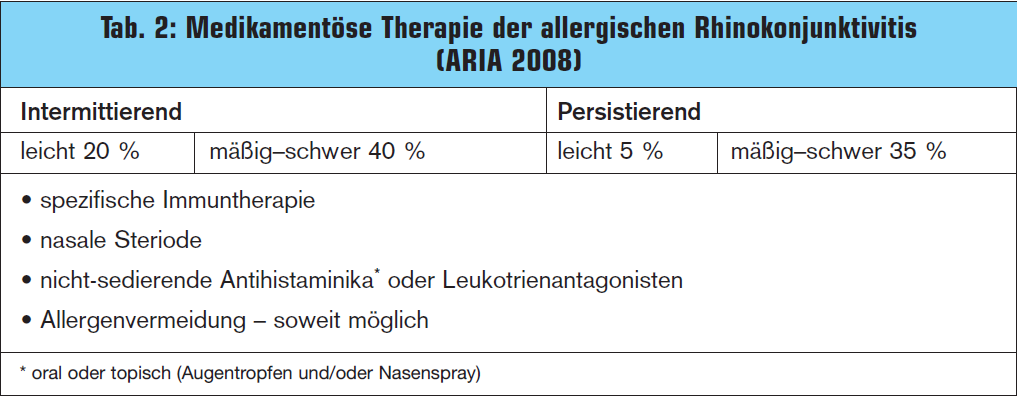
Die allergische Rhinitis ist die häufigste Manifestation der Typ-1-Allergie bei Erwachsenen. Da erwachsene Patienten mit allergischem Asthma bronchiale zumeist auch an allergischer Rhinitis leiden, darf auch die Therapie der Nase nicht vergessen werden (> Tab. 2). Die allergische Rhinitis wird in intermittierende und persistierende Verlaufsformen und nach Schweregrad (leicht, mittel, schwer) eingeteilt. Besonders gravierend ist die nächtliche Beeinträchtigung mit Schlafstörungen und begleitenden Komplikationen wie Tagesmüdigkeit, verminderte Konzentrationsfähigkeit oder Leis – tungsknick. Allergische Rhinitis ist daher mehr als „nur ein Schnupfen“.
Therapie des Asthma bronchiale
Die moderne Asthmatherapie (> Tab. 3) zielt auf größtmögliche Symptomfreiheit und somit maximale Lebensqualität ab. Mit einer frühen Diagnose und einer konsequenten Therapie ist das auch zumeist zu erreichen. Da Asthma bronchiale auf einer chronischen Entzündung der Bronchien beruht, steht die antiinflammatorische Behandlung mit inhalativen Steroiden oder Leukotrienantagonisten im Vordergrund. Lang wirksame Betamimetika steuern einen essenziellen Beitrag zur Symptomfreiheit bei und werden ab GINA Stufe 3 verwendet. In einem experimentellen Setting konnte gezeigt werden, dass rezidivierende bronchiale Obstruktion ohne Inflammation zu Remodelling führen kann. Diese Daten unterstreichen die Wertigkeit der Betamimetika in der Asthmatherapie. Seit kurzem wird auch das lang wirksame Anticholinergikum Tiotropium zur Therapie des schweren Asthma bronchiale diskutiert. Allerdings handelt es sich vorerst noch um eine Off-Label-Therapie, die nicht in den GINA-Guidelines inkludiert ist.
Neue Therapieoptionen mit monoklonalen Antikörpern gegen Il-13 (Lebrikizumab) konnten zwar eine rasche Verbesserung des FEV1 bewirken, die Asthmakontrolle und die Symptomatik veränderten sich nicht. Die Anti-Il-5- Therapie bei schwerem, steroidabhängigem Asthma mit Mepolizumab zeigte bei einer kleinen Patientengruppe (n = 9) nicht nur eine Abnahme der Sputum- und Bluteosinophilen, sondern auch eine signifikant geringere Exazerbationsrate. Die Anti-Il-5-Therapie bei schwerem, steroidabhängigem Asthma mit Reslizumab zeigt ebenfalls eine Abnahme der Sputumeosinophilie und eine Verbesserung der Lungenfunktion, die Asthmakontrolle war aber gegenüber Placebo nicht verbessert.
Eine spannende, wenn auch bisher nicht konklusiv zu beantwortende Frage betrifft die Rolle von Vitamin D in der Pathogenese und der Therapie von allergischen Erkrankungen. Niedrige Vitamin-D-Spiegel wurden bei Kindern mit Asthma und Allergieentwicklung assoziiert, insbesondere bei Buben. Auch fand sich eine Korrelation zwischen niedrigen Vitamin-DSpiegeln und spezifischen IgE-Spiegeln gegen Hausstaubmilben. Bei Kindern mit schwerem Asthma bronchiale korrelierten die erniedrigte Vitamin-D-Spiegel mit erniedrigten FEV1-Werten. Inwieweit eine Vitamin-D-Substitution eine Asthmatherapieoption darstellen könnte, muss offen bleiben.
Nicht zu vernachlässigen ist die Tatsache, dass 80 % der Asthmatiker auch an allergischer Rhinitis leiden. Auf eine adäquate Therapie der Rhinitis darf im Sinne des „One airway“-Konzepts nicht vergessen werden, da eine unbehandelte Rhinitis die Asthmakontrolle erschwert. Zusätzlich haben Patienten mit Rhinitis und Asthma bronchiale die schlechteste Lebensqualität.
Kausale Allergietherapie und Asthmaprävention
Die einzig kausale Therapie der Typ-I-Allergie stellt nach wie vor die spezifische Immuntherapie dar. Die Immuntherapie kann nicht nur bei al – lergischer Rhinitis bis zu 90 % Symptomreduktion erzeugen, sie kann auch die Entstehung beziehungsweise die Progression von Asthma bronchiale langfristig bremsen. Ab einer Beschwerdedauer von zwei Jahren, schwieriger Allergenkarenz, positiver Familienanamnese und einem Alter ab 5 Jahren sollte die Therapie erwogen werden. Eine spezifische Immuntherapie kann gegen Bäume (Hasel/Erle/Birke und/oder Esche), Gräser, Ragweed oder Hausstaubmilben durchgeführt werden.
Der goldene Standard ist nach wie vor die subkutane Applikation über 2 bis 3 Jahre. Erst kürzlich wurde ein neues Standardregime mit verkürzter Aufdosierung und niedriger Erhaltungsdosis vorgestellt. Erreicht wurde diese Modifikation durch Verwendung einer höheren Adjuvansdosis. Durch die verkürzte Aufdosierung kann die Immuntherapie auch noch 2 Monate vor der Blühperiode erfolgen. Die sublinguale Immuntherapie in Tropfenform ist aufgrund geringer Wirksamkeit nicht zu empfehlen, sehr wohl aber die neuen Allergietabletten (AIT – Allergen Immunotherapy Tablet), welche eine hohe Allergendosis applizieren. Leider gibt es derzeit lediglich die AIT gegen Gräser, weitere Allergene werden aber folgen.
Allergie, Asthma und Schwangerschaft
Die Behandlung von Allergien stellt eine der häufigsten Indikationen für die Gabe von Medikamenten während der Schwangerschaft dar. Die Gabe der Antihistaminika Loratadin oder Cetirizin wird als weitgehend risikofrei betrachtet.
Asthmatikerinnen neigen dazu, ihre Therapie abzusetzen und somit eine Asthmaexazerbation zu riskieren und damit möglicherweise die Gesundheit ihres Kindes zu gefährden. Auch in der Schwangerschaft sollte entsprechend der GINA-Guidelines behandelt werden. Selbiges gilt für die allergische Rhinitis. Asthmaexazerbationen sind tunlichst zu vermeiden. Nach strenger Indikationsstellung können Asthma bronchiale und inhalative Allergien weitgehend risikofrei behandelt werden.
Allerdings wurde kürzlich von Tegethoff ein Artikel veröffentlicht, dass Kinder, deren Mütter während der Schwangerschaft Steroid inhaliert haben, gehäuft metabolische und endokrine Erkrankungen entwickelt haben (HR 1,62, p = 0,036). Es liegt in der Verantwortung der behandelnden Ärzte, die Schwangere über die Notwendigkeit und eventuelle Risiken einer suffizienten Therapie aufzuklären. Durch Tegethoffs Studienergebnisse entsteht nun erneut ein Unsicherheitsfaktor in der Behandlung schwangerer Asthmatikerinnen.
FACT-BOX
- Nur eine frühzeitige Allergiediagnostik ermöglicht eine adäquate Therapie.
- Mittels molekularer Diagnostik können die therapierelevanten Majorallergene evaluiert werden.
- Die spezifische Immuntherapie ist nach wie vor die einzige kausale Therapie der Typ-1-Allergie.
- Allergien und Asthma müssen auch während der Schwangerschaft behandelt werden.