Alte Beziehung mit neuen Aspekten
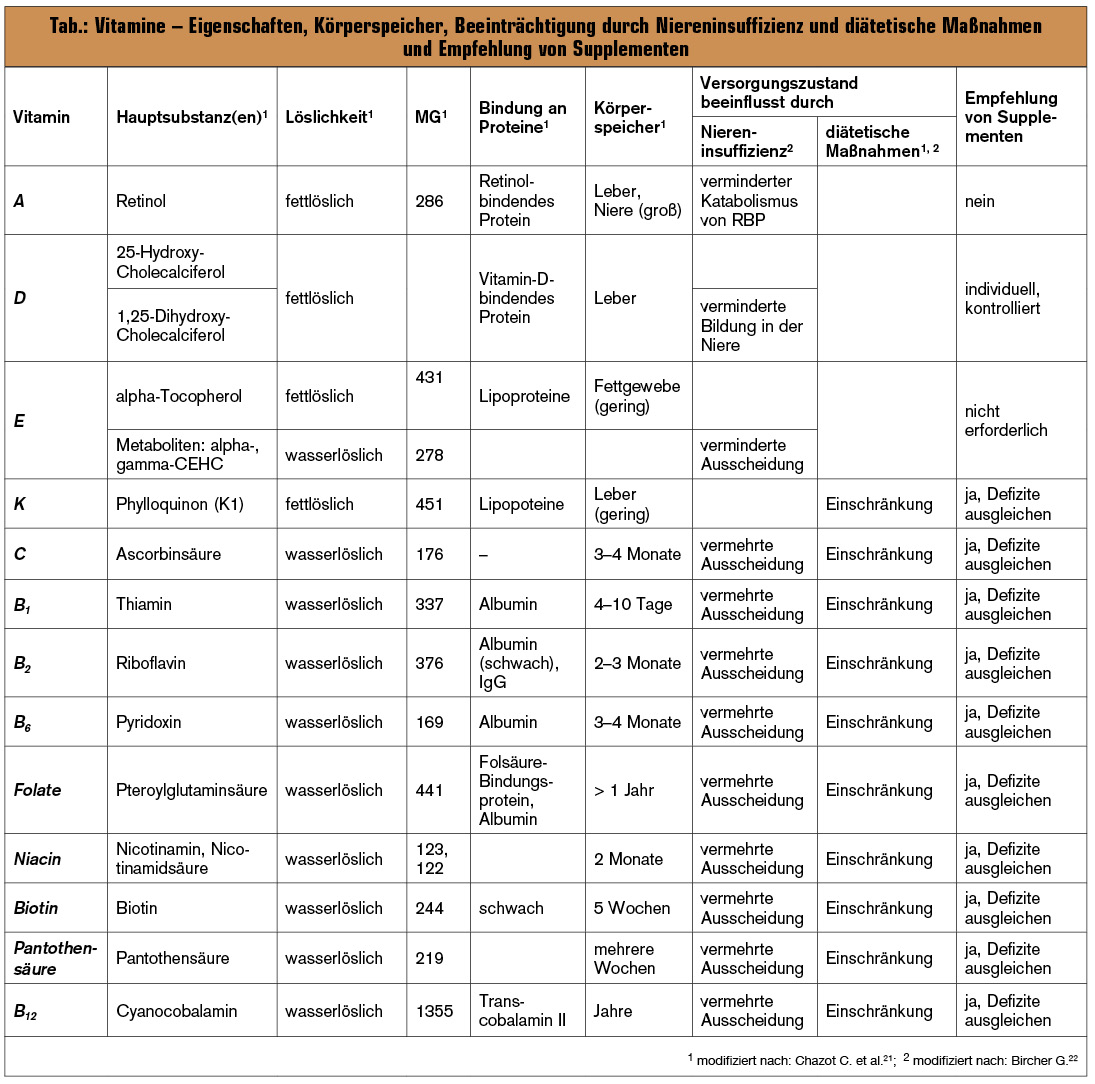
Die Niere spielt im Stoffwechsel verschiedener Vitamine eine wichtige Rolle, sodass es bei Patienten mit chronischer Niereninsuffizienz zu einer Veränderung des Vitaminversorgungszustandes kommt. Man findet sowohl Mangelzustände als auch erhöhte Vitaminkonzentrationen im Plasma (Tab.).
Die zugrunde liegenden Mechanismen umfassen sowohl die glomeruläre Filtration und tubuläre Rückresorption als auch den Katabolismus durch die Tubuluszellen. Transportproteine wie das Retinol-bindende Protein, das Vitamin-D-bindende Protein und das Transcobalamin II werden im Glomerulus filtriert und im proximalen Tubulus durch Endozytose rückresorbiert. Die endozytotischen Rezeptoren Megalin, ein Transmembranprotein der LDL-Rezeptorfamilie, und Cubilin, der intestinale Intrinsic-Factor-Cobalamin-Rezeptor, befinden sich im proximalen Tubulus und sind für die tubuläre Rückresorption von Proteinen, die glomerulär filtriert wurden, verantwortlich.1 Eine Dysfunktion eines der beiden führt nicht nur zu tubulärer Proteinurie, sondern auch zu spezifischen Veränderungen im Vitaminstoffwechsel aufgrund der eingeschränkten proximalen tubulären Rückresorption von Transportproteinen.2 Die Transportproteine können in Lysozymen degradiert werden, während die Vitamine selbst gespeichert, an neu synthetisierte Transportproteine gebunden und an der basolateralen Membran sezerniert werden können.3
Vitamin A (Retinol, Retinsäure): Die Niere ist verantwortlich für den Katabolismus des Retinol-bindenden Proteins (RBP), das für den Retinol-Transport im Plasma – in Form des Retinol-RBP-Transthyretin-Komplexes – von der Leber zu den Zielzellen verantwortlich ist. Freies RBP wird glomerulär filtriert und durch die Tubuluszellen katabolisiert. Zudem scheint die Niere die hepatische Retinol-Freisetzung zu kontrollieren, wobei der Anstieg der Plasmakonzentrationen von Apo-RBP, dem RBP-Transthyretin-Komplex ohne Retinol, ein positives Feedback-Signal für eine vermehrte Freisetzung von Retinol aus der Leber darstellen könnte.4
Patienten mit chronischer Niereninsuffizienz weisen erhöhte Plasmakonzentrationen von RBP sowie von Retinol und Retinylestern auf. Auch der Quotient RBP/Retinol ist erhöht. Als möglicher Mechanismus wurde eine verminderte Bindung von Retinol an RBP diskutiert.5 Bei Hämodialysepatienten wurde der Verlust eines C-terminalen Leucins des RBP beschrieben.6 Ob diese Veränderung die Bindungskapazität von RBP oder seine Katabolisierung durch die Niere beeinträchtigt, ist nicht bekannt.
Die erhöhten Plasmakonzentrationen von Retinol werden durch erhöhte RBP-Konzentrationen erklärt und es wird angenommen, dass diese solange klinisch nicht relevant sind, als der Quotient RBP/Retinol normal oder hoch ist. Es wurde postuliert, dass erst dann Vitamin-A-Toxizität auftritt, wenn die Plasmaretinylesterkonzentrationen in den Lipoproteinfraktionen ansteigen.7 Gewebekonzentrationen, soweit untersucht, wurden bei Niereninsuffizienz nicht konsistent erhöht beschrieben.
Vitamin D (Cholecalciferol): Im Vitamin-D-Stoffwechsel spielt die Niere eine zentrale Rolle. Das durch Parathormon stimulierte Enzym 1α-Hydroxylase katalysiert in der Niere die Hydroxylierung der in der Leber gebildeten Transport- und Speicherform 25-OH-Vitamin-D3 (25-Hydroxycholecalciferol, Calcidiol) in 1α,25-(OH)2-Vitamin-D3 (1α,25-Hydroxycholecalciferol, Calcitriol), die biologisch aktive und auch als Hormon bezeichnete Form von Vitamin D.
Die meisten, wenn nicht alle Wirkungen von Vitamin D, wie die Kalzium- und Phosphatresorption im Dünndarm, die Kalziummobilisation im Knochen und die Kalziumrückresorption in der Niere, werden durch den Vitamin-D-Rezeptor (VDR), einen nukleären Transkriptionsfaktor, mediiert.8 Sobald 1α,25-(OH)2-Vitamin-D3 in den Zellkern eintritt, verbindet es sich mit dem VDR und ermöglicht die Verbindung von VDR mit dem Retinsäure-X-Rezeptor (RXR). In Gegenwart von 1α 25-(OH)2-Vitamin D3 bindet der VDR/RXR-Komplex kurze DNA-Sequenzen, die als Vitamin D Responsive Elements (VDRE) bekannt sind und eine Kaskade von molekularen Interaktionen auslösen, die die Transkription spezifischer Gene modulieren. VDR finden sich auch in zahlreichen anderen Geweben (Gehirn, Herz, Magen, insulinsezernierende Zellen des Pankreas, Haut, Gonaden, und verschiedene Immunzellen).
In der Niere werden verschiedene 1α,25-(OH)2-Vitamin-D3-abhängige Proteine, wie z. B. Plasmamembran-Kalziumpumpe, epithelialer Kalziumkanal, Natrium-Kalzium-Austauscher und Calbindine exprimiert, die für die Kalzium-Rückresorption bedeutend sind.9
Neben den Wirkungen auf die Kalzium-Homöostase und die Knochenmineralisation hat Vitamin D weitere, pleiotrope Effekte8: eine hemmende Wirkung auf die Zellproliferation, eine stimulierende Wirkung auf die Zelldifferenzierung10, eine modulierende Wirkung auf das Immunsystem (Hemmung der Autoimmunität)11 und die Insulinsekretion12 sowie eine hemmende Wirkung auf die Expression des Renin-Gens13.
Vitamin E (Tocopherol): Während Vitamin E als fettlösliches Vitamin über die Galle ausgeschieden wird, führt der Hauptabbauweg von Vitamin E über eine Verkürzung und β-Oxidation der Phytyl-Seitenkette zu den wasserlöslichen Metaboliten α- und γ-Carboxyethyl-hydroxyxchroman (CEHC), die über die Niere ausgeschieden werden. γ-CEHC zeigt eine natriuretische14 und antiinflammatorische Wirkung.15
Patienten mit chronischer Niereninsuffizienz weisen normale Plasmakonzentrationen von α- und γ-Tocopherol und normale Quotienten von Tocopherol/Cholesterin (dem empfohlenen Biomarker für den Vitamin-E-Versorgungszustand) auf. Plasmakonzentrationen von α- und γ-CEHC wurden bei Hämodialysepatienten stark erhöht beschrieben16, was als Hinweis auf eine verminderte renale Ausscheidung dieser Metaboliten gewertet werden kann.
Vitamin C (Ascorbinsäure, Ascorbat): Vitamin C wird glomerulär filtriert und tubulär rückresorbiert. Aufgrund einer Sättigung der tubulären Rückresorption steigt die renale Clearance mit steigenden Plasmakonzentrationen an. Vitamin C wird durch Natrium-abhängige Transporter (SVCT1, SVCT2) transportiert. Ein Fehlen des für die Expression der Transporter verantwortlichen Gens Slc23a1 im Tierversuch manifestierte sich aufgrund des Unvermögens, filtriertes Ascorbat rückresorbieren zu können, in dreifach erhöhten Verlusten mit dem Harn und stark reduzierten Plasmakonzentrationen.17
Patienten mit chronischer Niereninsuffizienz weisen häufig stark erniedrigte Plasma-Vitamin-C-Konzentrationen auf. Nicht ausgeschlossen werden kann, dass ein Verbrauch von Ascorbat im Rahmen von oxidativem Stress an den erniedrigten Plasmakonzentrationen beteiligt ist, eindeutige Beweise für diesen Mechanismus fehlen jedoch.
Vitamin B12 und Folsäure: Vitamin B12 und Folsäure zirkulieren entweder frei oder in proteingebunder Form. Der Transcobalamin-Vitamin-B12-Komplex ist für den Transport von Vitamin B12 vom Plasma ins Gewebe verantwortlich. Die Niere scheint neben der Leber auch eine mögliche Speicherfunktion zu haben, da große Mengen des freien Vitamins in der Niere akkumulieren. Weiters wird Vitamin B12 in der Niere metabolisiert, wodurch die Niere eine Rolle in der Vitamin-B12-Homöostase spielen könnte.18 Der Transcobalamin-Vitamin-B12-Komplex wird glomerulär filtriert und stellt einen hochaffinen Liganden für den endozytotischen Rezeptor Megalin im proximalen Tubulus dar. Nach der Endozytose und Akkumulierung in Endosomen wird Transcobalamin abgebaut und das Vitamin B12-Molekül an neu synthetisiertes Protein gebunden freigesetzt.19
Der Folsäure-Rezeptor mediiert die Endozytose von Folsäure. Interaktionen zwischen dem löslichen Folsäure-Bindungsprotein und dem strukturell eng verwandten Megalin deuten daraufhin, dass Megalin auch eine Rolle in der Aufnahme von Folsäure spielt. Ein weiterer endozytotischer Rezeptor ist essenziell für die tubuläre Aufnahme von Alb
umin, einem weiteren Transportprotein der Folsäure.20
Ursachen für Vitaminmangel
Ernährungsempfehlungen für Patienten mit chronischer Niereninsuffizienz umfassen (a) Einschränkungen der Proteinzufuhr, was die Versorgung mit Vitaminen des B-Komplexes (Thiamin, Riboflavin, Pyridoxin und Cobalamin) einschränkt, und (b) Einschränkungen der Kaliumzufuhr, wodurch die Versorgung mit Vitamin C und K, Thiamin und Folsäure beeinträchtigt wird21.
Dies führt dazu, dass die Zufuhr einzelner Vitamine unter jener der empfohlenen Zufuhr für die gesunde Bevölkerung liegt und einen möglicherweise erhöhten Bedarf, z. B. aufgrund von renalen Verlusten von Vitamin C, Thiamin, Riboflavin und Pyridoxin, von oxidativem Stress und einer chronischen niedriggradigen Entzündung, nicht deckt. Dies gilt ganz besonders für Patienten an der Hämodialyse oder Peritonealdialyse, bei denen durch die Behandlung wasserlösliche Vitamine in substanziellen Mengen entfernt werden.
Vitaminsupplemente
In den oben beschriebenen Fällen sind Supplemente häufig erforderlich. Sie sollen individualisiert und bedarfsangepasst durch Monitoring des Versorgungszustandes verordnet werden. Bei der Gabe von Vitamin C (Risiko: Oxalose22), Vitamin K (Interferenz mit Vitamin-K-Antagonisten) und Vitamin D (besonders bei Verabreichung von 1 α ,25-(OH)2-Vitamin-D3, möglicherweise Förderung der Gefäßverkalkung) ist Vorsicht geboten. Die Gabe von Vitamin A ist nicht indiziert (Tab.).
Schlussfolgerungen
Die Rolle der Niere im Stoffwechsel einiger fett- und wasserlöslichen Vitamine ist bekannt. Einige der zugrunde liegenden Mechanismen sind aufgeklärt, weitere sollten folgen. Die Entdeckung weiterer Wirkungsmechanismen kann, wie das Beispiel Vitamin D zeigt, neue Perspektiven eröffnen.
Auswirkungen der unterschiedlichen Grade der eingeschränkten Nierenfunktion auf den Vitaminversorgungszustand und funktionelle Auswirkungen sind nicht systematisch untersucht und Gewebekonzentrationen sind kaum bekannt.
Offene Fragen, neue Perspektiven
Während die Prävention bzw. Korrektur eines Vitaminmangelzustandes empfohlen wird (Tab.), bleibt abzuklären, ob durch die Gabe von Supplementen bei Patienten mit Niereninsuffizienz positive Effekte über die Prävention eines Vitaminmangelzustandes hinaus erzielt werden können, z. B. durch Vitamin D aufgrund der positiven pleiotropen Effekte.