Antibiotikatherapie in Schwangerschaft und Stillzeit
Ungern verschreibt man als Arzt ein Medikament an eine schwangere Frau, v. a., wenn es sich um eine Neuverschreibung handelt. Gerade im Bereich der antiinfektiven Therapie haben wir es aber meist genau mit diesen Neuverschreibungen zu tun. Im Nachfolgenden soll eine kurze Übersicht über die derzeitige Praxis, aber v. a. auch über die Daten, die der Praxis zugrunde liegen, sowie neuere Studienergebnisse gegeben werden.
Während vor der Schwangerschaft Allgemeinmediziner, gefolgt von Internisten und Hals-Nasen-Ohren-Ärzten für die Mehrzahl von Verschreibungen von Antibiotika verantwortlich sind, werden – sobald eine Schwangerschaft bekannt wird – nahezu 50 % der Neuverordnungen von Gynäkologen durchgeführt. Gleichzeitig geht die Verordnung von Nicht-Beta-Laktamen nach Bekanntwerden der Schwangerschaft schlagartig zurück, während die Verschreibung von Penizillinen kontinuierlich ansteigt und erst unmittelbar nach Ende der Schwangerschaft mit ca. 10 % aller postpartalen Frauen das Maximum erreicht. In Summe erhält in Mitteleuropa ca. eine von 5 Frauen während der Schwangerschaft ein Antibiotikum, wovon wiederum ca. 1–2 % der in verschiedenen longitudinalen Studien beobachteten Medikamente als „potenziell schädlich“ eingestuft werden müssen.
Was bedeutet potenziell schädlich?
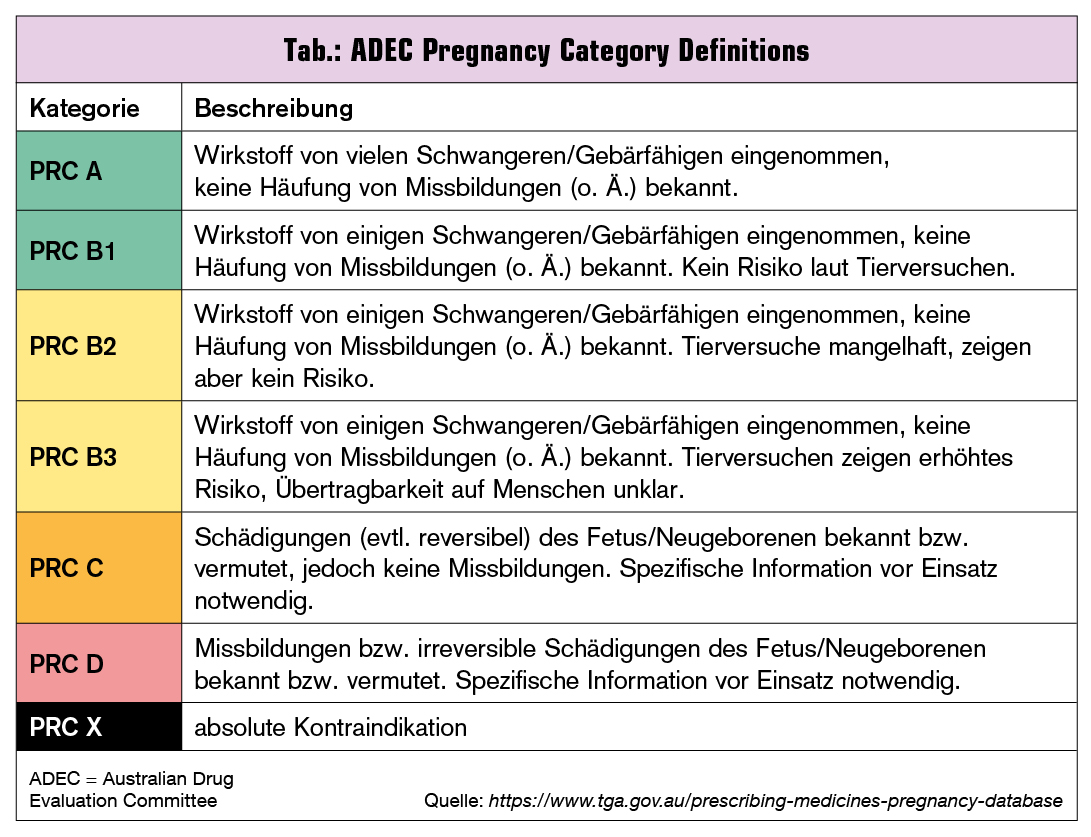
Grundsätzlich können alle Arzneistoffe in Schwangerschaftskategorien – damit meint man das Risiko, während der Schwangerschaft Schäden oder Missbildungen am Fetus zu verursachen – eingeteilt werden. Bespiele hierfür sind die in Deutschland gebräuchliche „Rote Liste“, die Pregnancy Risk Categories (PRC) der US-amerikanischen FDA oder die ADEC Pregnancy Category Definitions der Australischen Behörde (Tab.)
Allen gemeinsam ist, dass sie nicht etwa versuchen, die potenziell schädliche Wirkung bezüglich ihres Schweregrades einzuteilen, sondern hinsichtlich der Evidenz für eine schädliche Wirkung. So unterscheidet die australische Datenbank etwa zwischen humanen Daten und Daten aus Tiermodellen, wertet die Qualität der Studien sowie jene der pharmakologischen Plausibilität.
Es muss hier jedoch ausdrücklich betont werden, dass sowohl präklinische Modelle als auch klinische Studien Limitationen haben. Präklinische Modelle sind nicht unbedingt für den Menschen relevant, so wissen wir heute, dass nur ausgewählte Säugetiere die tragischen durch Thalidomid (Contergan®) verursachten Missbildungen voraussagen hätten können, Ähnliches ist von anderen Medikamenten bekannt. Studien an Primaten werden für Antibiotika nur im Ausnahmefall im Rahmen der Arzneistoffentwicklung gemacht. Klinische Studien haben hingegen einerseits das Problem der Fallzahl (seltene Nebenwirkungen sind vor Zulassung kaum zu entdecken) und Signaldetektion (auch ohne Einnahme von Arzneimitteln ist die spontane Rate von kindlichen Missbildungen während der Schwangerschaft bis zu 3 %), andererseits werden Studien an Schwangeren vor der Zulassung eigentlich gar nicht durchgeführt.
Dennoch kann anhand dieser Datenbanken eine orientierende Einstufung des Risikos während der Schwangerschaft gemacht werden. Von einer detaillierten Auflistung von Substanzen wird an dieser Stelle abgesehen, da dies nicht nur den Rahmen sprengen würde, sondern im Gegensatz zu Online-Daten eine Momentaufnahme wäre und hinzukommende Evidenz nicht berücksichtigen könnte.
Sichere und weniger sichere Substanzen
Weitgehend unbedenklich: Aus heutiger Sicht werden jedoch Penicilline (Penicillin V und G, Amoxicillin, Ampicillin) als bedenkenlos und Makrolide (beste Datenlage für das bei uns kaum mehr gebräuchliche Erythromycin, gefolgt von Azithromycin und Roxithromycin) als weitgehend bedenkenlos eingestuft. Da es in der Schwangerschaft zudem zu Veränderungen im Metabolismus kommen kann (die Aktivität CYP1A2 [Substrat Ciprofloxacin] wird herabgesetzt, während jene von CYP2D6 und CYP3A [Substrat Clarithromycin] vermehrt wird), scheint Azithromycin aufgrund seiner geringen Interaktion mit dem P-450-Enzym-System am besten geeignet. Ähnlich wird Fosfomycin eingeordnet, das jedenfalls in der S3-Leitlinie zur Behandlung von Harnwegsinfektionen von Schwangeren empfohlen wird und ebenfalls keinen enzymatischen Interaktionen unterliegt.
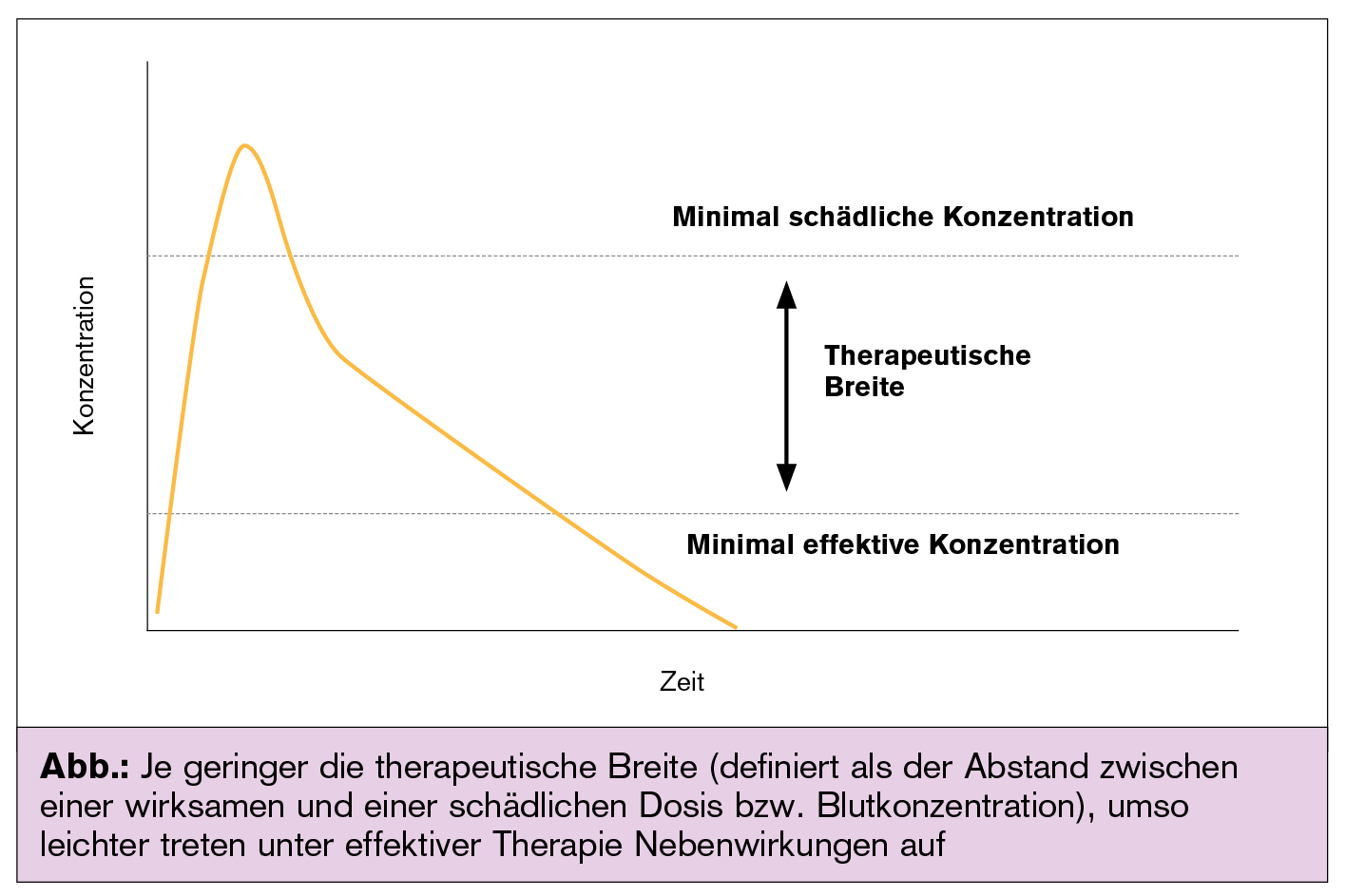
Vorsicht geboten: Tetrazykline und Aminoglykoside werden (obwohl die Datenlage sehr unterschiedlich ist) in der Schwangerschaft einhellig als kontraindiziert angesehen. Weniger klar ist die Situation für Fluoroquinolone (Anzeichen für Schädigung im Tierversuch, wobei die Relevanz für den Menschen unklar ist). Verschiedene Studien und Metaanalysen konnten in der Tat keine negativen Auswirkungen, wie z. B. fetale Anomalien, Tot- oder Frühgeburt, finden, wenn Fluoroquinolone im ersten Trimenon verabreicht wurden. Im Übrigen stimmt die Risikoeinteilung im Rahmen von Schwangerschaftskategorien gut mit jener hinsichtlich therapeutischer Breite überein (Abb.). Antibiotika mit hoher therapeutischer Breite wie Beta-Laktame und Makrolide sind auch für die Mutter unbedenklicher als jene mit geringerer Breite wie Aminoglykoside, Tetrazykline oder Fluoroquinolone. Eine Dosisanpassung ist üblicherweise bei schwangeren Frauen, die Antibiotika der beiden erstgenannten Klassen erhalten, nicht notwendig oder empfohlen.
Antibiotika-Kollateralschäden: Abseits dieser Überlegungen zur klassischen Teratogenität und direkten Fruchtschädigung hat man rezent vermehrt versucht, sogenannte Kollateralschäden von Antibiotika zu erfassen. So konnte etwa in einer randomisiert kontrollierten Studie gezeigt werden, dass die Therapie von Frauen mit vorzeitigem Blasensprung mit Amoxicillin und Clavulansäure verglichen mit Placebo, aber auch verglichen mit Makrolidtherapie signifikant häufiger zu nekrotisierender Kolitis von Neugeborenen führt. Weniger naheliegend fand man in einer weiteren randomisierten, kontrollieren Studie mit Kindern, deren Mütter wegen Frühgeburt pränatal Antibiotika erhielten, signifikant mehr Zerebralparesen nach 7 Jahren. Ähnliches wurde (allerdings in Kohortenstudien und somit anfällig für Confounder) für kindliche Epilepsie, entzündliche Darmerkrankungen und Asthma beobachtet; zurückgeführt wird dies von den jeweiligen Autoren v. a. auf eine Störung des kindlichen Mikrobioms.
Zugegebenermaßen unterliegt das Mikrobiom als Thema momentan einem medizinischen Hype. Jedoch konnte in einer anderen klinischen Studie belegt werden, dass auch 90 Tage nach der Geburt die Darmflora von Kindern, die unter antibiotischer Abschirmung zur Welt gekommen sind, von jener von Kindern unbehandelter Mütter abweicht. Interessanterweise war dieser Effekt in brustgestillten Säuglingen signifikant kürzer zu beobachten als in jenen, die ausschließlich mit Ersatznahrung gefüttert wurden.
Resümee
Letztlich trägt der Arzt, wie bei jeder Verordnung, die Verantwortung zur Abschätzung von Nutzen und Risiko für Kind und Patientin. Vor allem bei Beta-Laktam-Intoleranz ist die antibiotische Therapie in der Schwangerschaft herausfordernd und wenig evidenzbasiert hinsichtlich des Risikos für den Fetus. Azithromycin oder Fosfomycin können – wo mikrobiologisch adäquat – sinnvolle Alternativen darstellen.
Zusammenfassend kann gesagt werden, dass mehr klinische Daten zum sicheren Einsatz von Antibiotika in der Schwangerschaft nötig erscheinen. Wie immer sollten Antibiotika nicht ohne kritisches Hinterfragen der Indikation eingesetzt werden, insbesondere, da wir relevante Langzeitfolgen – auch wenn viele Kollateralschäden keinesfalls als bewiesen angesehen werden können – auch nicht ausschließen können.