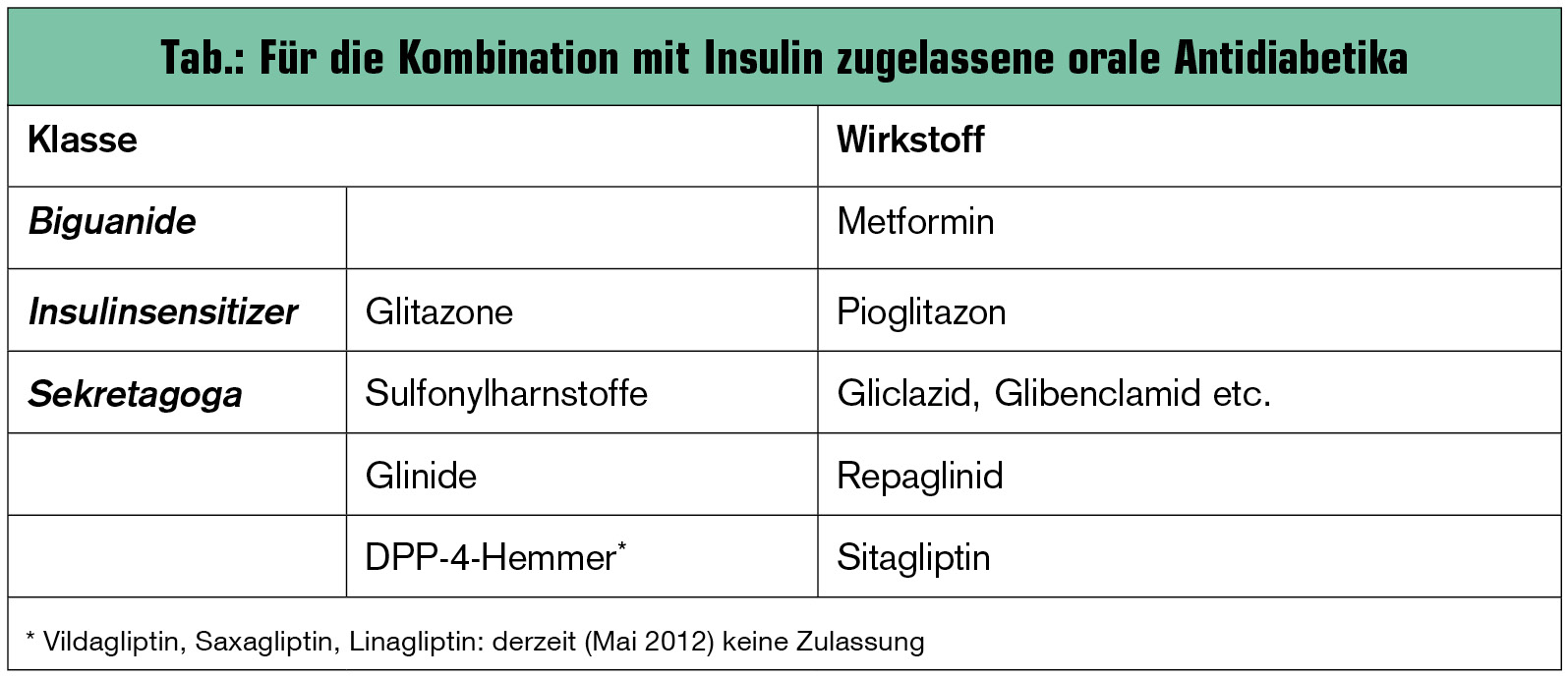
Typ-2-Diabetes – Antidiabetische Kombinationen mit Insulin
Zur Erlangung einer langfristig guten Diabeteseinstellung ist im Verlauf des Diabetes mellitus Typ 2 in der Regel am Ende eine Insulintherapie notwendig. Für viele der heute zugelassenen oralen Substanzklassen besteht eine Zulassung in Kombination mit Insulin. Eine Ausnahme bilden die DPP-4-Inhibitoren (Gliptine) – hier hat derzeit (Mai 2012) nur Sitagliptin eine solche Zulassung (Tab.). Im weiteren Verlauf des Diabetes bei Nichterreichen der Therapieziele ist eine Umstellung auf eine konventionelle oder intensivierte Insulintherapie der folgende Schritt.
Kombination mit Metformin und Pioglitazon
Die Medikation mit Metformin sollte bei Patienten mit Typ-2-Diabetiker belassen werden, da durch Hemmung der Glukoneogenese in der Leber weniger Insulin benötigt wird.
Auch eine Kombination von Insulin mit Pioglitazon – entweder bei Metformin-Kontraindikation oder additiv zu Metformin – kann zur Verringerung der benötigten Insulinmengen sinnvoll sein (Liao et al., Chin Med J 2010). Dies sollte jedoch vorsichtig etabliert werden, da es durch die Insulintherapie als auch den Sensitizer zu einer vermehrten Wasserretention und dadurch zu einer Ödembildung mit konsekutiver Belastung des Herzens kommen kann.
Kombination mit Sekretagoga
Die Verabreichung von Insulinsekretagoga zu einer konventionellen oder intensivierten Insulintherapie bringt in der Regel nur eine geringe Verbesserung der Stoffwechsellage, wobei es bei der Gruppe der Sulfonylharnstoffe und Glinide zu einer erheblichen Hypoglykämiegefahr kommen kann; diese Kombination wird deshalb unsererseits nicht empfohlen.
Die Kombination von Insulin mit einem DPP-4-Hemmer hebt das Hypoglykämierisiko nicht, ist jedoch in der Regel nur mit einer max. möglichen HbA1c-Wert-Reduktion von 0,2 bis 0,5 Prozentpunkten verbunden (Fonseca et al., Diabetologia 2007; Barnett et al., Curr Med Res Opin 2012) verbunden. Ausschlaggebend für den Erfolg der Verbesserung der Stoffwechsellage ist die Diabetesdauer des Patienten: Nach langer Diabeteslaufzeit ist die Insulineigensekretion des Patienten gering, und so können Sekretagoga additiv keine Verbesserung der Stoffwechsellage erbringen.
Kombination mit GLP-1-Mimetika
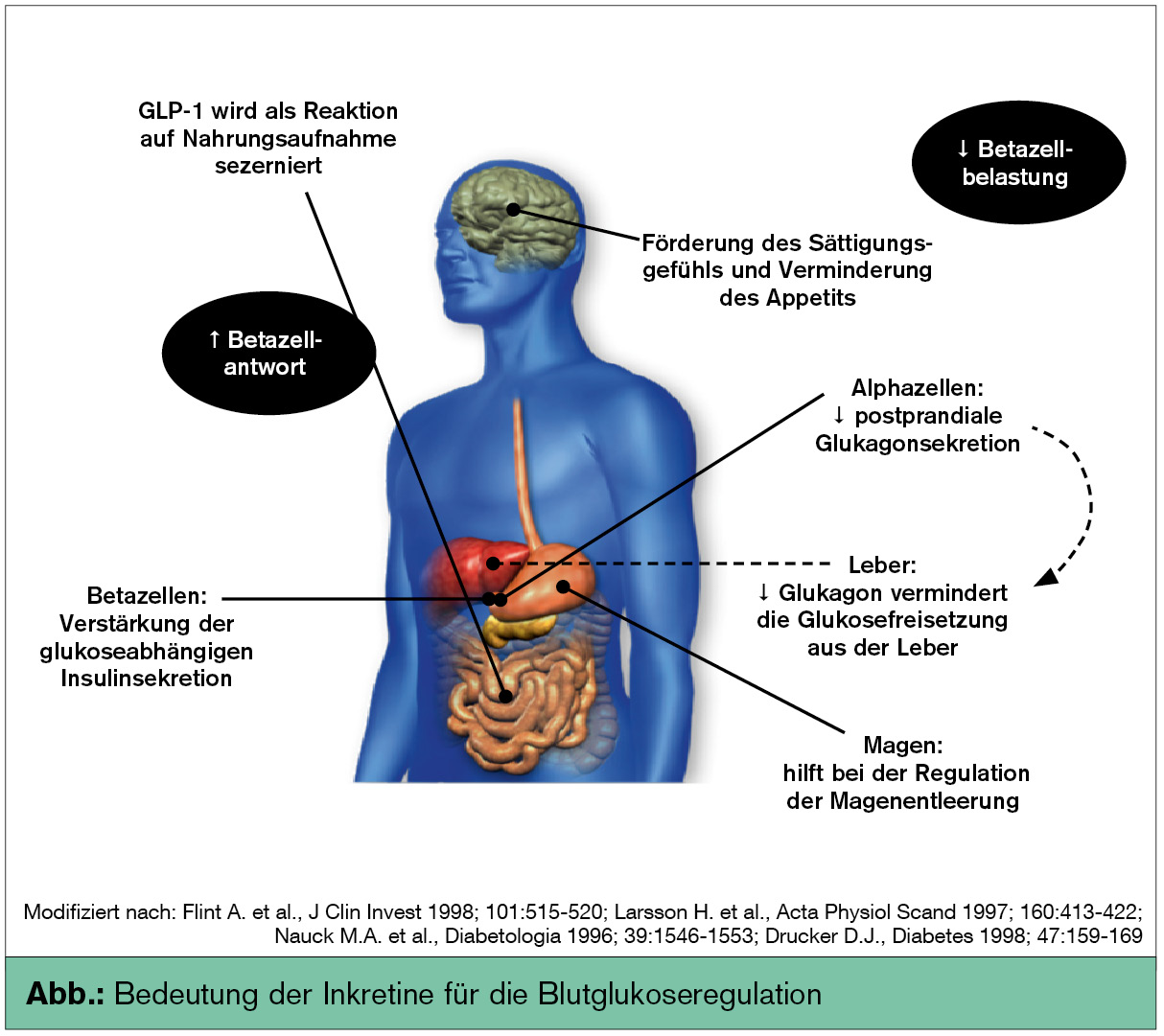 Glucagon-like-Peptide-1-(GLP-1)-Rezeptoragonisten (Exenatid, Liraglutid) sind subkutan zu injizieren. Es kommt über den Inkretineffekt zur blutzuckerabhängigen Verbesserung der Insulinsekretion; weitere Effekte sind in der Abb. dargestellt. In Österreich ist diese Substanzgruppe seit ca. 4–5 Jahren zur Therapie übergewichtiger Patienten mit Typ-2-Diabetes verfügbar. In der Regel werden GLP-1-Mimetika nach Versagen der oralen antidiabetischen Therapie vor einer Insulintherapie eingesetzt (Henry et al., Endocr Pract 2011; Crast et al., Drugs Today 2011).
Glucagon-like-Peptide-1-(GLP-1)-Rezeptoragonisten (Exenatid, Liraglutid) sind subkutan zu injizieren. Es kommt über den Inkretineffekt zur blutzuckerabhängigen Verbesserung der Insulinsekretion; weitere Effekte sind in der Abb. dargestellt. In Österreich ist diese Substanzgruppe seit ca. 4–5 Jahren zur Therapie übergewichtiger Patienten mit Typ-2-Diabetes verfügbar. In der Regel werden GLP-1-Mimetika nach Versagen der oralen antidiabetischen Therapie vor einer Insulintherapie eingesetzt (Henry et al., Endocr Pract 2011; Crast et al., Drugs Today 2011).
Die Kombination mit einem Biguanid ist notwendig. Eine weitere Kombination mit einem Sulfonylharnstoff kann eine Verbesserung bringen, birgt jedoch eine Hypoglykämiegefahr und reduziert den möglichen Gewichtsverlust. Bei Nichterreichen der Therapieziele ist auch eine Kombination mit einem Basalinsulin durchaus möglich. Liraglutid hat die Zulassung in Kombination mit Insulin detemir. Die Übernahme der Therapiekosten eines GLP-1-Analogons in Kombination mit Insulin wird von der Krankenkasse im Einzelfall überprüft.
Eine weitere Option ist die additive Zugabe eines GLP-1-Rezeptoragonisten zu einer laufenden konventionellen oder intensivierten Insulintherapie zur Reduktion der Insulindosis und Reduktion des Übergewichts. So kann eine Verminderung der Insulindosis um 30–50 % erreicht werden, was im weiteren die Gewichtsreduktion additiv zur Wirkung des GLP-1-Analogons unterstützt. Der HbA1c-Wert kann je nach Ausgangslage und Eigensekretionslage um bis zu 1–2 % abgesenkt werden (Levin et al., Curr Med Res Opin 2012). Nach ca. 20 Wochen Therapiedauer kommt es in der Regel zu keinem weiteren Gewichtsverlust. Der Gewichtsverlust beträgt um die 2–6 kg (Visbøll et al., BMJ 2012).