ASH 2020 | Maligne hämatologische Erkrankungen
Neue Therapien und klinische Studien
Im Rahmen des ASH-Kongresses stachen zwei Studien besonders hervor, in denen die neuesten Therapien gegen das rezidivierte/refraktäre multiple Myelom (r/r MM) untersucht wurden.
In der Phase-Ib/II-Studie CARTITUDE-1 wurden bei Patienten, die mit Ciltacabtagene Autoleucel (Cilta-cel, CAR-T-Zellen mit einem B-Zell-Maturation-Antigen) vielversprechende Ergebnisse in Hinblick auf Gesamtansprechraten (Overall Response Rate, ORR) von 97 % und das 6-monatige Gesamtüberleben von 93,8 % erzielt.1
Talquetamab, der bispezifische Antikörper GPRC5D-CD3, ist ein neues Ziel bei MM und induziert die Zerstörung von GPRC5D-exprimierenden MM-Zellen durch aktivierte T-Zellen. In einer Phase-I-Studie konnte Talquetamab eine ORR von 78 % (i. v.) bzw. 67 % (s. c.) erreichen.2
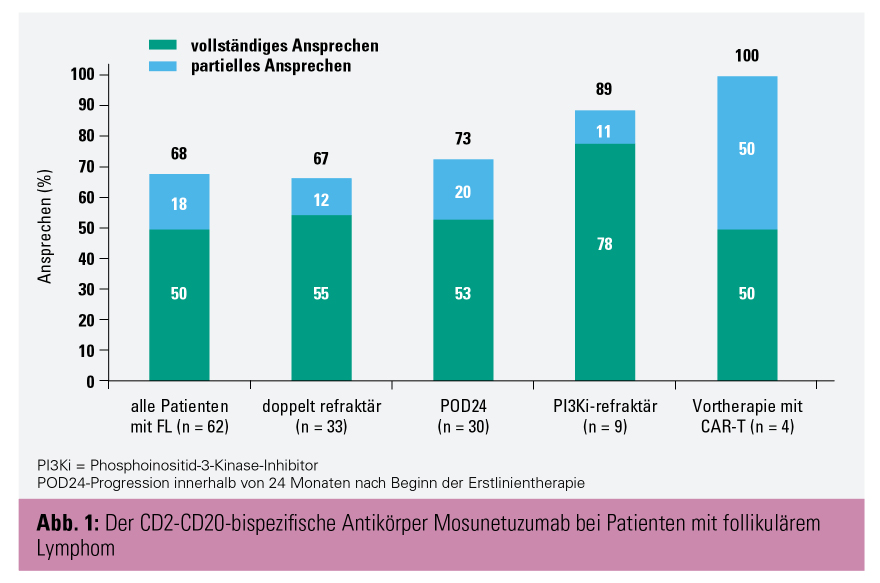
In verschiedenen Abstracts wurde die klinische Wirksamkeit des bispezifischen Antikörpers Mosunetuzumab erhoben. Mosunetuzumab ist ein humanisiertes IgG gegen CD20 und CD2, womit T-Zellen maligne B-Zellen effektiv eliminieren können. In einer Phase-I-Studie konnte bei 62 Patienten mit r/r follikulärem Lymphom eine gute Tolerabilität und eine ORR von 68 % beobachtet werden (Abb. 1).3
Auch bei unbehandelten älteren und unfitten Patienten mit DLBCL (diffuses großzelliges B-Zell-Lymphom) mit limitierten Behandlungsmöglichkeiten zeigte Mosunetuzumab gute Ansprechraten.4
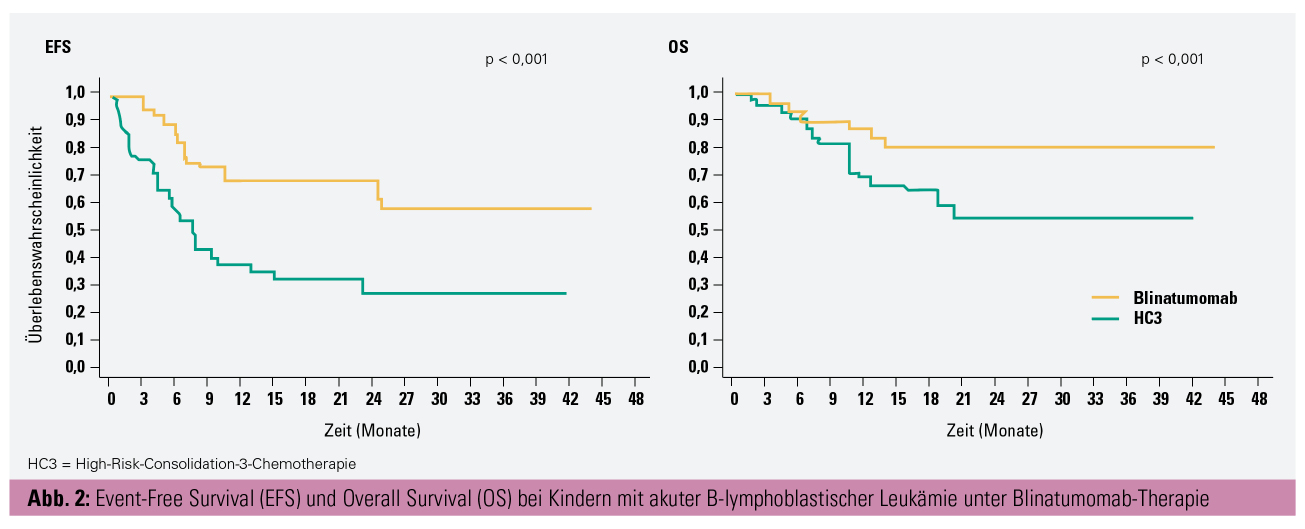
Der bispezifische Antikörper Blinatumomab (CD3-CD19) konnte als Ergänzung zur Chemotherapie in einer Phase-III-Studie bei Kindern mit akuter B-lymphoblastischer Leukämie ein signifikant besseres Ergebnis in Event-free Survival zeigen (Abb. 2).5
Basierend auf der ZUMA-1-Studie bei refraktären großen B-Zell-Lymphomen, die 2017 im New England Journal of Medicine publiziert wurde, wurden weitere Studien mit der Anti-CD19-CAR-T-Therapie Axicabtagene Ciloleucel (Axi-cel) vorgestellt. In der ZUMA-5-Phase-II-Studie wurde bei 124 Patienten mit r/r Mantel-zell-Lymphom oder r/r follikulärem Lymphom eine ORR von 92 % (MZL) bzw. 94 % (FL) beobachtet.6
Neuigkeiten in der CAR-T-Zell-Therapie
Ein Höhepunkt im besseren Verständnis zielgerichteter Therapien war eine Arbeit aus Stanford, die untersuchte, warum die revolutionierende CD19-CAR-T-Zell-Therapie Axicel bei DLBCL nur bei 40–50 % der Patienten zu einer kompletten Remission führt. Das Team entdeckte, dass Mutationen und eine erniedrigte Expression von CD58 hierfür der Grund sein könnten. In vitro gelang es ihnen, zu zeigen, dass das Oberflächenprotein CD2 auf T-Zellen, der Ligand für CD58, wesentlich zur CAR-T-Aktivierung beiträgt. Nach einer Reihe eleganter in-vitro-Experimente integrierten sie eine CD2-kostimulierende Domäne in das CAR-Molekül und erreichten damit eine signifikant erhöhte Antitumoraktivität der CAR-T-Zellen.7
Updates zu aggressiven T-Zell-Lymphomen
In Hinblick auf neue Therapiemöglichkeiten für T-Zell-Lymphome kam die Phase-III-Studie Ro-CHOP leider zu ernüchternden Ergebnissen. Der Zusatz von Romidepsin, einem Histon-Deacetylase-Inhibitor, zur konventionellen Chemotherapie CHOP zeigte bei 421 Patienten mit peripherem T-Zell-Lymphom kein verbessertes PFS und eine erhöhte Toxizität. Einzig in der Subgruppe AITL (angioimmunoblastische T-Zell-Lymphome) zeigte die Kombination Ro-CHOP in der ersten Analyse ermutigende Wirkung. Eine Auswertung der Subgruppen wird noch durchgeführt.8
Bessere Behandlungsoptionen für T-Zell-Lymphome und ihre heterogenen Subgruppen stehen nach wie vor aus.
Mittels Ex-vivo-functional-Drug-Screenings (FDS) kann die Sensitivität von primären, biopsierten Tumorzellen von Patienten gegen hunderte von zugelassenen Krebstherapien ex vivo getestet werden. In der EXALT-Studie9 wurde die ex vivo wirksamste Therapie des FDS ins Tumorboard miteinbezogen. Ein Ergebnis dieser Studie zeigte, dass gerade die heterogenen T-Zell-Lymphome von personalisierter und gezielter Therapie besser profitieren könnten.
Neues bei Stammzelltransplantationen
Die REACH3-Studie (Phase III) untersuchte die Behandlung von chronischer Graft-vs.-Host-Erkrankung nach Stammzelltransplantation. Mit dem JAK1/2-Inhibitor Ruxolitinib konnte eine verbesserte Wirksamkeit und ein günstigeres Nebenwirkungsprofil als mit konventioneller steroidhaltiger Therapie erzielt werden.11
Entstehung von Krebs besser verstehen
Dem Team um Anna Nam an der Universität Weill Cornell Medicine gelang es, Einzelzellanalysen von mRNA, Methylom und Genotyping bei CD34+-Zellen von Patienten mit multiplem Myelom zu kombinieren.
Damit erklären sie auf Einzelzellebene einen Mechanismus, wie Mutationen im DNMT3AR882-Gen in CD34+-Progenitoren zur Expansion von bestimmten Zelllinien in der Hämatopoese führen. Diese Expansion geschieht über selektive Hypomethylation, die zu einer erhöhten MYC-Aktivität und somit zu einem rapiden Wachstum bei malignen Zellen führt.12
Eine weitere Arbeit verwendete ebenfalls Einzelzell-RNA-Analysen gemeinsam mit Whole-Genome Sequencing. In silico fand sich, dass JAK2V617F-Mutationen bei Patienten mit myeloproliferativer Neoplasie (MPN) wohl 10–20 Jahre vor klinischer Erstdiagnose nachweisbar sind. Die Autoren treffen die provokative Aussage, dass Mutationen vor Krankheitsbeginn detektiert werden und als Ziel für eine frühzeitige Behandlung dienen könnten.13
Im immunkompetenten Mausmodell konnte gezeigt werden, wie der Proteasom-Inhibitor Bortezomib (BTZ) zur Tumorregression bei MM führt. BTZ induziert in vitro in MM-Zellen die Präsentation von Calreticulin, einem Protein des endoplasmatischen Retikulums, an der Oberfläche. Calreticulin kann nun von dendritischen Zellen erkannt werden, die jetzt wiederum T-Zellen gegen MM Zellen aktivieren.14
RESÜMEE: Die bispezifischen Antikörper Mosunetuzumab, Talquetamab oder Blinatumomab können aufgrund vielversprechender erster klinischer Studien und einer einfachen Handhabung in Zukunft wesentlich an Bedeutung gewinnen. Hingegen können die aufwendigeren CAR-T-Therapien zielgerichteter eingesetzt werden, indem Ursachen für niedrige Ansprechraten genau erforscht werden.
- Madduri D, ASH 2020; Abstract #177
- Chari A, ASH 2020; Abstract #290
- Assoulin S, ASH 2020; Abstract #702
- Olszewski A, ASH 2020; Abstract #401
- Locatelli F, ASH 2020; Abstract #268
- Jacobson C, ASH 2020; Abstract #700
- Majzner R, ASH 2020; Abstract #556
- Bachy E, ASH 2020; Abstract #039
- Kornauth C, ASH 2020; Abstract #359
- Zeiser R, ASH 2020; Abstract #77
- Nam A, ASH 2020; Abstract #107
- Egeren DV, ASH 2020; Abstract #714
- Gulla A, ASH 2020; Abstract #665