Thrombose: Covid-19, Tumorerkrankungen
Venöse Thromboembolie und Koagulopathie bei COVID-19
Bereits kurz nach Beginn der globalen COVID-19-Pandemie gab es erste Hinweise auf ein exorbitant hohes Risiko venöser Thromboembolien (VTE) bei schwer erkrankten PatientInnen, insbesondere unter intensivmedizinischer Betreuung.1 Darüber hinaus mehren sich die Hinweise, dass die systemische Koagulopathie und Endothelzell-Dysfunktion ein pathophysiologisches Spezifikum einer COVID-19-Erkrankung darstellt, das einerseits zum schweren Verlauf der Erkrankung beiträgt und andererseits mittels Gerinnungsbiomarkern für prognostische Zwecke herangezogen werden kann.2 Eine rezente systematische Übersichtsarbeit unserer Arbeitsgruppe zur Häufigkeit venöser Thromboembolien bei hospitalisierten COVID-19-PatientInnen, basierend auf gepoolten Daten von 28.173 Individuen aus 66 Studien, quantifiziert das VTE-Risiko für PatientInnen auf der Normalstation mit 5–11 % und für jene auf Intensivstationen mit 18–28 %.3 Auf dieser Basis wird aktuell die Antikoagulation in prophylaktischer Dosis bei hospitalisierten PatientInnen mit COVID-19 empfohlen.2 Hochrelevante Fragen zu diesem Thema – insbesondere zu intensivierter, höher dosierter Antikoagulation bei PatientInnen mit COVID-19 – bleiben jedoch nach wie vor aufgrund mangelnder Ergebnisse aus randomisiert kontrollierten Studien unbeantwortet. Am ASH 2020 (American Society of Hematology) wurden nun einige wichtige neue Aspekte zum Thema „Thrombose und Blutgerinnung bei COVID-19“ präsentiert.
Thrombose bei COVID-19 und Krebserkrankungen: Dr. Ang Li präsentierte wichtige Daten aus dem internationalen, kollaborativen COVID-19 and Cancer Consortium (CCC19), die sich speziell auf die vulnerable Gruppe der PatientInnen mit Krebserkrankungen unter COVID-19 konzentrierten. Von den 1.629 hospitalisierten PatientInnen mit COVID-19 und Krebserkrankungen entwickelten 9,3 % eine venöse Thromboembolie und 5,2 % eine Lungenembolie, mit entsprechenden Raten von 13,4 % und 7,9 % unter intensivmedizinischer Behandlung. Als Risikofaktoren für thrombotische Events wurden in dieser Gruppe eine rezente krebsspezifische Therapie, aktive Krebserkrankung, Tumortypen mit hohem thrombotischem Risiko sowie die intensivmedizinische Behandlung identifiziert.
Thrombosen bei COVID-19 nach Spitalsentlassung: Daten aus dem internationalen Northwell CORE-19 Registry zum Risiko venöser Thromboembolien im Zeitraum nach einer Entlassung von PatientInnen, die aufgrund von COVID-19 hospitalisiert waren, wurden von Dr. Dimitrios Giannis präsentiert. Bei den 4.100 PatientInnen, die für 90 Tage nach Entlassung beobachtet wurden, war das Risiko für venöse und arterielle Thromboembolien 2,4 % und 1,1 %, und das Risiko für schwere Blutungen betrug 1,6 %. Die beträchtliche beobachtete Mortalität (4,3 %) und Rate an Re-Hospitalisierungen (12,9 %) zeigen erneut eindrucksvoll den oft protrahierten und schwerwiegenden Verlauf von COVID-19 auf.
Prädiktion von Thrombosen bei COVID-19: Beobachtungsdaten legen nahe, dass D-Dimer zur Stratifizierung des Risikos für venöse Thromboembolien und damit als Marker für intensivierte Antikoagulationstherapie geeignet sein könnte.2, 3 Am ASH 2020 wurden nun von Dr. Hanny Al-Samkari Daten präsentiert, die zeigen, dass Prothrombin-Fragment 1.2 ein überlegener Marker zur Abschätzung des Thromboserisikos sein könnte. Die Ergebnisse prospektiver und insbesondere interventioneller, randomisiert-kontrollierter Studien zur Abklärung der optimalen Antikoagulationsstrategie bei PatientInnen mit COVID-19 werden aktuell weiterhin entsprechend gespannt erwartet.
Krebs und Thrombose
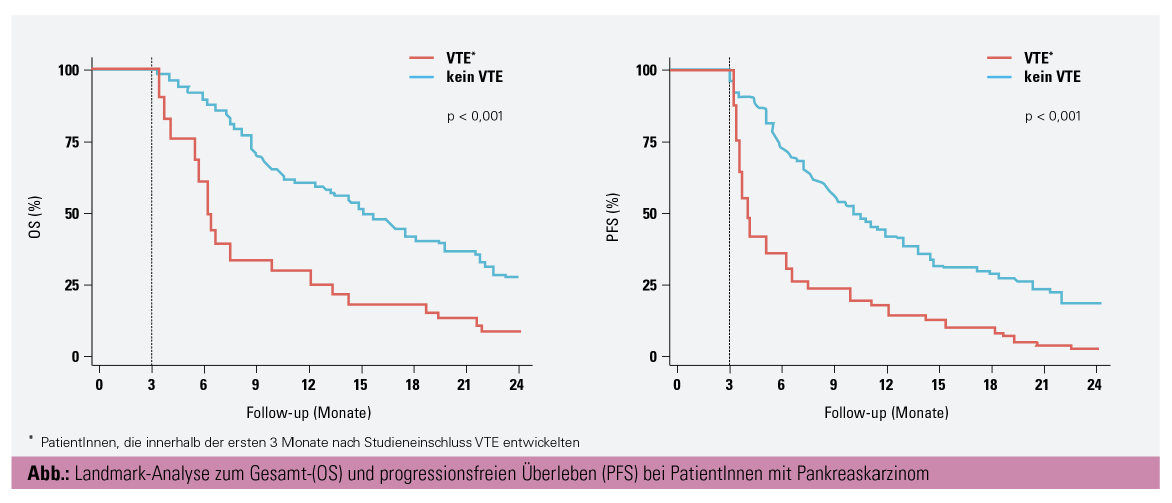
Gerinnungsparameter als prognostische und prädiktive Marker: Die Rolle des Blutgerinnungssystems in der Progression von Tumorerkrankungen ist aktuell einer der Schwerpunkte unserer Forschungsgruppe an der Abteilung für Hämatologie und Hämostaseologie der Medizinischen Universität Wien um Prof. Ingrid Pabinger und Prof. Cihan Ay. Neueste Ergebnisse dieser Forschung wurden bei einem Vortrag am ASH 2020 präsentiert. Das Pankreaskarzinom ist ein starker prothrombotischer Risikofaktor, mit dem Auftreten venöser Thromboembolien bei bis zu 20 % der PatientInnen.4 Weiters legen experimentelle Forschungsergebnisse nahe, dass die Aktivierung des Blutgerinnungssystems direkt durch tumorvermittelte Mechanismen verursacht wird und im Gegenzug das aktivierte Gerinnungssystem eine Reihe von Effekten auf den Tumor und sein Mikro-Milieu hat, welche protumorale Vorgänge wie Tumorwachstum, invasives Verhalten, Metastasierung und Immunevasion fördern.5 In den am ASH 2020 präsentierten Daten aus einer prospektiven Beobachtungsstudie wurde gezeigt, dass sich Biomarker des Blutgerinnungssystems dazu eignen, die Prognose und das Therapieansprechen von PatientInnen mit Pankreaskarzinomen abzuschätzen. Insbesondere höhere Werte von D-Dimer waren unabhängig von klinischen Charakteristika mit einer höheren Mortalität, einem höheren Risiko für Krankheitsprogression und einem niedrigeren Risiko für radiologisches Therapieansprechen während der Chemotherapie assoziiert. Weitere identifizierte unabhängige prognostische Marker für das Gesamtüberleben waren Plasminogen-Aktivator-Inhibitor Typ 1 (PAI-1) und lösliches P-Selektin. Zudem konnte gezeigt werden, dass das Auftreten einer venösen Thromboembolie eine Signalwirkung für kürzeres Überleben und Therapieversagen haben könnte, gekennzeichnet durch eine signifikant höhere Mortalität und ein erhöhten Risikos für eine Tumorprogression nach dem Auftreten thrombotischer Ereignisse. Die Gesamt- und progressionsfreie Überlebenszeit waren 5,5 und 3,0 Monate nach dem Auftreten von Thromboembolien, verglichen mit 13,4 und 7,5 Monaten bei PatientInnen ohne thrombotische Ereignisse (Abb.).
Relevantes Risiko für VTE unter Immuntherapie: Rezent publizierte Daten unserer Forschungsgruppe lieferten erste Hinweise auf ein signifikantes Risiko venöser sowie arterieller thrombotischer Ereignisse unter einer Therapie mit Immuncheckpoint-Inhibitoren.6 Diese Ereignisse hatten einen Einfluss auf die Prognose der PatientInnen, führten zu Therapieverzögerungen und -abbrüchen, und die Antikoagulationstherapie der venösen Thromboembolie war mit hohen Raten an Rezidiv-Thrombosen und Blutungsereignissen assoziiert. Gerade im Hinblick auf ein mögliches Langzeit-Therapieansprechen auf Immuncheckpoint-Inhibitoren ist die Erforschung dieser Komplikationen als sekundäre Ursachen von Mortalität und Morbidität ein wichtiger Aspekt. Am ASH 2020 konnten nun weitere Daten diese Beobachtungen stärken. Dr. Iris Yeong-Fung Sheng et al. präsentierten entsprechende Ergebnisse einer großen PatientInnenpopulation (n = 351) mit fortgeschrittenem Nierenzellkarzinom, die an der Cleveland Clinic, Ohio, behandelt wurden. Unter einer Therapie mit Immuncheckpoint-Inhibitoren wurde nach 6 Monaten ein Risiko für venöse Thromboembolien von 4,4 %, nach 12 Monaten von 9,8 % beobachtet. Arterielle Thromboembolien wurden bei 6 PatientInnen beobachtet (2 %). Das Auftreten venöser Thromboembolien führte bei einem Großteil der PatientInnen zu einer Hospitalisierung (72 %), bei 21 % zu Therapieverzögerungen für durchschnittlich 13 Tage sowie zu einer thrombosespezifischen Mortalität von 9 %. Weitere Untersuchungen zu einer besseren Charakterisierung dieser neu identifizierten Risikopopulation für thrombotische Ereignisse sollten folgen, um jene PatientInnen zu identifizieren, die von einer prophylaktischen Antikoagulation profitieren könnten.
Resümee
Neueste Forschungsergebnisse auf dem Gebiet der Hämostaseologie bilden seit jeher einen wichtigen Aspekt des jährlichen Kongresses der American Society of Hematology (ASH). Auch beim Kongress 2020 wurden eine Reihe spannender und relevanter neuer Erkenntnisse zum Thema Blutgerinnung und thrombotische Erkrankungen präsentiert. Der Kongress stand nicht nur organisatorisch als virtuell abgehaltenes Meeting ganz im Zeichen der aktuellen Corona-Pandemie, sondern auch auf Forschungsebene wurden zahlreiche Studien zur venösen Thromboembolie bei COVID-19-PatientInnen sowie zur SARS-CoV-2-induzierten Koagulopathie präsentiert. Darüber hinaus wurden einige neue Erkenntnisse zur Thrombose und zum Gerinnungssystem bei PatientInnen mit Krebserkrankungen vorgestellt.
- Klok FA et al., Thromb Res 2020; 191:148–150
- Thachil J et al., J Thromb Haemost 2020; 18(5):1023–1026
- Nopp S et al., Res Pract Thromb Haemost 2020; 4(7):1178–1191
- Mulder FI et al., Blood 2020; DOI: 10.1182/blood.2020007338
- Campello E et al., Br J Cancer 2019; 121(5):359–371
- Moik F et al., Blood 2020; DOI: 10.1182/blood.2020007878