Typ-1-Diabetes – Bestmögliche Nachbildung der physiologischen Sekretion
Nachdem im Jahr 1922 der erste Typ-1-Diabetiker mit tierischen Insulin behandelt worden war, wurden wenige Jahre später die ersten Verzögerungsinsuline (NPH-Insuline) entwickelt. Es dauerte dann noch bis in die 1980er-Jahre, bis menschliches Insulin („Normalinsulin“) gentechnologisch hergestellt werden konnte und den Patienten zur Verfügung stand. In dieser Zeit entwickelten sich auch die Grundlagen für eine möglichst physiologische Insulinsubstitution, wie sie auch heute noch „State of the Art“ ist. Wesentlichen Anteil daran hatte in dieser Zeit auch die Entwicklung von kleinen, mobilen Blutzuckermessgeräten, die es Patienten und Ärzten erst ermöglichten, rasch auf Blutzuckeränderungen zu reagieren.
Therapieziel ist die Reduktion von mikro- und makrovaskulären Spätschäden, welche im „Diabetes Control and Complications Trial“ (DCCT, N Engl J Med 1993) sowie in der „Epidemiology of Diabetes Interventions and Complications“-Studie (EDIC, N Engl J Med 2005) unter intensivierter Therapie erreicht werden konnte.
Physiologie der Insulinsekretion
Der Tagesinsulinbedarf eines normalgewichtigen Menschen variiert zwischen 0,3 IE und 1,0 IE pro kg Körpergewicht. Als Faustregel kann von ~ 40–50 IE Insulin pro Tag ausgegangen werden. Etwa die Hälfte davon entfällt auf die basale, also essensunabhängige Insulinsekretion (ca. 1 IE/h = ~24 IE pro Tag) (Waldhäusl, Diabetologia 1979 und 1986). In Bezug auf die aufgenommenen Kohlenhydrate hat sich im deutschsprachigen Raum der Begriff „Broteinheiten“ (1 BE = 12 g Kohlenhydrate) etabliert. Für jede Broteinheit werden zusätzlich ca. 1,5 IE Insulin sezerniert (K. Howorka: Funktionelle Insulintherapie, 4. Auflage 1996), wobei diese Zahl im Rahmen der Tagesrhythmik variiert (morgens am höchsten, gleichbedeutend mit dem höchsten Insulinbedarf in der Früh). Die Insulinsekretion für Fette und Proteine ist deutlich geringer und wird (mit wenigen Ausnahmen) in der Praxis vernachlässigt.
Für die meisten Patienten können diese Zahlen jedoch nicht direkt in die Therapieberechnungen übernommen werden: Patienten mit erhöhter Insulinresistenz haben einen meist deutlich höheren Insulinbedarf. Umgekehrt können eine körpereigene Restsekretion (bei nicht vollständiger Zerstörung der Betazellmasse) oder ein sportlicher Lebensstil den Insulinbedarf deutlich senken.
Therapieformen
Neben der bereits genannten Reduktion vaskulärer Ereignisse steht in den letzten Jahrzehnten zunehmend die Verbesserung der Lebensqualität der Patienten im Vordergrund. Es ist daher nötig, für jeden Patienten die individuell beste Therapieform zu finden:
Konventionelle Insulintherapie: Die konventionelle Therapie besteht in einer fixen Vorgabe sowohl der Insulindosis als der Uhrzeit und Größe der Kohlenhydratportionen („BE“). Als Insuline werden Mischinsuline (oder ein lang und ein kurz wirksames Insulin in fixer Dosis) gegeben. Diese Therapieform kann den Anspruch an eine möglichst physiologische (und somit auch flexible) Insulinsubstitution kaum erfüllen und kommt daher nur bei Typ-1-Diabetikern in Frage, die aufgrund von z. B. kognitiven Einschränkungen nicht in der Lage sind, eine intensivierte Therapie durchzuführen. Es soll jedoch auch erwähnt werden, dass es immer wieder Typ-1-Diabetiker gibt, die auch mit dieser Therapie sehr gute Blutzuckertagesprofile und HbA1c-Werte erreichen und die sich auch nach ausführlicher Aufklärung gegen eine funktionelle Insulintherapie entscheiden.
Konventionell-intensivierte Therapie: Bei dieser Therapieform werden neben der getrennten Gabe von Basis- und Essensinsulin auch Möglichkeiten zur Korrektur („Korrekturschema“) gegeben. In vielen Zentren wird diese Therapie bei der Erstmanifestation des Diabetes eingeleitet, bevor dann nach einigen Monaten eine Schulung in funktioneller Insulintherapie erfolgt.
Funktionelle Insulintherapie (FIT), Basis-Bolus-Insulintherapie (BBIT): Die FIT (BBIT) ermöglicht die individuelle Anpassung der Insulinsubstitution an den aktuellen Bedarf, abhängig von der vom Patienten gewählten Essensmenge und der körperlichen Aktivität. Als wesentlicher Vorteil dieser Therapie ist die weitgehende Flexibilität des Tagesablaufs und der Mahlzeiten zu sehen. Dies ist jedoch auch mit häufigen Blutzuckerselbstkontrollen und Insulinapplikationen pro Tag verbunden. Als Faustregel kann man von 5–8 Blutzuckermessungen und ebenso vielen Insulingaben pro Tag ausgehen. Entsprechende Schulung und engmaschige Betreuung in einer Spezialambulanz vorausgesetzt, können so ausgezeichnete HbA1c-Werte erreicht und gleichzeitig Hypoglykämien vermieden werden.
Prinzipien der FIT/BBIT
In Österreich erfolgt die Schulung zumeist im Rahmen eines (meist einwöchigen) stationären Aufenthalts oder eines Rehab-Aufenthalts. Dies ermöglicht Erfahrungsaustausch in der Gruppe sowie engmaschige (auch nächtliche) Blutzuckerkontrollen ohne Ablenkung.
Die Patienten lernen, das Insulin in „Basis“, „prandiales Insulin“ und „Korrekturinsulin“ zu trennen. Die „Basis“ besteht aus dem Verzögerungsinsulin (Basisinsulin) und wird je nach verwendetem Präparat 1- bis 2-mal täglich gespritzt. Zusätzlich kann eine mahlzeitenunabhängige morgendliche Gabe eines rasch wirkenden Insulins zum Ausgleich des erhöhten Insulinbedarfs in den Morgenstunden notwendig sein. Dieser „Morgengupf“ ist als Teil der Basis zu sehen. Wesentlicher Schulungsinhalt ist, dass die Basis auch an Fasttagen gespritzt werden muss, da ohne Basis bedingt durch den absoluten Insulinmangel eine ketoazidotische Entgleisung droht!
„Prandiales Insulin“ und „Korrekturinsulin” entsprechen zwar beide dem rasch wirksamen Insulin, sollten aber völlig voneinander getrennt berechnet werden. In der FIT (BBIT) sollte zu jeder Mahlzeit auch ein prandiales Insulin gespritzt werden (Broteinheiten x Essensfaktor). Zusätzlich wird ein erhöhter Blutzucker durch Korrekturen ausgeglichen: Als Zielwerte für Korrekturen werden üblicherweise nüchtern 100 mg/dl sowie postprandial 160 mg/dl (nach 1 Stunde) bzw. 120 mg/dl (nach 2 Stunden) angegeben, wobei diese Werte in den verschiedenen Zentren etwas variieren. Vor dem Zubettgehen haben sich bei hypoglykämiegefährdeten Patienten 120 mg/dl (anstatt 100 mg/dl) als Zielwert bewährt.
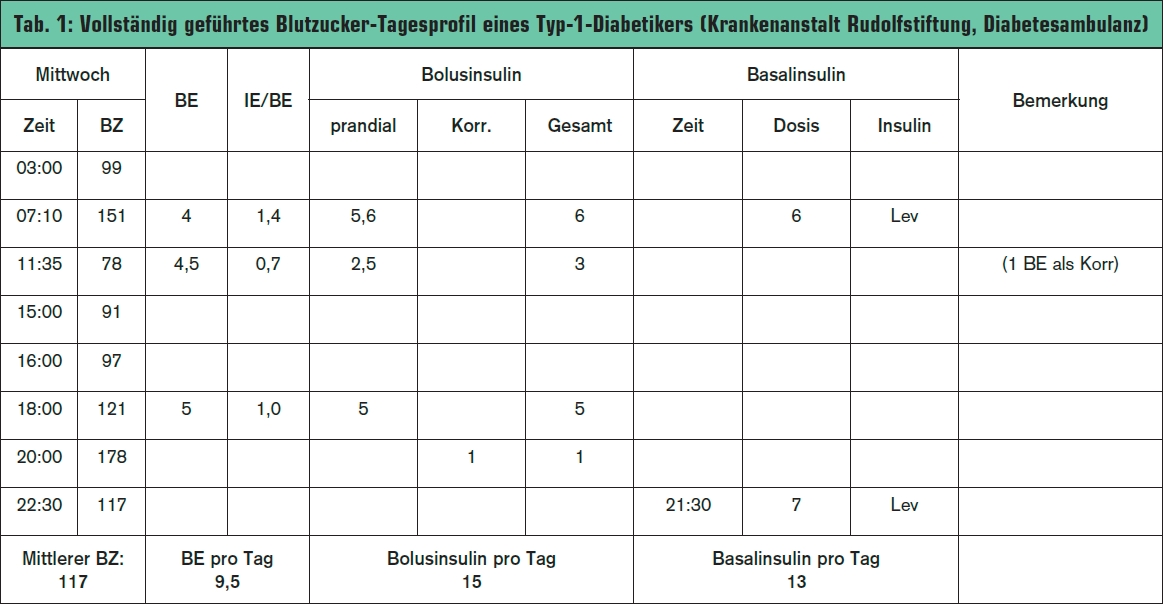
Die benötigte „Basis“ sowie die so genannten „Algorithmen“ für das prandiale Insulin (benötigte IE Insulin pro BE) und die Korrektur (Senkung der Blutglukose pro Einheit Insulin) können rechnerisch nach den oben genannten physiologischen Grundlagen sowie aus der bisher benötigten durchschnittlichen täglichen Insulinmenge errechnet werden. Detaillierte Blutzuckerprotokolle (inklusive Aufzeichnungen über Insulin und Broteinheiten) über mehrere Wochen sind die Voraussetzung (Tab. 1). Zusätzlich werden in einigen Zentren empirisch ermittelte Nomogramme (K. Howorka: Funktionelle Insulintherapie, 4. Auflage 1996) verwendet, welche auch die bisherige Güte der Einstellung (durchschnittliche Blutglukose) berücksichtigen. In weiterer Folge werden die Algorithmen dann individuell angepasst.
Pumpentherapie
Bei der Insulinpumpentherapie (Continuous Subcutaneous Insulin Infusion – CSII) wird über eine externe Arzneimittelpumpe kurz wirksames Insulin über eine subkutan liegende Kanüle kontinuierlich verabreicht. Im Wesentlichen entspricht die Pumpentherapie der FIT (BBIT), wobei jedoch die „Basis“ frei programmierbar kontinuierlich abgegeben wird und somit das Verzögerungsinsulin ersetzt. Prandiales Insulin und Korrekturinsulin werden vom Patienten per Knopfdruck appliziert. Wesentlicher Vorteil dieser Therapie ist die Möglichkeit der stundengenauen Anpassung der Basalrate an den individuellen physiologischen Bedarf. Zwei Metaanalysen (Pickup, BMJ 2002; Jeitler et al., Diabetologia 2008) bestätigen ein
e verbesserte glykämische Kontrolle bei gleichzeitig reduziertem Insulinverbrauch und geringerer Frequenz schwerer Hypoglykämien.
Neuere Pumpenmodelle ermöglichen in Kombination mit subkutanen Glukose-Sensoren bereits eine gewisse „Rückkoppelung“, um auf diese Weise z. B. nächtliche Hypoglykämien zu vermeiden. Wirkliche „Closed Loop“-Systeme (also eine vollautomatische Glukosemessung und Insulinapplikation) sind jedoch für den klinischen Alltag noch nicht verfügbar.
Verfügbare Insuline
In Österreich sind heute ausschließlich gentechnologisch hergestellte humane Insuline bzw. Insulinanaloga mit veränderter Kinetik erhältlich. Eine Applikation mittels Insulinpen oder Insulinpumpe ist heute Standard, Injektionsspritzen werden nur mehr in Ausnahmefällen verwendet.
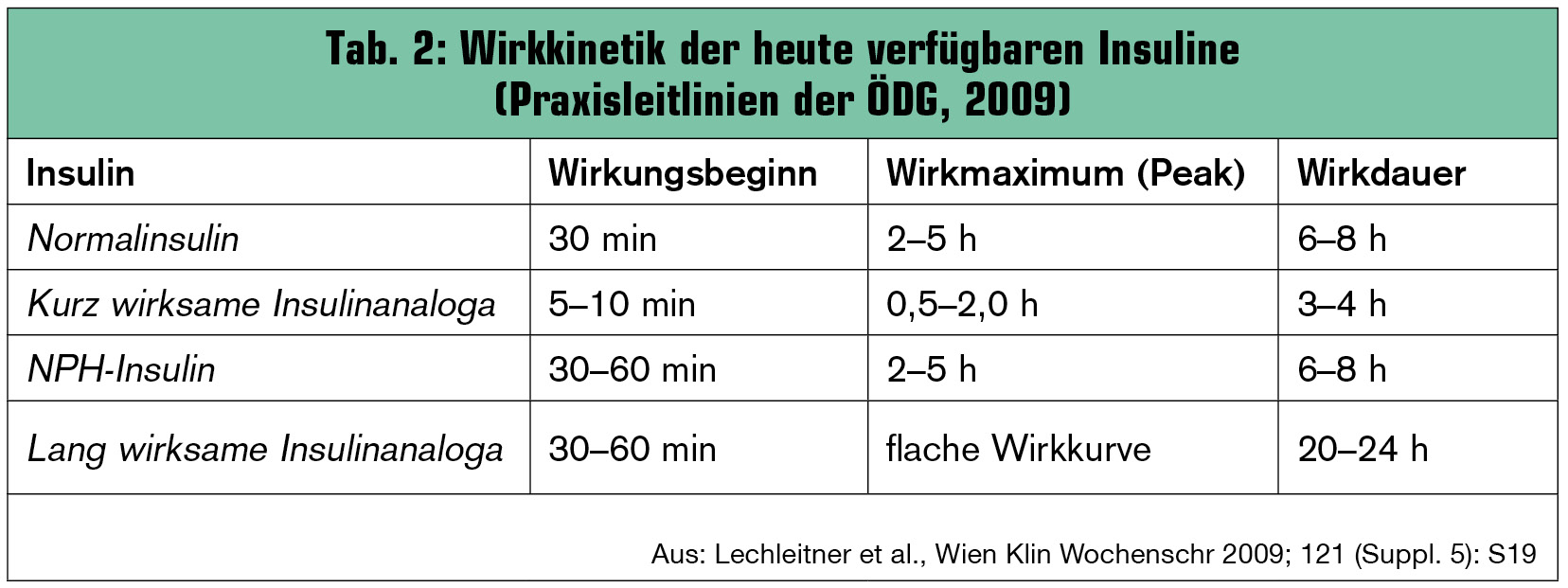
Im Bemühen, die Wirkprofile der Humaninsuline noch besser an die Physiologie anzupassen, wurden seit den 1990er-Jahren Insuline mit veränderter Aminosäuresequenz und damit geänderter Pharmakodynamik entwickelt (Tab. 2).
Rasch wirksame Insulinanaloga („ultrakurz wirksame Insuline“) weisen einen rascheren 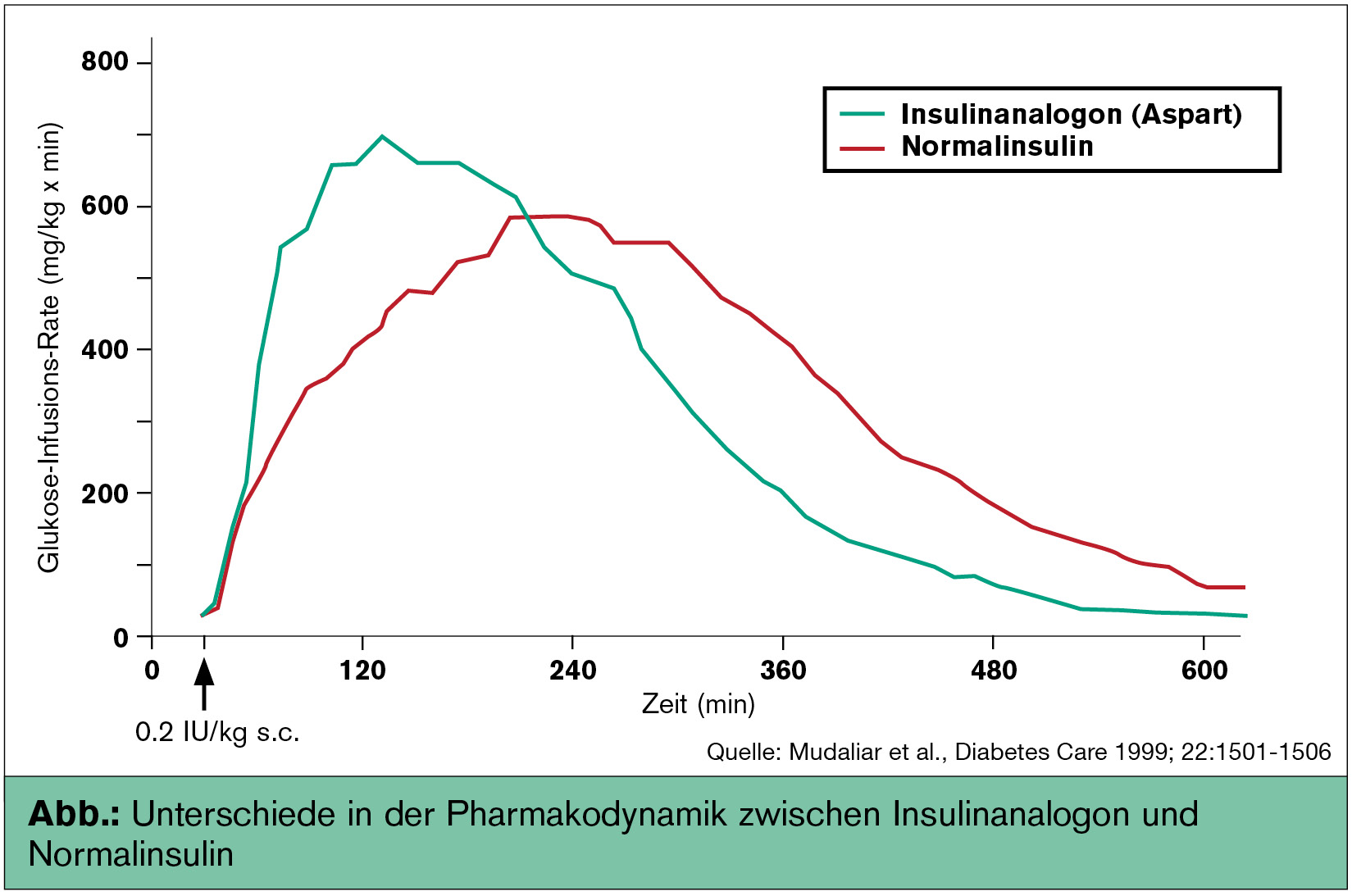 Wirkeintritt nach Applikation sowie eine kürzere Wirkdauer auf, sodass kein Spritz-ess-Abstand mehr nötig ist (Abb.). Dies trägt für viele Patienten zu einer besseren Lebensqualität bei. Zusätzlich können niedrigere postprandiale Glukosekonzentrationen erreicht werden, während postprandiale und nächtliche Hypoglykämien reduziert werden (Home et al., Diabet Med 2000; Raskin et al., Diabetes Care 2000). Auch die Anwendungssicherheit bei (Vorschul)-Kindern (Danne et al., Pediatric Diabetes 2007) und Schwangeren (Mathiesen et al., Diabetes Care 2007) konnte gezeigt werden. Die rasch wirksamen Insulinanaloga werden als Präparate der „Grünen Box“ problemlos erstattet.
Wirkeintritt nach Applikation sowie eine kürzere Wirkdauer auf, sodass kein Spritz-ess-Abstand mehr nötig ist (Abb.). Dies trägt für viele Patienten zu einer besseren Lebensqualität bei. Zusätzlich können niedrigere postprandiale Glukosekonzentrationen erreicht werden, während postprandiale und nächtliche Hypoglykämien reduziert werden (Home et al., Diabet Med 2000; Raskin et al., Diabetes Care 2000). Auch die Anwendungssicherheit bei (Vorschul)-Kindern (Danne et al., Pediatric Diabetes 2007) und Schwangeren (Mathiesen et al., Diabetes Care 2007) konnte gezeigt werden. Die rasch wirksamen Insulinanaloga werden als Präparate der „Grünen Box“ problemlos erstattet.
Lang wirksame Insulinanaloga weisen eine flachere Wirkkurve, geringere intraindividuelle Schwankungen und eine deutlich längere Wirkdauer (Insulin glargin: > 24 Stunden; Insulin detemir: ~16–20 Stunden) auf als NPH-Insuline (Porcellati et al., Diabetes Care 2007). Dadurch können geringere Blutzuckerschwankungen und weniger nächtlichen Hypoglykämien erreicht werden (Ratner et al., Diabetes Care 2000; Vague et al., Diabetes Care 2003). Zudem ist bei vielen Patienten eine 1-mal tägliche Gabe (vor allem bei Insulin glargin) ausreichend. Beide Präparate werden in Österreich nach chefärztlicher Bewilligung nur bei dokumentierten wiederholten, nächtlichen Hypoglykämien erstattet.
Ausblick
Weitere Insuline sind in Entwicklung, insbesondere im Bereich der lang wirksamen Insulinanaloga: Als Beispiel kann Insulin deglutec genannt werden, ein Insulin mit flachem Wirkprofil und einer Wirkdauer von > 40 Stunden, welches bereits erfolgreich in klinischen Studien eingesetzt wird.
Blickt man auf die relativ kurze Zeit der Insulinentwicklung und die in 90 Jahren erreichten Erfolge zurück, so darf vermutet werden, dass die weitere Zukunft noch viele spannende Neuentwicklungen und Verbesserungen für die Therapie des Typ-1-Diabetes bringen wird.