Aus der Sicht des Radiologen
Die Einführung der endovaskulären Techniken zur Behandlung von Aortenaneurysmen zu Beginn der 1990er-Jahre sorgte für großes Aufsehen und zog einen regelrechten Boom nach sich. Das abdominelle Aortenaneurysma (AAA) ist klassischerweise eine Erkrankung des höheren Lebensalters. Kommt es zu einer Ruptur, beträgt die Mortalität trotz Notfalleingriff 50 %. In der elektiven Situation konnte die Mortalität auf unter 3 % reduziert werden. Das jährliche Rupturrisiko beträgt 0,3 % für AAA ≤ 3,9 cm, 1,5 % für AAA mit 4–4,9 cm und 6,5 % für AAA mit 5–5,9 cm. Frauen dürften ein höheres Rupturrisiko haben als Männer. Aufgrund der erhöhten Rupturgefahr stellen asymptomatische AAA ab 5,5 cm und symptomatische AAA immer dann, wenn es der Allgemeinzustand des Patienten erlaubt, eine Indikation zur Sanierung dar (offene OP vs. endovaskuläre Technik). Mehr als 50 % der AAA verlaufen asymptomatisch und stellen einen Zufallsbefund bei routinemäßigen Sonografien des Abdomens dar – auch zur Verlaufsbeobachtung ist der Ultraschall gut geeignet.
Vor jeder Intervention wird eine CT-Untersuchung der Aorta in Dünnschnitttechnik durchgeführt. MR-Untersuchungen sind für exakte Vermessungen, wie sie für die endovaskuläre Therapie notwendig sind, weniger geeignet.
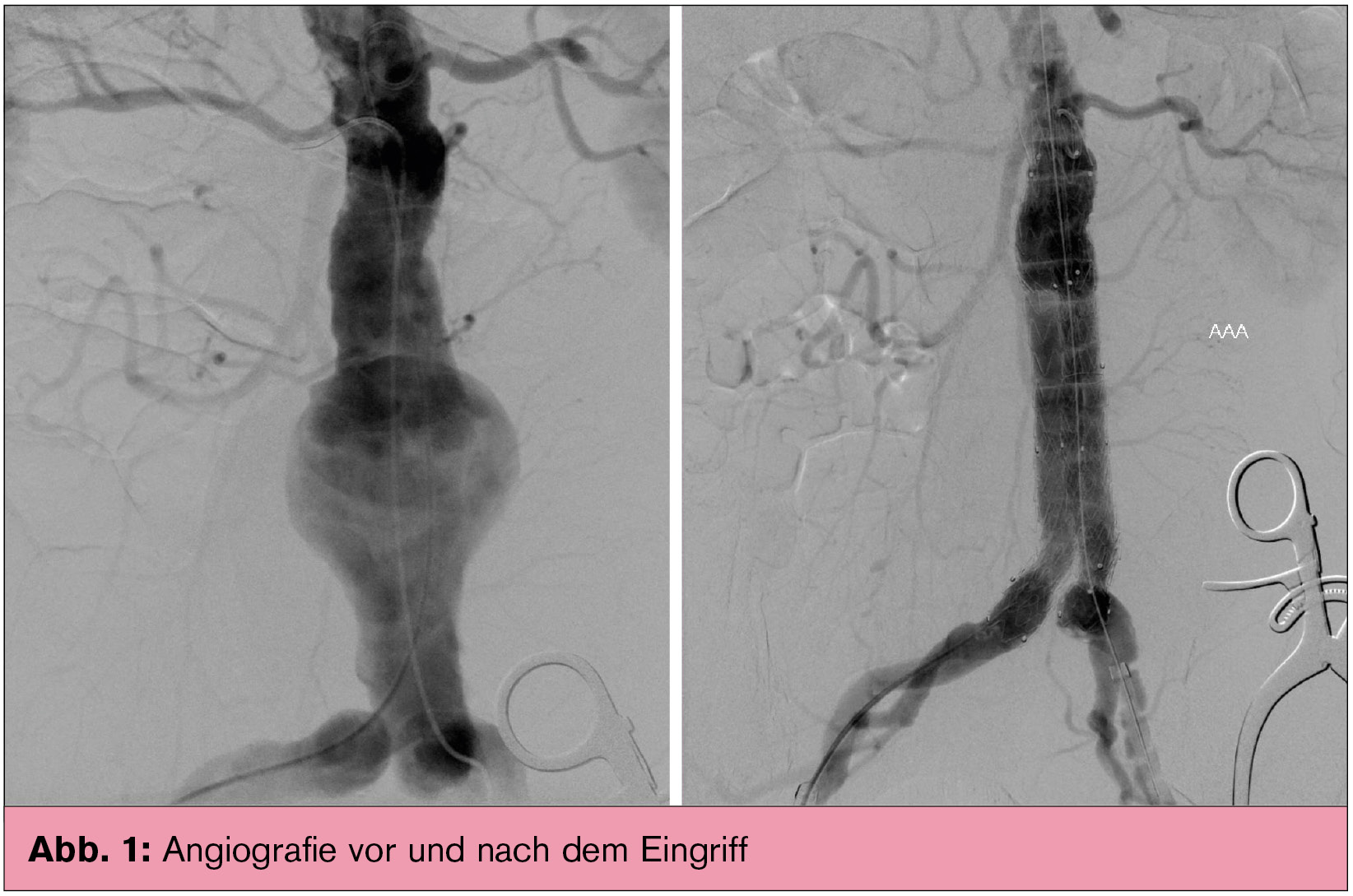
Die endovaskuläre Schienung der infrarenalen Bauchaortenaneurysmen hat sich in den letzten Jahren zu einem Standardverfahren (Abb. 1) entwickelt. Erstmals wurde diese Technik von Parodi, einem argentinischen Chirurgen, 1991 beschrieben. Seit dieser Zeit gab es enorme Fortschritte bei den Prothesenmaterialien, auch die Technik der Implantation hat sich verfeinert. Einige Studien (EVAR I, DREAM, EVAR II, OVER) belegen die Effektivität und deutlich geringere perioperative Mortalität (1,6 % vs. 4,6 %) im Vergleich zum offenen Verfahren. Sekundäre Interventionen sind bei der endovaskulären Methode erhöht (9,8 % vs. 5,8 %). Die Krankenhausverweildauer ist bei den „gestenteten“ Patienten deutlich kürzer (3 vs. 7 Tage). Auch rupturierte AAA lassen sich mittels Endoprothesen versorgen, wobei in „Gefäß-Zentren“ so genannte Notfallprothesen (aortouniiliakal mit Verschluss der kontralateralen A. iliaca und Crossover-Bypass) zum Einsatz kommen. Die Eingriffe selbst werden entweder in Lokalanästhesie oder in Allgemeinnarkose durchgeführt. Prinzipiell lassen sich die Eingriffe auch rein perkutan durchführen, aufgrund der Größe der einzuführenden Kathetersysteme bevorzugen die meisten Interventionalisten einen offenen chirurgischen Zugang der Leistenarterien.
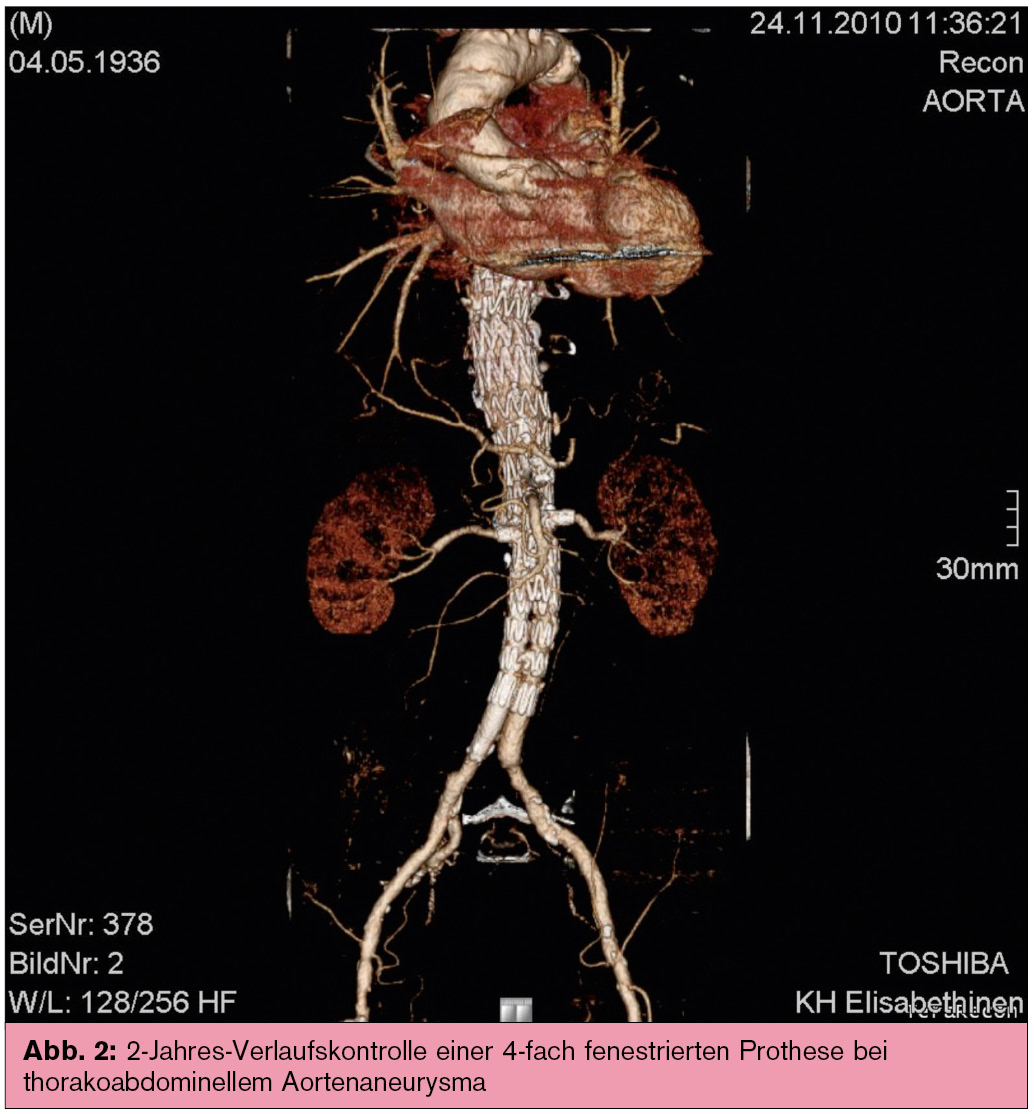
Schienung von komplexen Aortenaneurysmen: War die Methode vorerst auf den infrarenalen Abschnitt der Bauchaorta beschränkt, stehen uns seit einigen Jahren auch Möglichkeiten zur Schienung von komplexen Aortenaneurysmen zur Verfügung, welche den Bereich der Abgänge der Nierenarterien, der A. mesenterica sup., des Truncus coeliacus oder auch der Abgänge von A. iliaca int. betreffen (Abb. 2). Diese z. T. mehrfach fenestrierten oder „gebranchten“ Prothesen erfordern eine exakte Planung mittels spezieller Softwareprogramme. Die Implantation stellt ebenfalls eine Herausforderung an das Interventionalistenteam dar. Die Ergebnisse dieser Eingriffe zeigen im Vergleich zu den offenen Eingriffen eine deutliche Reduktion der perioperativen Morbidität und Mortalität. In erfahrenen „Gefäßzentren“ lassen sich mittlerweile über 80 % der therapiepflichtigen Bauchaortenaneurysmen endovaskulär versorgen.
FACT-BOX
Die endovaskuläre Versorgung von infrarenalen Aortenaneurysmen hat als Therapieoption neben der klassischen offenen Operation mittlerweile einen festen Stellenwert.
Neben der durch klinische Studien belegten Standardtherapie mittels „einfacher“ endovaskulär eingebrachter Bifurkationsprothesen kommen in „Gefäßzentren“ auch komplexe gefensterte und „gebranchte“ Prothesen zum Einsatz.
Die exakte radiologische Aufarbeitung der präinterventionellen Schnittbilduntersuchungen zur Indikationsstellung und Eingriffsplanung sowie die exakte Vermessung der Gefäße sind Voraussetzungen für einen erfolgreichen Eingriff.