Medikamentöse Therapie des Urothelkarzinoms
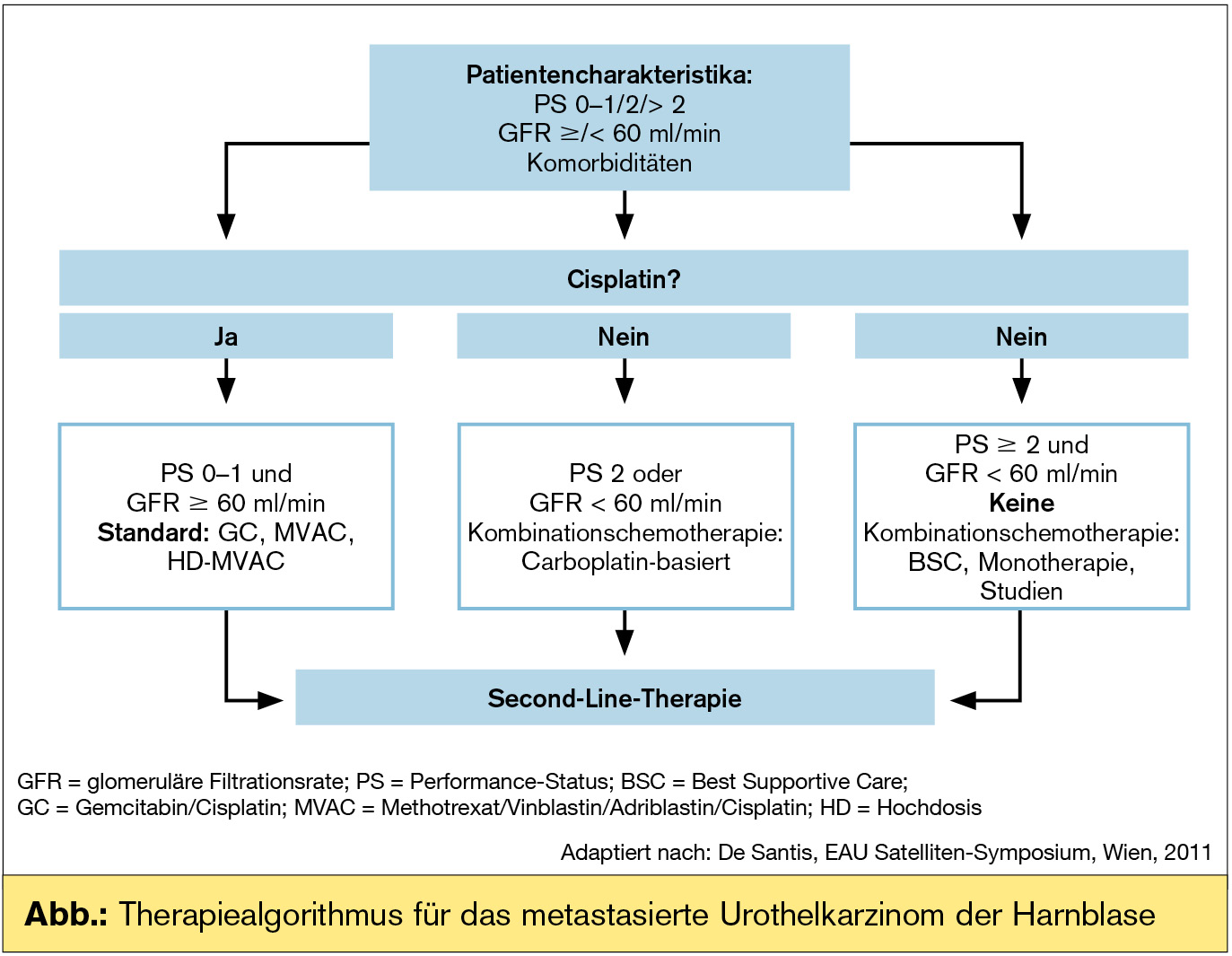
Das metastasierte Urothelkarzinom ist ein chemosensitiver Tumor. Die cisplatinhältige Kombinationschemotherapie ist der Standard. Für etwa 50 % der Patienten, die „nicht fit“ für Cisplatin sind, hat sich noch keine Standardtherapie etablieren lassen. In einer großen randomisierten Phase-III-Studie bei Cisplatin-ungeeigneten Patienten wurde Gemcitabin/Carboplatin (GC) gegen die Kombination Carboplatin/Vinblastin/Methotrexat (M-CAVI) geprüft und konnte ein medianes Gesamtüberleben von etwa 9 Monaten erreichen. Gemcitabin/Carboplatin (GC) wird aufgrund des Nebenwirkungsprofils favorisiert.
Erstlinienchemotherapie: der Standard ist Cisplatin-basiert
MVAC und GC: In einer internationalen randomisierten Phase-III-Studie wurde die Kombination Gemcitabin/Cisplatin (GC) mit MVAC (Methotrexat, Vinblastin, Adriamycin und Cisplatin) verglichen. Beide Arme zeigten ähnliche objektive Ansprechraten (GC 49 %, MVAC 46 %) und ein vergleichbares medianes Überleben (GC 14 Monate, MVAC 15,2 Monate) (von der Maase et al. 2000). GC wies jedoch ein deutlich besseres Toxizitätsprofil auf. Obwohl ursprünglich nicht als Äquivalenzstudie ausgelegt, gilt GC seither als Therapiealternative zu MVAC und wurde in vielen Ländern Standard für Patienten mit lokal fortgeschrittenem oder metastasiertem Harnblasenkarzinom.
Was bringt die Dosisintensivierung? Hochdosis-(HD)-MVAC plus GCSF wurde in einer großen randomisierten Phase-III-Studie der EORTC mit klassischem MVAC verglichen (Sternberg et al., 2001; Sternberg et al., 2006). Für den Hochdosis-Arm wurde kein signifikanter Vorteil bezüglich des Gesamtüberlebens demonstriert. Es gab jedoch Vorteile bezüglich der Dosisintensität (Applikation doppelter Dosen Adriamycin und Cisplatin in der Hälfte der Zeit), der Toxizität, des progressionsfreien Überlebens, der objektiven Ansprechrate inklusive kompletter Remissionen (CR) und für die Subgruppe der CR ein signifikant längeres progressionsfreies Überleben (PFS).
In einer ganz rezenten Publikation wurde Paclitaxel/Cisplatin/Gemcitabin (PCG) gegen Gemcitabin/Cisplatin (GC) studiert (Bellmunt et al., 2012). Die Dreierkombination PCG induzierte im Vergleich mit GC eine höhere Gesamtremissionsrate (56 % vs. 44 %; p = 0,0031), verlängerte das mediane Gesamtüberleben aber nur tendenziell (15,8 vs. 12,7 Monate; Hazard-Ratio = 0,85, p = 0,075). Signifikant besser war PCG in den Subgruppen der „eligiblen“ Patienten und jener, die den Primärtumor in der Harnblase hatten. Obwohl diese Untergruppenergebnisse nicht der erste Endpunkt der Studie waren, kann PCG als eine mögliche weitere Chemotherapieoption in der Behandlung des Urothelkarzinoms angesehen werden. Die Hinzugabe von Paclitaxel verursachte wenig zusätzliche Toxizität: Grad-4-Neutropenie (35,8 % vs. 20 % für PCG vs. GC) und febrile Neutropenie (13,2 % vs. 4,3 % für PCG vs. GC) und eine höhere GCSF-Rate (17 % vs. 11 % für PCG vs. GC).
GC verursachte öfter als PCG Thrombopenie Grad 4 und thrombopenische Blutungen (11,4 % vs. 6,8 %). Insgesamt gab es unter der Dreierkombination etwas häufiger schwere Toxizitäten mit 20,2 % vs. 14,8 %.
„Nicht fit“ für Cisplatin?
Mehr als 50 % der Patienten mit metastasiertem Urothelkarzinom der Harnblase fallen in diese Kategorie. Die Definition für „fit“ oder „nicht fit“ für Cisplatin ist international kontrovers (für rezent publizierte Kriterien vgl. Tab.).
Chemotherapie für „nichtfitte“ Patienten: Die erste und bislang einzige randomisierte Phase-II/III-Studie zur Chemotherapie von „nichtfitten“ Patienten mit fortgeschrittenem Harnblasenkarzinom wurde von der EORTC initiiert (De Santis et al., 2009). Es liegen nun erstmals prospektiv-randomisierte Phase-III-Daten für die Erstlinientherapie dieser wichtigen Patientengruppe vor. Die Studie verglich zwei Carboplatin-hältige Chemotherapie-Regime (Carboplatin/Gemcitabin [CG] und Methotrexat/Carboplatin/Vinblastin [M-CAVI]). Cisplatin-„nicht-fitte“ Patienten wurden von der EORTC über den Performance Score (WHO PS ≥ 2) und/oder die Nierenfunktion (GFR ≤ 60 ml/min) definiert.
Zwischen 2001 und 2008 wurden an 12 verschiedenen Zentren 238 Patienten rekrutiert. Im CG-Arm lag die objektive Gesamtansprechrate (Overall Response Rate – ORR) bei 41,2 %, im M-CAVI-Arm bei 30,3 % (p = 0,08). Das mediane progressionsfreie Überleben lag im CG-Arm bei 5,8 Monaten, im M-CAVI-Arm bei 4,2 Monaten. Das mediane Gesamtüberleben im CG-Arm betrug 9,3 Monate, jenes im M-CAVI-Arm 8,1 Monate (p = 0,64). Die Toxizitätsrate von M-CAVI lag etwas höher als jene von CG (De Santis et al., 2012).
Obwohl das erhoffte mediane Gesamtüberleben von 13,5 Monaten im CG-Arm bei weitem nicht erreicht wurde, ist damit die Kombination Carboplatin/Gemcitabin die am besten dokumentierte Erstlinientherapie bei Patienten, die für Cisplatin-hältige Chemotherapie nicht in Frage kommen, und gilt als Therapiestandard in dieser Patientengruppe und als Referenztherapie für weitere klinische Studien.
Zweitlinientherapie – Vinflunin
Bis vor Kurzem gab es keine etablierte Standardtherapie für vorbehandelte Patienten mit Urothelkarzinom. Eine randomisierte Phase-III-Studie beim Urothelkarzinom in der Indikation „Chemotherapie nach Platinversagen“ wurde kürzlich publiziert. Vinflunin, ein neuartiges Vincaalkaloid, und Best Supportive Care (BSC) zeigten in einer randomisierten Phase-III-Studie einen signifikanten klinischen Benefit und eine 22%ige Reduktion des Risikos zu versterben (2,6 Monate Lebensverlängerung in der „eligiblen“ Population). Darüber hinaus wurden Lebensqualität erhalten und Beschwerden gelindert, und das bei nur mäßiger Toxizität.
Vinflunin hat damit unser Behandlungsarmamentarium für Patienten, die nach Cisplatin-hältiger Kombinationschemotherapie progredient sind, entscheidend erweitert. Vinflunin gilt als neuer Therapiestandard für die Zweitlinienchemotherapie.
#Fact-Box_Titel