Diabetische Nephropathie – Aktuelle Aspekte
Progressionsfaktoren
 Die Albuminurie als Progressionsfaktor der chronischen (diabetischen) Niereninsuffizienz und ihre Bekämpfung/Reduktion oder Vermeidung als Strategie zur Erhaltung der Nierenfunktion sind lange bekannte Paradigmen in der Nephrologie. In den letzten Jahrzehnten haben sich vielfache Beweise für die nephroprotektiven Effekte der Blutdrucksenkung an sich bzw. für die Verwendung von Substanzen der RAS-Blockade wie ACEHemmer (Angiotensin-converting Enzyme) oder Angiotensinrezeptor-Typ-1-Blocker und guter Stoffwechseleinstellung mit zum Teil recht ehrgeizigen Zielen gezeigt.2 Allerdings gab es auch „Draw-backs“ in manchen Studien, wo bei allzu strenger Blutzuckereinstellung vorteilhafte renale Effekte beobachtet wurden, aber das kardiovaskuläre Risiko sogar anstieg (ACCORD, UKPDS, VADT: besonders bei älteren Patienten mit kardiovaskulärer Vorerkrankung und schlechter Voreinstellung) 3 bzw. eine besonders starke Blutdrucksenkung in der ADVANCE-BP-Studie von 120/80 mmHg vs. 130/80 mmHg keinen zusätzlichen Benefit erbrachte.4
Die Albuminurie als Progressionsfaktor der chronischen (diabetischen) Niereninsuffizienz und ihre Bekämpfung/Reduktion oder Vermeidung als Strategie zur Erhaltung der Nierenfunktion sind lange bekannte Paradigmen in der Nephrologie. In den letzten Jahrzehnten haben sich vielfache Beweise für die nephroprotektiven Effekte der Blutdrucksenkung an sich bzw. für die Verwendung von Substanzen der RAS-Blockade wie ACEHemmer (Angiotensin-converting Enzyme) oder Angiotensinrezeptor-Typ-1-Blocker und guter Stoffwechseleinstellung mit zum Teil recht ehrgeizigen Zielen gezeigt.2 Allerdings gab es auch „Draw-backs“ in manchen Studien, wo bei allzu strenger Blutzuckereinstellung vorteilhafte renale Effekte beobachtet wurden, aber das kardiovaskuläre Risiko sogar anstieg (ACCORD, UKPDS, VADT: besonders bei älteren Patienten mit kardiovaskulärer Vorerkrankung und schlechter Voreinstellung) 3 bzw. eine besonders starke Blutdrucksenkung in der ADVANCE-BP-Studie von 120/80 mmHg vs. 130/80 mmHg keinen zusätzlichen Benefit erbrachte.4
Ein weiteres erfolgversprechendes Konzept in der Erweiterung der RAS-Blockade war die direkte Reninhemmung mit Aliskiren. In einer der ersten Studien (AVOID) zeigte Aliskiren als zusätzliches Antihypertensivum zu Losartan einen additiven Effekt in der Albuminuriesenkung unabhängig von der Blutdrucksenkung. 5 Vorerst enttäuschend ergab die erste Auswertung der ALTITUDE-Studie (Aliskiren als Add-on-Therapie zur RAS-Blockade bei Typ-2-Diabetes) ein geringgradig schlechteres renales und kardiovaskuläres Outcome und häufigere Nebenwirkungen unter Aliskiren und führte zur Beendigung der Studie. Hier muss jedoch bedacht werden, dass das Studiendesign ausdrücklich die mehrfache RAAS-Blockade vorausgesetzt hat.6 Als vorläufige Konsequenz sollte man die Kombina – tion von Aliskiren mit ACE-Hemmern oder Angiotensinrezeptorblockern (ARBs) vermeiden.
Die Studien der letzten Jahre haben vermehrt die unabhängige Existenz der Risikofaktoren Albuminurie und eingeschränkte glomeruläre Filtrationsrate (GFR) für kardiale und renale Ereignisse bei Typ-2-Diabetes gezeigt (ADVANCE).7 Astor beschrieb in der NHANES-Studie einen deutlichen Anstieg des kardiovaskulären (CV) Risikos mit Abnahme der GFR und innerhalb eines Stadiums der chronischen Niereninsuffizienz (CNI) eine signifikante Assoziation des CV-Risikos mit zunehmender Albumin-Kreatinin-Ratio (ACR).8 Daher ist es in der Praxis wesentlich und auch die offizielle Empfehlung der American Diabetes Association (ADA) 2012, bei allen DiabetikerInnen sowohl die eGFR („estimated“ GFR) als auch die ACR zumindest jährlich zu erfassen (bei GFR 45–60 ml/min halbjährlich, bei GFR 30–44 ml/min 3-monatlich). 9
Orale Antidiabetika
Mit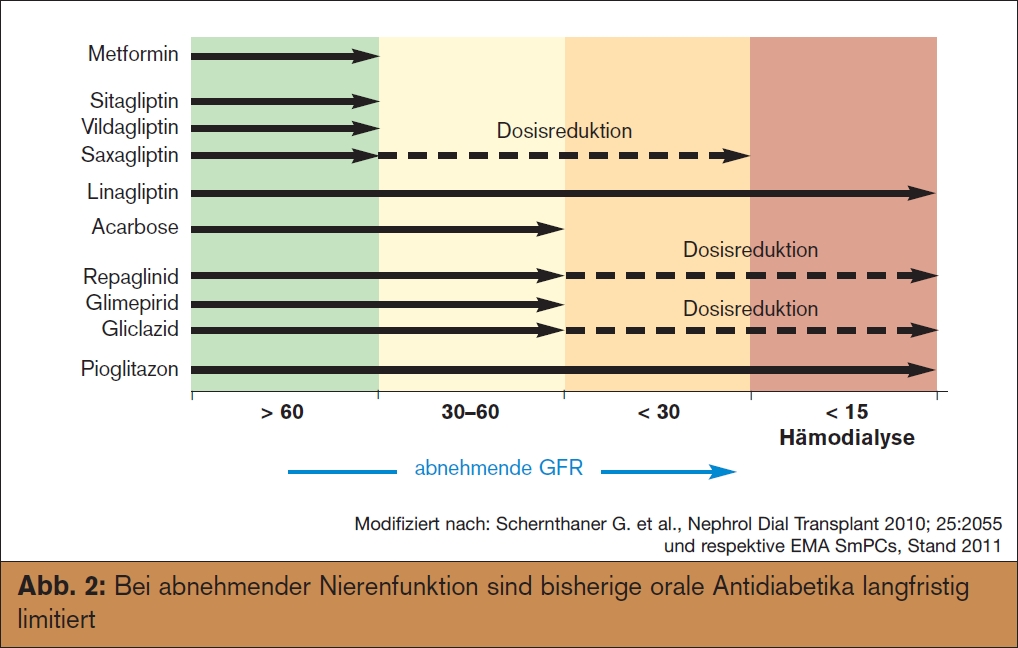 abnehmender Nierenfunktion und geringerer Insulinclearance wird zwar die Stoffwechseleinstellung meist besser, allerdings auch die Frage der noch möglichen therapeutischen Substanzen schwieriger (eine Übersicht über die Eignung oraler Antidiabetika abhängig von der Nierenfunktion > Abb. 2). Die meisten Sulfonylharnstoffe (außer Gliquidon) werden renal eliminiert und daher steigt mit sinkender Nierenfunktion die Hypoglykämiegefahr. Metformin ist zurzeit ab einer Clearance von 50 ml/min kontraindiziert (obwohl die Gefahr einer Laktazidose wahrscheinlich weit geringer als allgemein befürchtet ist) und somit auch nur limitiert einsetzbar. Neben Pioglitazon, welches bis incl. Dialysestadium verwendbar ist (unter Beachtung der allgemeinen Kontraindikationen wie Herzinsuffizienz, Hämaturie etc.), sind in letzter Zeit erfreulicherweise die Zulassungen der gut verträglichen DPP-4-Inhibitoren erweitert und somit Linagliptin (hepatale Elimination, keine Dosisreduktion notwendig) bis incl. Stadium 5 und Saxagliptin bis Stadium 5 (in reduzierter Dosis) verfügbar. Andere DPP-4-Hemmer, die derzeit nur bis 50 ml/min eGFR zugelassen sind (Sita- und Vildagliptin) könnten in nächster Zeit mit reduzierter Dosis vielleicht auch in Österreich zugelassen und erstattet werden.
abnehmender Nierenfunktion und geringerer Insulinclearance wird zwar die Stoffwechseleinstellung meist besser, allerdings auch die Frage der noch möglichen therapeutischen Substanzen schwieriger (eine Übersicht über die Eignung oraler Antidiabetika abhängig von der Nierenfunktion > Abb. 2). Die meisten Sulfonylharnstoffe (außer Gliquidon) werden renal eliminiert und daher steigt mit sinkender Nierenfunktion die Hypoglykämiegefahr. Metformin ist zurzeit ab einer Clearance von 50 ml/min kontraindiziert (obwohl die Gefahr einer Laktazidose wahrscheinlich weit geringer als allgemein befürchtet ist) und somit auch nur limitiert einsetzbar. Neben Pioglitazon, welches bis incl. Dialysestadium verwendbar ist (unter Beachtung der allgemeinen Kontraindikationen wie Herzinsuffizienz, Hämaturie etc.), sind in letzter Zeit erfreulicherweise die Zulassungen der gut verträglichen DPP-4-Inhibitoren erweitert und somit Linagliptin (hepatale Elimination, keine Dosisreduktion notwendig) bis incl. Stadium 5 und Saxagliptin bis Stadium 5 (in reduzierter Dosis) verfügbar. Andere DPP-4-Hemmer, die derzeit nur bis 50 ml/min eGFR zugelassen sind (Sita- und Vildagliptin) könnten in nächster Zeit mit reduzierter Dosis vielleicht auch in Österreich zugelassen und erstattet werden.
Subkutane Antidiabetika
Die derzeit verfügbaren GLP-1-Analoga sind bis zu einer eGFR von 60 ml/min (Liraglutid) bzw. in reduzierter Dosis bis 30 ml/min (Exenatide) zu verwenden. Entscheidend für die Insulintherapie (welche bei jeder Nierenfunktionsstörung möglich ist) bleibt die Reduktion der Insulinmenge bei fortgeschrittenen Stadien der chronischen Niereninsuffizienz, oft auf bis zu 50 % der ursprünglichen Dosis.10
Hypoglykämierisiko
Obwohl die Niereninsuffizienz auch blutzu – ckersteigernde Effekte hat (gesteigerte Insulinresistenz, verminderte Vitamin-D-abhän – gige Insulinproduktion, Glukosezufuhr durch Dialysat), überwiegen doch die blutzuckersenkenden Effekte der fortgeschrittenen Niereninsuffizienz (Inappetenz, geringere renale Insulinclearance, geringere renale Glukoneogenese) und damit auch die Hypoglykämiegefahr bei Nichtanpassung der Therapie.11 Da die Hypoglykämie (vor allem bei älteren PatientInnen) nicht nur eine unmittelbare neurologische und traumatologische Gefahr darstellt, sondern absolut ernstzunehmende und z. T. lebensbedrohende kardiale Folgen haben kann, sollte das Bewusstsein und die Vermeidung von Hypoglykämien ein mindes – tens ebenso wichtiges Therapieziel sein.
HbA1c
Obwohl die HbA1c-Bestimmung zum Standard der Diabetestherapie geworden ist und eine unverzichtbare Messvariable in fast allen Outcome-Studien darstellt, sehen wir in der Nephrologie doch beträchtliche Einschränkungen in der Aussagekraft dieses etablierten Markers. Neben der vollkommenen Vernachlässigung der Erfassung der Blutzucker-(BZ)-Auslenkungen und -Variabilität (da kleinere und größere Auslenkungen – solange sie nach oben und unten in gleichem Ausmaß vorkommen – zu vergleichbaren HbA1c-Werten führen, aber das CV-Risiko bei großer Variabilität viel höher ist) stellen geringere Erythrozytenzahl und -überleben einen signifikanten Bias in der Einschätzung der BZ-Einstellung dar (HbA1c ab einem Kreatinin von 2,5 mg/dl ist falsch-niedrig!). Wenn auch die Bestimmung des glykosylierten Albumins bei diesen Patienten relevanter wäre, scheitert sie an der Praktikabilität. Letzendlich sollten im praxisgerechten Alltag zur Blutzuckereinstellung immer auch die Messungen aus den Blutzuckertagesprofilen herangezogen werden!
ZUSAMMENFASSUNG: Die diabetische Nephropathie und die Niereninsuffizienz des diabetischen Patienten stellen weiterhin die Hauptursachen der terminalen Niereninsuffizienz dar. Multifaktorielle Interventionen in sinnvollem Ausmaß (Blutdrucksenkung, RASBlockade, gute Stoffwechseleinstellung, Proteinrestriktion auf 0,8–1 g/kg/Tag, Vermeidung von Risikofaktoren wie Nikotinabusus, Exsikkose und nephrotoxischen Substanzen, rechtzeitige Zuweisung an nephrologisch kompetente ÄrztInnen) können helfen, die Progression der Niereninsuffizienz zu verzögern oder sogar das Auftreten dieser zu verhindern.
1 Kramar R., Oberbauer R., Österreichisches Dialyse- und Transplantationsregister, ÖDTR, Jahresbericht 2010 der Österreichischen Gesellschaft für Nephrologie
2 Ruilope L.M. et al.: RAS Blockade for Every Diabetic Patient: Pro and Con. Diabetes Care 2011; 34 (Suppl. 2):S320-324
3 Turnbull F.M. et al., Diabetologia 2009 Aug 5
4 Hamet P.: What matters in ADVANCE and ADVANCEON. Diabetes, Obesity and Metabolism 2012; 14 (Suppl. 1):20–29
5 Parving H.H. et al., AVOID Study Investigators: Aliskiren combined with losartan in type 2 diabetes and nephropathy. N Engl J Med 2008; 358:2433-2446
6 www.arzneitelegramm.de/abo/b111223.html
7 Patel A. et al.: Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial). Lancet 2007; 370:829-840
8 Astor B.C. et al.: Glomerular Filtration Rate, Albuminuria, and Risk of Cardiovascular and All-Cause Mortality in the US Population. Am J Epidemiol 2008; 167:1226-1234
9 www.kindey.org/professionals/KDOQI/guideline_diabetes/
10 Biesenbach et al., Diabetic Medicine 2003; 20:642-645
11 Kovesdy C.P. et al.: Glycemic Control in Diabetic CKD Patients: Where Do We Stand? Am J Kidney Dis 2008; 52:766-777