Diastolische Herzinsuffizienz
Die Hälfte aller Patienten mit Herzinsuffizienz weist eine erhaltene Linksventrikelfunktion auf. Die aktuell gängige Bezeichnung dieser im Allgemeinen auch als diastolische Herzinsuffizienz bezeichneten Entität lautet HFpEF (Heart Failure with preserved Ejection Fraction) und grenzt sich somit von der systolischen Herzinsuffizienz (HFrEF – Heart Failure with reduced Ejection Fraction) ab. Bei ähnlicher Prognose zeigt HFpEF eine alarmierend steigende Prävalenz um 1 % pro Jahr. Es ist in den nächsten Jahren damit zu rechnen, dass HFpEF die prädominierende Präsentation der Herzinsuffizienz sein wird. Risikogruppen für HFpEF sind Hypertoniker, Ältere, Frauen und Diabetiker.
Pathophysiologisch spielen die diastolische Dysfunktion in Ruhe und unter Belastungsbedingungen sowie ein eingeschränkter „Ventricular-arterial Coupling“-Mechanismus, zusammen mit einer Verschlechterung der belastungs- und flussmediierten Vasodilatation, chronotrope Inkompetenz und pulmonale arterielle Hypertension jeweils eine Rolle. Der diastolische Dysfunktion per se liegt eine zunehmende myokardiale Steifigkeit, die ihre Ursache in einem erhöhten Kollagenanteil in der extrazellulären Matrix, einer Veränderung der Kardiomyozyten und in matrizellulären Proteinen findet, zugrunde.
Diagnostik von HFpEF
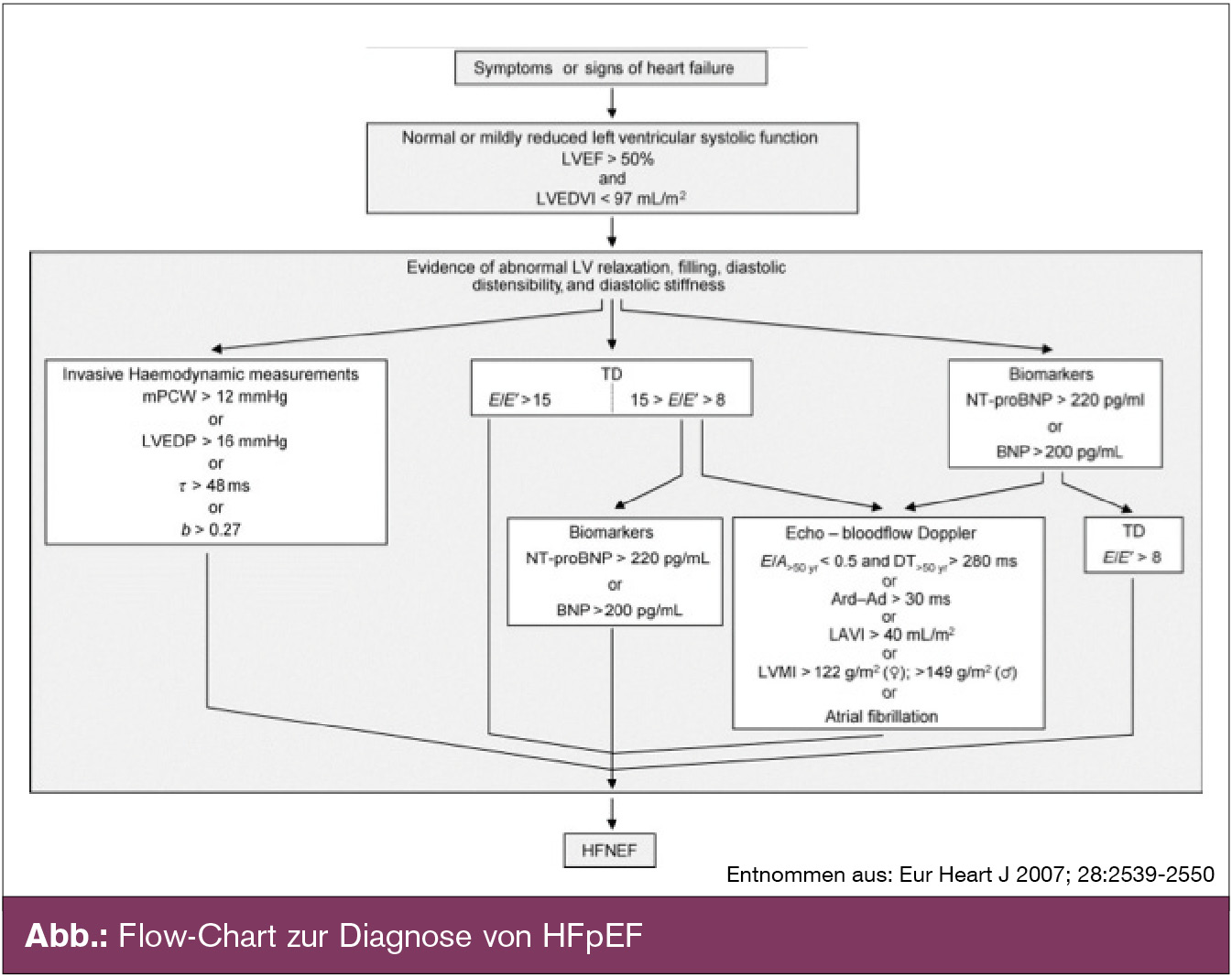
Die Diagnostik von HFpEF respektive der diastolischen Herzinsuffizienz ist schwierig. Dies schlägt sich auch in den rezenten ESC-Guidelines zur Diagnostik und Therapie der Herzinsuffizienz nieder. Unter dem Titel „Gaps in evidence“ wird darauf hingewiesen, dass die Diagnostik von HFpEF eine besondere Herausforderung darstellt und die optimale Vorgehensweise nach wie vor nicht evident ist. Eine Näherung zu diesem Problemkreis findet sich in einem ESC-Konsensstatement zur Diagnostik der diastolischen Dysfunktion (Eur Heart J 2007; 28:2539-2550).
Zur Diagnosestellung von HFpEF sind jeweils
- Symptome der Herzinsuffizienz,
- eine normale systolische Funktion und
- Zeichen der diastolischen Dysfunktion erforderlich.
Erfassung der diastolischen Dysfunktion: Nachdem die verlässlichen invasiven Messungen (linksventrikulärer enddiastolischer Druck [LVEDP] und pulmonalkapillärer Wedgedruck [PCWP]) nicht ubiquitär verfügbar sind, spielt in der klinischen Praxis die minutiöse echokardiografische Abklärung eine ganz wesentliche Rolle zur Diagnostik von HFpEF (Abb.).
Ratio E/e`: Die echokardiografischen Parameter der diastolischen Dysfunktion sind nicht ganz einfach zu erfassen und auch nicht restlos als solche validiert.
Als relativ gut etablierter Parameter gilt die Bestimmung von E als „peak velocity“ des frühdiastolischen Einflusses über die Mitralklappe (gemessen im PW-Doppler) und von e` als frühdiastolische „lengthening velocity“ (gemessen im Tissue-Doppler). Während e` gleichfalls als Ausmaß des frühdiastolischen Blutflusses in den linken Ventrikel betrachtet werden kann, gilt E quasi als Druckgradient, den es zu überwinden gilt.
Die Ratio E/e` korreliert sehr gut mit dem linksventrikulärem Füllungsdruck. Dementsprechend besteht bei E/e` > 15 eine hohe Evidenz für eine diastolische Dysfunktion, während E/e` E/e` < 8) sind zusätzliche Kriterien zur Diagnosestellung der diastolischen Dysfunktion erforderlich (natriuretische Petide, Pulmonalvenenfluss, LV-Masse oder Vorhofflimmern).
Belastungsuntersuchungen: Für Patienten mit signifikanter Klinik im Sinne von Belastungsdyspnoe und grenzwertigen Befunden bzw. nicht besonders auffälligen invasiven oder echokardiografischen Untersuchungen ist die Hämodynamik unter körperlicher Belastung von großem Interesse. Diesbezüglich sind Belastungsuntersuchungen mit invasiver Druckmessung angezeigt. Echokardiografische Untersuchungen erbringen dabei häufig insuffiziente Befunde (aufgrund von Tachykardie und Störungsartefakten bei Bewegungen etc.).
Therapie
Bis dato gibt es keine überzeugend effektive medikamentöse Therapie, die in die Lage ist, Mortalität und Hospitalisierungsrate bei HFpEF zu reduzieren. Diuretika werden zur rein symptomatischen Therapie eingesetzt. Eine adäquate Kontrolle des Blutdrucks und die Behandlung von Ischämie werden empfohlen. Weiters wird auf die Frequenzkontrolle bei Vorhofflimmern hingewiesen. Letzteres gelingt mit Ca-Antagonisten und Betablockern.

Konsequentes körperliches Training bei diastolischer Herzinsuffizienz: eine nicht zu unterschätzende Option
angesichts enttäuschender Evidenz für die medikamentöse Therapie.
Foto: Martin Novak – shuttersock.com
Enttäuschende Datenlage: Groß angelegte klinische Studien zur Anwendung von ACE-Hemmern und Sartanen erbrachten enttäuschende Ergebnisse. Die CHARM-preserved-Studie (mit Candesartan) mit 3.023 Patienten und die I-PRESERVE-Studie (mit Irbesartan) an 4.128 HFpEF-Patienten verfehlten jeweils den primären Endpunkt (Mortalität und Hospitalisierungsrate). Allerdings konnte in der CHARM-preserved-Studie durch die Verabreichung von Candesartan die Hospitalisierungsrate reduziert werden. Ebenso negativ verlief die PEP-CHF-Studie mit dem ACE-Hemmer Perindopril mit 850 Patienten.
Neuere Therapieansätze etwa mit Aldosteronantagonisten werden aktuell gerade in großen Studien untersucht (TOPCAT, ALDO-DHF).
Des Weiteren gibt es ein breites Feld von experimentelle Untersuchungen mit neueren Substanzen wie etwa Phosphodiesterase-5-Inhibitoren, Tetrahydrobiopterin und Alagebriumchlorid – um nur einzelne anzuführen.
Training erfolgversprechend: Eine vielversprechende Therapieoption dürfte im Training liegen. In der Ex-DHF-Studie konnte gezeigt werden, dass regelmäßig durchgeführtes Training zu einer Erhöhung der Leistungsfähigkeit, einer Reduktion von E/e`, einer Reduktion des linksatrialen Volumenindex und einer Zunahme der Lebensqualität führt.