Entwicklungen beim Myelom – Steckbrief für neue Substanzen
In der Therapie des Multiplen Myeloms (MM) herrscht seit Jahren rege Dynamik – viele der bis vor Kurzem als „novel agents“ gehandelten Medikamente wie Immunmodulatoren (IMiD), Proteasomeninhibitoren (PI) oder monoklonale Antikörper haben sich etabliert. Neue Substanzen und Wirkstoffgruppen drängen in das Feld und werden teils in absehbarer Zeit bereits Zulassungsstatus erreichen.
Isatuximab
Mit Isatuximab steht ein weiterer Anti-CD38-Antikörper zur Verfügung, der sich von Daratumumab durch die Bindung an ein anderes Epitop unterscheidet. In der Phase-III-Studie ICARIA war das PFS in der Kombination mit Pomalidomid/Dexamethason (Pd) gegenüber Pd allein bei Patienten, die refraktär auf mindestens einen PI und Lenalidomid waren, beinahe verdoppelt (11,5 vs. 6,5 Monate). Die Ansprechrate wurde von 23 % auf 42 % erhöht.1 Die häufigsten Nebenwirkungen waren Infusionsreaktionen (38 % vs. 0 %) und Infekte der oberen Atemwege (28 % vs. 17 %). Die Zulassung in der Drittlinientherapie wird für Juni 2020 erwartet. In der Primärtherapie wird Isatuximab als Kombinationspartner von Carfilzomib/Dexamethason (KRd) für Hochrisiko-Patienten (GMMG-CONCEPT) bzw. VRd (Bortezomib/Lenalidomid/Dexamethason; GMMG HD7) untersucht.
Selinexor
Der erste Vertreter der Exportin-(XPO1-)Inhibitoren ist seit Juli 2019 durch die FDA, basierend auf den Ergebnissen der STORM-Studie, zugelassen. Bei IMiD-, PI- und Daratumumab-refraktären Patienten („triple class refractory“) wurde in Kombination mit Dexamethason ein Ansprechen bei immerhin 26 % gesehen, allerdings um den Preis relevanter Nebenwirkungen.2 Patienten litten unter gastrointestinalen Beschwerden (Nausea bei 72 %, Gewichtsverlust bei 50 %) und markanten Thrombozytopenien (73 % in toto, 59 % Grad 3/4), die letztlich nur mit Dosisreduktionen gut beherrschbar waren. Der Stellenwert von Selinexor als Einzelsubstanz muss daher hinterfragt werden, es dürfte sich aber als Kombinationspartner empfehlen. Gemeinsam mit Pomalidomid/Dexa (SPd) erzielt die Substanz Ansprechraten von 58 % bei Pom-naiven Patienten und wird in der dort eingesetzten Dosis von 60–80 mg bei 1 x wöchentlicher oraler Applikation auch akzeptabel vertragen.3 Die randomisierte Phase-III-Studie BOSTON (Selinexor + Bortezomib/Dexamethason vs. Vd) hat ihre Rekrutierung beendet, Ergebnisse wurden bislang aber noch nicht berichtet.
Iberdomid
Aus der Familie der IMiDs ist erneut eine Weiterentwicklung zu vermelden: Iberdomid (CC-220) ist der erste selektive Cereblon-E3-Ligase-Modulator (CELMoD), welcher eine hohe Bindungsaffinität an die Zielproteine Aiolos/Ikaros aufweist und auch bei IMiD-Resistenz wirksam ist. Erste Ergebnisse einer Phase-I-/II-Studie zeigen bei mehrheitlich Lenalidomid- und Pomalidomid-refraktären Patienten ein Ansprechen in der Größenordnung von 30 %.4 Bemerkenswerterweise traten keinerlei Neutropenien Grad 3/4 auf, auch wurden keine relevanten Diarrhöen beobachtet. Als häufigste schwerwiegende Nebenwirkung (22 %) wurden bei diesen im Median mit 5 Linien vorbehandelten Patienten – nicht unerwartet – Infektionen gesehen. Das Nebenwirkungsprofil scheint dennoch günstig zu sein, weshalb die Substanz aktiv weiterentwickelt wird und bereits Phase-III-Konzepte in Planung sind.
Venetoclax
Der BCL-2-Inhibitor hat die Therapielandschaft bei CLL revolutioniert und bietet sich auch für die etwa 20 % der MM-Fälle an, die eine Überexpression von BCL-2 – meist getragen durch eine Translokation t(11;14) – aufweisen. Tatsächlich lässt sich bereits in der Monotherapie ein beträchtliches Ansprechen erzielen, das in Kombination mit Vd in der Gesamtpopulation der BELLINI-Studie 80 % erreicht. Der PFS-Vorteil gegenüber Vd übertrug sich jedoch nicht auf das Gesamtüberleben – im Gegenteil, das OS entwickelte sich wegen gehäufter fataler Infektionen zu Ungunsten des experimentellen Arms und führte zu einem vorübergehenden Stopp der Studienaktivitäten.5 Betrachtet man das Kollektiv mit t(11; 14) bzw. BCL-2-Überexpression isoliert, so zeigen sich ein hohes Ansprechen (ORR 90 %, ≥ VGPR 70 %) und ein riesiger Unterschied im PFS (HR 0,11 bzw. 0,34) für Ven-Vd bei identem OS.6 Eine Zulassung ist wegen der Sicherheitsbedenken noch nicht in Sicht, es laufen aber neue Studien ausschließlich für Patienten mit nachgewiesener t(11;14).
Melflufen
Mit Melflufen kommt Altbekanntes neu verpackt: Melphalan wird durch Bindung an ein Peptid (Flufenamid) lipophil, selektiv in die Tumorzelle aufgenommen und hier von Peptidasen aktiviert, wodurch eine 40-fach höhere Wirkung erreicht wird. Dies geht mit einer besseren Verträglichkeit einher; speziell Haarverlust oder eine schwerwiegende Mukositis werden nicht beobachtet. Nichtsdestotrotz hat konventionelle Chemotherapie bei multipel vorbehandelten Patienten seinen Preis: in der Phase-II-Studie HORIZON wurden nebenwirkungsbedingte Therapieabbrüche bei 14 % der Patienten berichtet; überwiegend hämatologische Toxizitäten Grad 3/4 traten bei 72 % auf.7 Es wurden Patienten mit sehr ungünstiger Prognose eingeschlossen, dennoch erreichte man bei 1 x monatlicher i. v. Gabe und wöchentlichem Dexamethason eine Krankheitsstabilisierung bei 86 % und ein messbares Ansprechen bei 28 % der Probanden. Das Alleinstellungsmerkmal der Studie ist der sehr hohe Anteil an Patienten mit extramedullärer Erkrankung (60 %), die ebenso eine Ansprechrate von 30 % aufwiesen. Ein PFS von 4,0 Monaten mag bescheiden wirken, das OS ist mit 11,0 Monaten in diesem Kollektiv allerdings mehr als respektabel.
Belantamab Mafodotin
Das Immun-Toxin-Konjugat Belantamab Mafodotin ist dem u. a. bei M. Hodgkin etablierten Brentuximab Vedotin nachempfunden, bindet an BCMA (B-cell maturation antigen) und schleust gezielt ein Zytostatikum (MMAF) in die MM-Zelle. In der Phase-II-Studie DREAMM-2 erreichte die Substanz als Monotherapie (i. v. Gabe alle 3 Wochen) bei auf CD38-Antikörper refraktärer Erkrankung ein Ansprechen von immerhin 31–34 %.8 Häufige Nebenwirkungen sind Blutbildveränderungen (Thrombozytopenie 20 %, Anämie 20 %) sowie eine Keratopathie (≥ Grad 3: 27 %), die unangenehm, aber reversibel ist und sich durch Anwendung steroidhaltiger Augentropfen positiv beeinflussen lässt. Eine enge Zusammenarbeit mit den Kollegen der Augenheilkunde ist jedenfalls erforderlich.
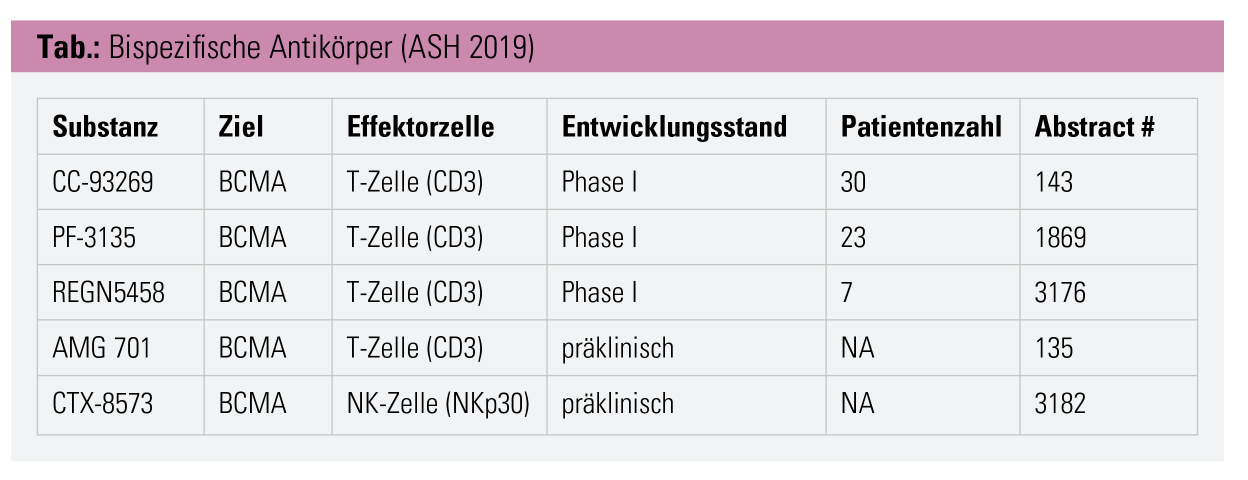
Bispezifische Antikörper
Nach dem Vorbild von Blinatumomab wurde mit AMG 420 der erste bispezifische Antikörper im BiTE-Format (bispecific T cell engager) für das MM entwickelt und erreichte in der Zieldosis von 400 µg/d Ansprechraten von 70 %,9 wird aber nicht weiterentwickelt. Die Substanzen der 2. Generation (Tab.) enthalten eine Fc-Domäne, wodurch die intermittierende Gabe möglich wird, und befinden sich derzeit in früher klinischer Prüfung. Zielstruktur ist mehrheitlich BCMA, am weitesten fortgeschritten scheint derzeit CC-93269 mit Ansprechraten von 89 % in der höchsten bisher getesteten Dosis.10 Präklinische Daten lassen auf einen möglichen Synergismus mit IMiDs schließen und öffnen das Feld für künftige Kombinationsstrategien.11
CAR-T-Zellen
Die detaillierte Besprechung der CAR-T-Zell-Therapie bei MM würde den Rahmen dieses Berichts sprengen. Die bisher publizierten Ergebnisse speziell für bb2121 zeigen zwar beeindruckende Ansprechraten, aber – anders als bei aggressiven Lymphomen – eine nur begrenzte progressionsfreie Zeit von etwa 12 Monaten.12 An verbesserten CAR-T-Konstrukten wird vornehmlich in den USA und China gearbeitet, das Studienangebot in Europa ist hier bislang leider sehr dünn.
Fazit
In naher Zukunft werden wir zahlreiche neue Entwicklungen in der Klinik sehen, aber auch neue und schwere Nebenwirkungen, vor allem Infektionen, im Auge behalten müssen.