Eosinophile Ösophagitis: ein unspezifisches Erkrankungsbild
Die eosinophile Ösophagitis (EoE) ist eine chronische Entzündung der Speiseröhre, die durch Symptome einer Fehlfunktion des Organs und Infiltrate des Ösophagusepithels durch eosinophile Granulozyten charakterisiert ist. Die EoE muss von einer Refluxösophagitis abgegrenzt werden. Die EoE wurde 1978 erstmals beschrieben, anfänglich wurde sie als seltene Erkrankung erachtet, in den letzten Jahren wird sie aber zusehends häufiger als Ursache für Dysphagie und Bolusgeschehen diagnostiziert. Es gibt Schätzungen, dass eine EoE in 6–15 % aller endoskopierter Patienten erkannt werden könnte, bei durch ein Bolusereignis vorselektierte Patienten bis zu 50 %.
Pathogenese: Die Erkrankung ist immunmediiert. Als Antwort auf einen Antigenstimulus aus der Nahrung oder der Umwelt wird eine Entzündung im Speiseröhrenepithel ausgelöst und es werden Faktoren wie Interleukin 4, 5 und 13 freigesetzt. Diese stimulieren Eotaxin 3, welches eosinophile Granulozyten in die Schleimhaut lockt. Werden diese Granulozyten aktiviert, verursachen diese lokale Gewebeschäden und aktivieren in weiterer Folge Mastzellen und Fibroblasten. Diese mediieren ein „Remodeling“ der Speiseröhre mit einer rigiden, verletzlichen Mukosa und Stenosierungen. Eine genetische Prädisposition durch Mutation von z. B. Eotaxin konnte gezeigt werden.
Klinik: Die Symptome der EoE variieren mit dem Alter der Patienten und sind unspezifisch. Während sie bei Kindern Gedeihstörung, Nahrungsverweigerung, epigastrische Schmerzen, Übelkeit, Erbrechen und Regurgitation beinhalten, präsentiert sich die Erkrankung bei Jugendlichen und Erwachsenen mit Dysphagie und Bolusereignissen. Über Sodbrennen klagen sowohl Kinder als auch Erwachsene. So ist vor allem bei jenen Patienten mit einer vermeintlichen Refluxerkrankung, welche nicht auf eine Therapie mit Protonenpumpenhemmern ansprechen, an eine EoE zu denken. Allergische Begleiterkrankungen wie Asthma, atopische Dermatitis, Heuschnupfen und Nahrungsmittelallergien sind bei EoE häufig, aber nicht zwingend.
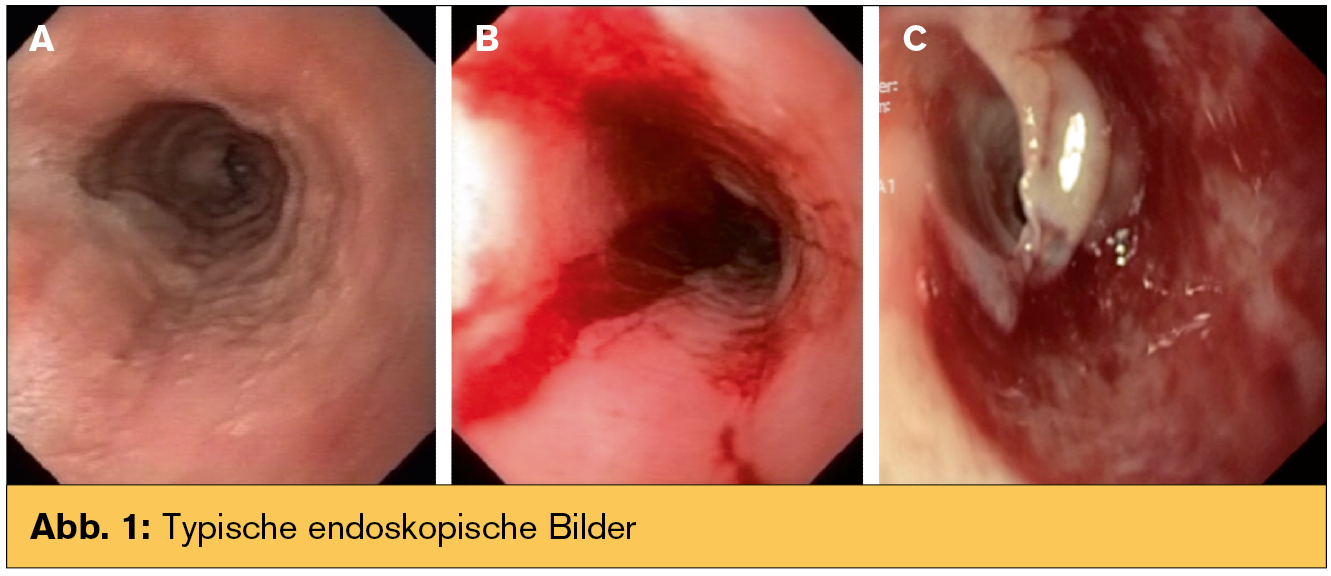
Endoskopie: Es gibt einige typische endoskopische Bilder, diese sind jedoch nicht spezifisch und unterliegen einer deutlichen Inter- und Intraobservervariabilität: Schleimhautringe können fixiert („Trachealisierung“) oder transient („Felinisierung“ = wie bei einer Speiseröhre einer Katze) auftreten. Lineare und zur Längsachse des Organs parallele Furchen (Abb. 1a), weißliche Plaques oder Exsudate können gesehen werden. Manchmal erscheint die Schleimhaut nur blass oder hat eine verminderte Vaskularisierung. Da die Mukosa sehr verletzlich ist, kann sie bei der Passage mit dem Endoskop leicht einreißen, ein Phänomen, das „Krepppapier-Schleimhaut“ genannt wird (Abb. 1b). Im Extremfall kann die Schleimhaut großflächig exfoliert werden (Abb. 1c). Biopsien sind für die Diagnose der EoE unumgänglich. Da sich 10–20 % der Patienten mit einer makroskopisch unauffälligen Endoskopie präsentieren, soll bei allen Patienten mit ungeklärter Dysphagie biopsiert werden. Die Probenentnahme soll getrennt aus dem distalen und proximalen Ösophagus erfolgen.
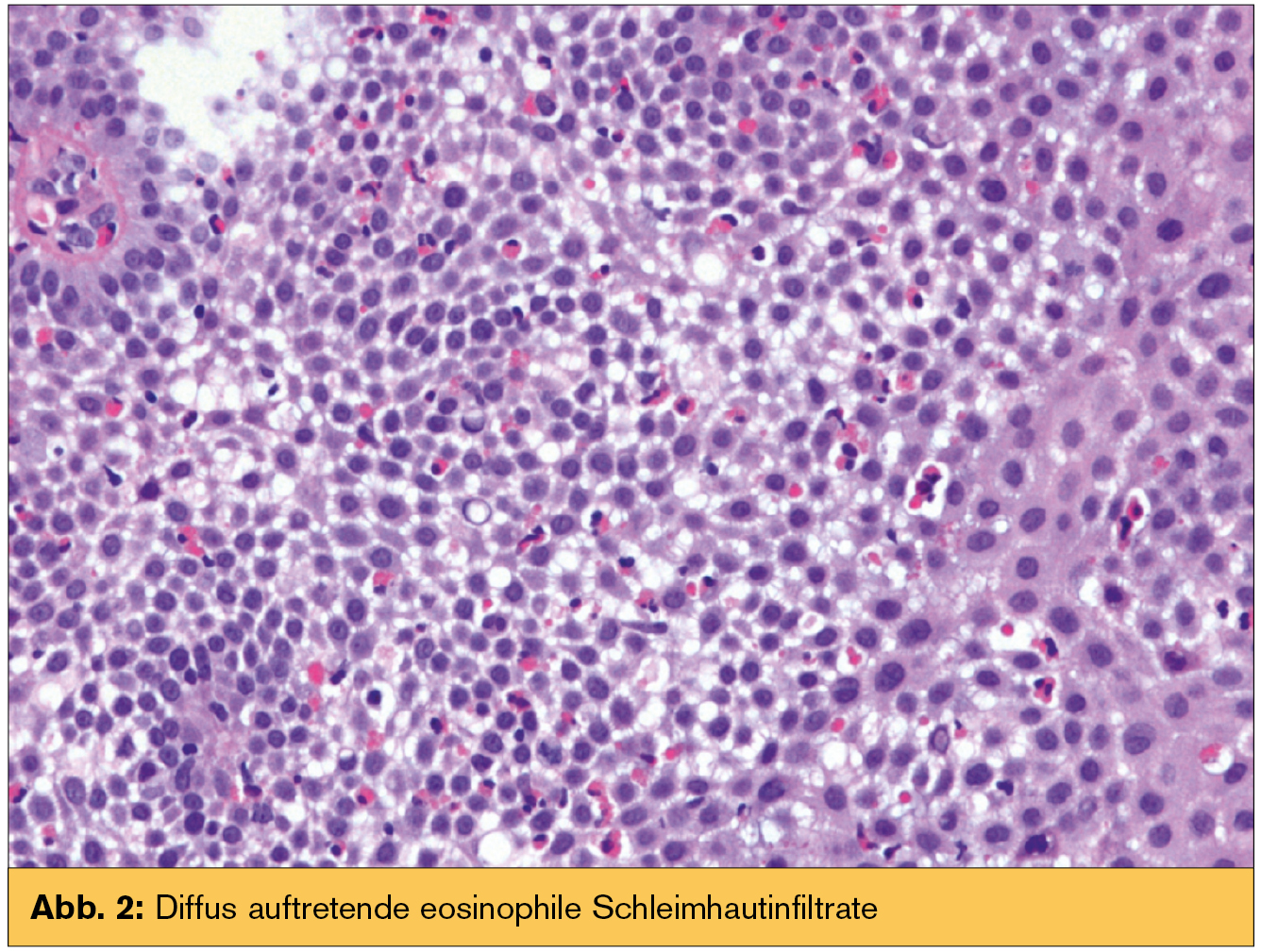
Histologie: Eosinophile Schleimhautinfiltrate können diffus (Abb. 2) oder in Clustern auftreten, im Extremfall als eosinophile Mikroabszesse. Auch eine eosinophile Degranulierung mit extrazellulärem Granulaprotein kann bestehen. Wenn im Biopsat Lamina propria miterfasst ist, dann ist diese häufig fibrosiert. Das Ausmaß der eosinophilen Infiltration wurde anfänglich kontroversiell gesehen, dzt. ist eine diagnostische Grenze von mindestens 15 Eosinophilen pro High Power Field (HPF) des Mikroskops gefordert. Wie die endoskopischen Veränderungen sind auch die histologischen nicht spezifisch. Aufgrund der Häufigkeit einer GERD ist die Abgrenzung eosinophiler Infiltrate bei dieser Erkrankung von besonderem praktischem Interesse. Aber auch andere Erkrankungen können von einer Eosinophilenvermehrung begleitet sein (Tab.). Ein neu beobachteter Phänotyp ist eine „PPI-response esophageal eosinophilia“ (PPI-REE). In mehreren Studien konnte gezeigt werden, dass bei einem Drittel der Patienten mit Eosinophilie der Speiseröhre diese auf die Einnahme von PPI mit kompletter symptomatischer und histologischer Besserung reagieren. Es ist bisher noch unklar, ob diese PPI-REE eine atypische Form der GERD ist, eine Variante der EoE oder überhaupt eine neue Krankheitsentität.
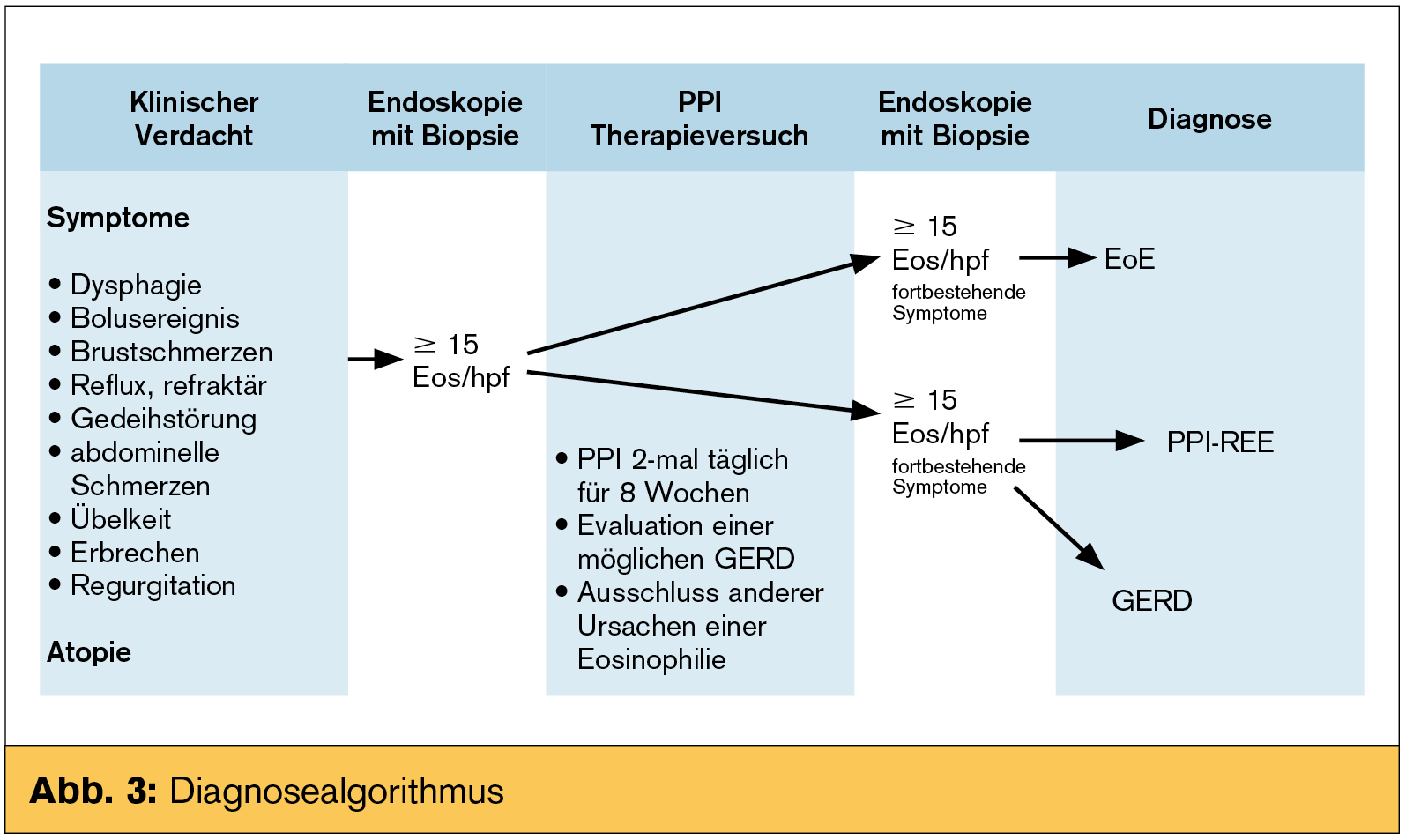
Diagnose: Bei der anfänglichen Definition der EoE wurde aus methodischen Gründen das Bestehen einer GERD als Ausschluss zur Diagnose gesehen. Die 2011 neu fomulierten Guidelines erfordern die Erfüllung dreier Kriterien: 1. klinische Symptome, 2. eosinophile Infiltration und 3. ein Ausschluss anderer Erkrankungen mit eosinophilen Infiltraten, die PPI-REE eingeschlossen. Eine GERD muss nicht mehr zwingend berücksichtigt werden, da EoE und GERD gemeinsam auftreten können. Einen Diagnosealgorithmus schlägt Abb. 3 vor.
Therapie: Die Krankheit ist nicht heilbar, das Ziel ist eine Symptomlinderung. Da Nahrungsmittelallergien Auslöser der Erkrankung sein können, spielen diätetische Maßnahmen eine wichtige Rolle. Neulich konnte gezeigt werden, dass eine Elimination der 6 bekanntesten Allergene aus der Nahrung von Erwachsenen mit EoE Beschwerden und auch die Histologie gebessert wurden (60 % der Patienten nach Weglassen von Weizen, 50 % bei Milch). Hauttests waren bei diesen Patienten nur in 13 % positiv. Als Standardtherapie gilt die topische Therapie mit Fluticason oder Budesonid über einen Zeitraum von 6–8 Wochen. Die Erfolgsrate liegt bei 50–95 %, Rezidive sind jedoch sehr häufig. Diese treten meist nach 9 Monaten auf, eine Therapiewiederholung wird dann notwendig. Eine Erhaltungstherapie mit niedrigen Dosen eines topischen Kortikoids bringt keine Vorteile, Cromoglycinsäure oder Leukotrien-Antagonisten sind wirkungslos. Für Problemfälle gibt es Therapieansätze mit dem IL-5-Antikörper Mepolizumab. Bei Stenosierung besteht die Indikation zur Dehnungsbehandlung.