Genetische Untersuchungen in der Hepatologie – Verschwimmende Grenzen zwischen prädiktiver genetischer Diagnostik und Erfassung von genetischen Risikofaktoren
Klinisch-chemische Untersuchungen in der hepatologischen Stufendiagnostik erfolgen in zwei Stufen:
Stufe 1
Die erste Stufe der hepatologischen Diagnostik bei klinischem Verdacht auf chronische Lebererkrankung oder suggestiven laborchemischen Veränderungen im Blut zielt neben einer gezielten Anamnese und Untersuchung auf die 4 häufigsten Erkrankungen der Leber:
1. serologische Analysen zur Diagnose einer chronischen Virushepatitis B oder C
2. Bestimmung der AST und ALT, des Carbohydrat-defizienten Transferrins (CDT) sowie der Färbeindizes der Erythrozyten (MCH und MCV) und Durchführung einer Sonografie zur Diagnose einer alkoholischen Lebererkrankung in Zusammenschau mit den anamnestischen Angaben.
3. Bestimmung des Lipidstatus, des HbA1c, des Bauchumfangs und des BMI mit Sonografie zur Diagnose einer nicht-alkoholischen Lebererkrankung.
4. Bestimmung der Serum-Eisenparameter zur Diagnose einer Hämochromatose. Für alle 4 Gruppen dieser häufigsten Lebererkrankungen gibt es korrespondierende genetische Untersuchungen, die zur Bestätigung der Diagnose beitragen oder zusätzliche Informationen über die Prognose, den Krankheitsverlauf und die Therapie geben.
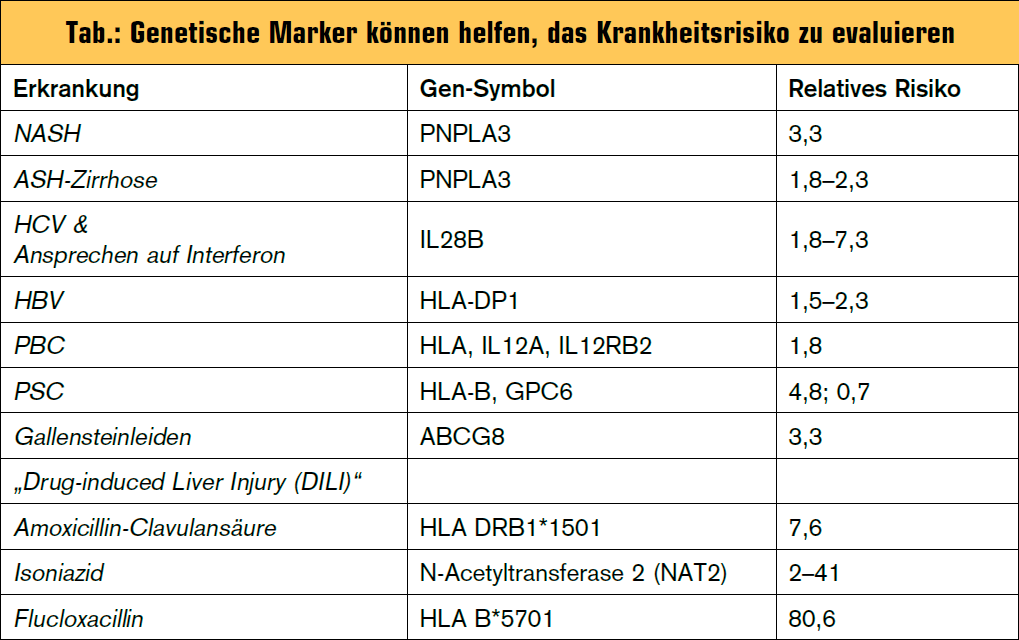
Patienten mit Hepatitis C, die den CC-Genotyp nahe dem IL28B-Gen an der Position rs1297860 aufweisen, sprechen mit doppelt so hoher Wahrscheinlichkeit auf eine Interferontherapie an als Patienten mit Genotyp CT oder TT an (Tab.). Zusätzlich heilt auch eine akute Hepatitis C mit höherer Wahrscheinlichkeit aus, wenn Patienten den „guten“ Genotyp CC haben. In einer Studie betrug die Spontanheilungsrate einer akuten Hepatitis C bei Patienten mit CC Genotyp 64 % gegenüber 24 % bei Patienten mit Genotyp CT oder gar nur 6 % bei Patienten mit Genotyp TT. Daher ist der IL28B-Genotyp heute eine Standarduntersuchung bei Patienten mit chronischer Hepatitis C und ein Entscheidungskriterium in modernen Therapiealgorithmen bei Hepatitis C.
Auch bei Patienten mit alkoholischer Lebererkrankung können genetische Marker helfen, das leberspezifische Krankheitsrisiko zu evaluieren. Der GG-Genotyp an der Position rs738409, der dazu führt, dass an Position 148 der Lipase Adiponutrin die Aminosäure Methionin statt Isoleucin eingebaut wird (I148M) ist prädiktiv für das Vorliegen einer alkoholassoziierten Lebererkrankung. In einer Studie war eine alkoholische Lebererkrankung 3-mal so häufig bei Patienten mit GG-Genotyp als bei Patienten mit anderen Genotypen.
Nicht-alkoholische Fettleber: Das Gen, das für Adiponutrin kodiert, wird als PnPLA3 (Patatinlike Phospholipase Domain-containing Protein 3) bezeichnet und wurde ursprünglich als Risikofaktor für hepatische Triglyzeridakkumulation identifiziert. Damit spielt der PnPLA3/ Adiponutrin-Genotyp auch eine wichtige Rolle bei der Evaluierung von Patienten mit nichtalkoholischer Fettleber, da Patienten mit dem ungünstigen GG-Genotyp eine genetische Erklärung für hepatische Triglyzeridakkumulation haben, die nicht notwendigerweise als hepatische Manifestation des metabolischen Syndroms gewertet werden muss. Ob Patienten mit dem ungünstigen GG-Genotyp in PnPLA3 bei gleich ausgeprägter Fettleber daher auch ein geringeres Risiko haben, Komplikationen eines metabolischen Syndroms zu erleiden, muss noch geklärt werden.
Die Hämochromatose ist mit einer Prävalenz von 1:1.000 eine klassische genetische Lebererkrankung, bei der in unseren Breiten über 85 % der betroffenen Patienten homozygote Anlageträger für einen Austausch der Aminosäure Cystein zu Tyrosin an Position 282 im Protein des so genannten HFE-Gens sind. Bei einer erhöhten Transferrinsättigung besteht der Verdacht auf Hämochromatose und somit eine Indikation zur Genotypisierung des HFE-Gens. Die Diagnose einer Hämochromatose beruht somit auf suggestiven Serum-Eisenparametern mit erhöhter Transferrinsättigung (und Hyperferritinämie) und einer Homozygotie für C282Y im HFE-Gen. Bei einem kleineren Teil der Patienten mit klinischer Hämochromatose und Eisenablagerung im Gewebe finden sich hingegen genetische Veränderungen in den Genen für Hepcidin (HAMP), Hämojuvelin (HJV), Transferrinrezeptor 2 (TFR2) oder auch Ferroportin (SLC40A1). Da die genetischen Veränderungen in diesen Genen nicht so uniform sind wie die C282Y-Mutation im HFEGen, ist bei Verdacht auf eine so genannte „nicht-HFE-assoziierte Hämochromatose“ daher eine differenzierte genetische Abklärung mit direkter Sequenzierung dieser Gene indiziert.
Stufe 2
In der zweiten Stufe der hepatologischen Diagnostik helfen die klinische Präsentation und weitere biochemische Laborparameter.
1. Bei weiblichen Patienten, insbesondere mit Autoimmunphänomenen und hepatitischer Präsentation, sollte eine weiterführende immunologische Diagnostik mit AnA, LKM, SLA-Autoantikörper und Immunglobulinen erfolgen, um eine Autoimmunhepatitis zu diagnostizieren.
2. Bei Patienten mit cholestatischem Muster der Transaminasenerhöhung, Ikterus, Juckreiz oder Fieber hilft eine Bestimmung der AMA oder eine Gallenwegsdarstellung zur Diagnose einer primär biliären Zirrhose (PBC) bzw. einer primär sklerosierenden Cholangitis (PSC).
3. Bei jungen Patienten mit Leberzirrhose und verminderter Serumkonzentration von Alpha-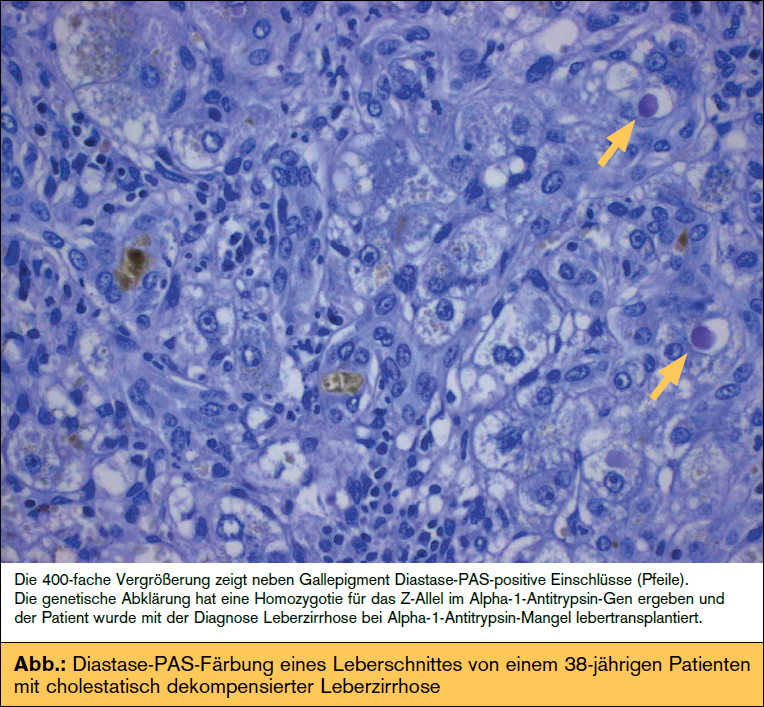 1-Antitrypsin oder erhöhter Harnkupferausscheidung sind in erster Linie genetische Untersuchungen zur Diagnose eines Alpha-1-Antitrypsin- Mangels oder eines Morbus Wilsons indiziert. Insbesondere bei letzteren beiden Erkrankungen helfen genetische Analysen bei der Diagnosestellung. Bei Mb. Wilson ist die Analyse des Gens ATP7B angezeigt, wobei aufgrund der Größe und Komplexität des Gens die Analyse zeitintensiv und teuer ist und insbesondere bei fulminanter Krankheitsmanifestation eine Leberbiopsie bzw. eine Spaltlampenuntersuchung notwendig sind, um die Diagnose konventionell zu stellen. Da nur ein Teil der Patienten eine verminderte Coeruloplasminkonzentration hat, ist diese nur ein kleiner Baustein bei der Diagnosefindung und weder notwendig noch beweisend für die Diagnose eines Mb. Wilson.
1-Antitrypsin oder erhöhter Harnkupferausscheidung sind in erster Linie genetische Untersuchungen zur Diagnose eines Alpha-1-Antitrypsin- Mangels oder eines Morbus Wilsons indiziert. Insbesondere bei letzteren beiden Erkrankungen helfen genetische Analysen bei der Diagnosestellung. Bei Mb. Wilson ist die Analyse des Gens ATP7B angezeigt, wobei aufgrund der Größe und Komplexität des Gens die Analyse zeitintensiv und teuer ist und insbesondere bei fulminanter Krankheitsmanifestation eine Leberbiopsie bzw. eine Spaltlampenuntersuchung notwendig sind, um die Diagnose konventionell zu stellen. Da nur ein Teil der Patienten eine verminderte Coeruloplasminkonzentration hat, ist diese nur ein kleiner Baustein bei der Diagnosefindung und weder notwendig noch beweisend für die Diagnose eines Mb. Wilson.
Die Lebermanifestation des Alpha- 1-Antitrypsin-Mangels wird im Gegensatz zum Mb. Wilson in den allermeisten Fällen durch eine typische Mutation in dem für das Serumprotein Alpha-1-Antitrypsin (A1AT) kodierenden Gens SERPInA1 verursacht. Die Mutation führt zu einer gestörten Faltung und hepatozellulären Speicherung des Proteins, welche der Pathologe auch als Diastase-PAS-positive Granula darstellen kann. Bei Patienten mit chronischer Lebererkrankung und verminderter Konzentration von A1AT im Serum (< 80 mg/dl) sollte daher eine Genotypisierung des so genannten Z-Allels erfolgen.
Rezente genomweite Assoziationsstudien haben auch genetische Risikofaktoren für PBC und PSC identifiziert, die – ähnlich wie „Risikogene“ für Hepatitis B – im HLA-Lokus liegen und die immunologische Komponente der Erkrankungen unterstreichen. Da das relative Krankheitsrisiko bei diesen speziellen HLA-Typen jedoch relativ gering ist, spielen diese Gene keine Rolle in der Routinediagnostik.
FACT-BOX
- Dank moderner genetischer Methoden wurden fur beinahe jede Krankheit Risikogene identifiziert.
- In der klinischen Praxis haben die HFE-Genotypisierung und die Alpha-1-Antitrypsin-Genotypisierung einen fixen Platz in der Diagnostik der Hamochromatose bzw. des Alpha-1-Antitrypsin-Mangels.
- Die Bedeutung des Fettleber-Risikogens PNPLA3 fur die Prognose und Therapie der alkoholischen und nicht-alkoholischen Fettlebererkrankung ist noch nicht geklart.
- Bei Patienten mit chronischer Hepatitis C kann eine Genotypsierung nahe dem IL28B-Gen die Vorhersage über die Wahrscheinlichkeit des Ansprechens auf eine interferonbasierte Therapie erleichtern.
- Aufwändige genetische Untersuchungen mit kompletter Sequenzierung sind bei Verdacht auf Mb. Wilson, cholestatischen Lebererkrankungen und nicht-HFE-assoziierter Hämochromatose indiziert, wobei die Einfuhrung von „next generation sequencing“ in der Routine die Diagnostik dieser Erkrankungen in naher Zukunft revolutionieren konnte.