HDAC-Inhibition – ein neuer Therapieansatz für HFpEF
Die im Folgenden besprochene Studie wurde bereits im Journal Science Translational Medicine1 publiziert. Des Weiteren wurden die Studienergebnisse als Research Highlight in den renommierten Fachzeitschriften Nature Reviews Drug Discovery2 und Nature Reviews Cardiology3 präsentiert.
Hintergrund
Weltweit zählt die Herzinsuffizienz nicht nur zu einem der größten Gesundheitsprobleme, sondern verursacht auch immens hohe Kosten für das Gesundheitssystem. Allein in Österreich sind rund 300.000 Menschen betroffen. Bei etwa der Hälfte dieser Patienten ist die Ursache vor allem auf eine gestörte Relaxation und erhöhte linksventrikuläre Füllungsdrücke zurückzuführen und wird als „Heart Failure with preserved Ejection Fraction“ (HFpEF) bezeichnet. HFpEF ist mit einer sehr schlechten Prognose, häufigen Krankenhausaufenthalten und eingeschränkter Lebensqualität assoziiert.
Die 5-Jahres-Überlebensrate liegt bei nur 50 %, und trotz intensiver Forschungsanstrengungen gibt es derzeit keine prognoseverbessernde Therapie für Patienten mit HFpEF. Ursache hierfür ist u. a. die Tatsache, dass es kaum valide Tiermodelle gibt, welche die Komplexität der Erkrankung widerspiegeln. Des Weiteren beschränkten sich die meisten tierexperimentellen Studien auf die Evaluierung der kardialen Funktion. Funktionelle und strukturelle Veränderungen der Lunge wurden kaum systematisch untersucht, obwohl pulmonale Hypertonie bei Patienten mit HFpEF eine hohe Prävalenz aufweist (36–83 %) und mit einer hohen Mortalität und Morbidität assoziiert ist.
HDAC-Hemmung im HFpEF-Tiermodell
Ziel unserer Forschungsarbeit war es zunächst, ein valides HFpEF-Tiermodell zu etablieren und kardiopulmonale Veränderungen zu charakterisieren.4 Gemäß den europäischen Richtlinien für Herzinsuffizienz5 erfüllt das Modell alle Kriterien, um eine HFpEF-Diagnose stellen zu können. Das Modell zeichnet sich u. a. durch die Entstehung einer pulmonalen Hypertonie und Verschlechterung der Lungenfunktion aus. Im nächsten Schritt wurde die Wirkung von SAHA („suberoylanilide hydroxamic acid“), einem pan-HDAC-Inhibitor, untersucht. HDAC-(histone deacetylases-)Inhibitoren sind auf Grund ihrer antiproliferativen Wirkung zur Behandlung verschiedener Tumoren, nicht jedoch zur Behandlung von Herzinsuffizienz zugelassen. HDACs sind Enzyme, welche durch das Entfernen von Acetylgruppen von verschiedenen Proteinen eine wichtige Rolle in der Genexpression und posttranslationalen Modifikation spielen. Unsere Arbeitsgruppe untersuchte nun erstmalig die Wirkung von HDAC-Inhibition in einem relevanten, gut charakterisierten und translationalen Großtiermodell für HFpEF.1
Methodik
Der HFpEF-Phänotyp wurde in jungen Katzen durch eine Konstriktion der Aorta mit Hilfe eines eigens angefertigten Bands mit fixem Innendurchmesser induziert. Das Band wurde locker um die Aorta ascendens platziert und verursachte somit keine akute Drucküberladung des linken Ventrikels. Im Verlauf kommt es, durch das Wachstum der Tiere, jedoch zu einer langsamen, progredienten Druckbelastung des linken Ventrikels. Diese Methode ermöglicht es dem Herzen, sich an die neuen Druckverhältnisse anzupassen. Nach dem Eingriff wurde 2 Monate lang gewartet, um einen ausgeprägten kardialen HFpEF-Phänotyp mit linksventrikulärer Hypertrophie (LVH), vergrößerten linken Vorhöfen und gestörter linksventrikulärer Relaxation zu erhalten. Erst danach wurden die HFpEF-Tiere entweder mit SAHA (10 mg/kg Körpergewicht) oder mit Placebo für 2 Monate lang behandelt. Dieses Protokoll wurde bewusst gewählt, um ein klinisch relevantes Szenario zu simulieren und eine translationale Interpretation der Ergebnisse zu gewährleisten. Serielle Echokardiografie und Lungenfunktionstestung wurden monatlich bis zum Ende der Studie durchgeführt. 4 Monate nach dem Eingriff wurden invasive hämodynamische Untersuchungen durchgeführt und Gewebe für weiterführende histologische und molekularbiologische Experimente gewonnen.
Studienergebnisse
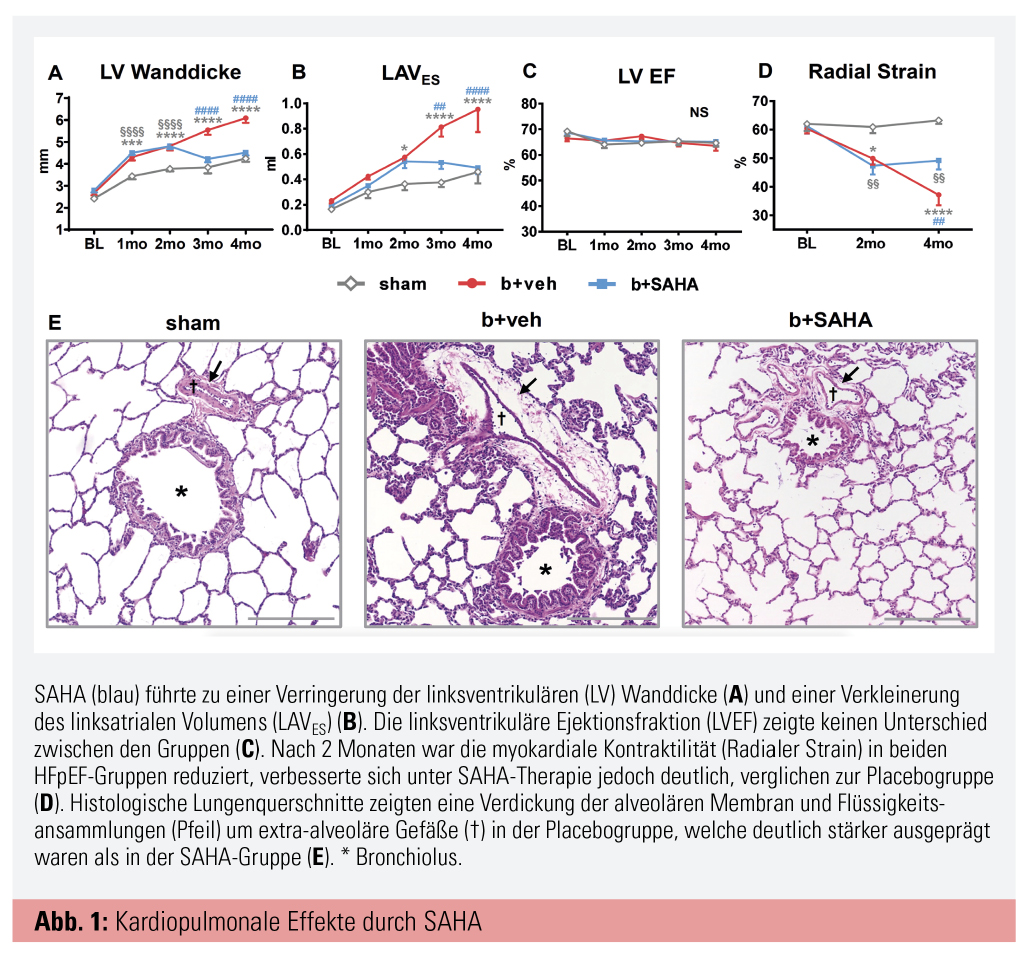
Echokardiografisch zeigte sich eine signifikante Reduktion der LVH, eine Verkleinerung des linken Vorhofes und eine Verbesserung der linksatrialen Funktion in der SAHA-Gruppe. Speckle-Tracking-basierte Strain-Analysen zeigten, dass mit SAHA die Kontraktilität, verglichen mit der Placebogruppe, deutlich verbessert war (Abb. 1). Invasiv gemessene Herz- und Lungendrücke zeigten, dass der linksventrikuläre Füllungsdruck (LVEDP, Goldstandard für die Diagnosestellung) und die pulmonal-arteriellen Drücke mit SAHA deutlich gesenkt werden konnten. Des Weiteren wurde die isovolumetrische Relaxation (tau) beschleunigt. Eine pharmakologische Stresstestung mit Dobutamin wurde durchgeführt, um die Veränderungen unter Belastung zu beurteilen. Mit Dobutamin kam es in der Placebogruppe zu einer deutlich geringeren Zunahme von dP/dtmax im Vergleich zur SAHA-Gruppe, was für eine eingeschränkte Kontraktilitätsreserve spricht und auch bei Patienten mit HFpEF häufig beobachtet wird. Als Mechanismus für die verbesserte diastolische Funktion (Relaxation) wurde eine neue, nicht-genomische Regulation der myofibrillären Relaxation durch HDAC-Inhibitoren entdeckt. In weiterer Folge wurde die Lungenfunktion untersucht, um zu sehen, ob die verbesserte Hämodynamik in der SAHA-Gruppe auch einen Einfluss auf die Lungenfunktion hat. SAHA zeigte eine eindeutige Verbesserung der Lungenfunktion durch eine Erhöhung der pulmonalen Compliance und durch verbesserten Gasaustausch (paO2/FiO2). Histomorphometrische Analysen wurden durchgeführt, um zu untersuchen, ob die verbesserte Lungenfunktion mit strukturellen Veränderungen der Lunge assoziiert war. Zum ersten Mal wurden für HFpEF (Placebogruppe) Flüssigkeitsansammlungen um extra-alveoläre Gefäße beschrieben, welche zusätzlich die pulmonale Compliance senken und zu einer weiteren Verschlechterung der gestörten Lungenfunktion führen können. Zusätzlich kam es in der Placebo-HFpEF-Gruppe zu einer Verdickung der alveolären-kapillären Wand und einer Abnahme der alveolären Gasaustauschfläche. In der SAHA-Gruppe waren diese pathologischen Veränderungen deutlich schwächer ausgeprägt bzw. nicht nachzuweisen. Diese Effekte sind wahrscheinlich auf eine Senkung des linksventrikulären Füllungsdrucks und in weiterer Folge des pulmonalvenösen und -arteriellen Drucks zurückzuführen, auch wenn direkte pulmonale Effekte durch SAHA nicht auszuschließen sind.
Bei Patienten mit HFpEF wurde gezeigt, dass die mitochondriale Funktion beeinträchtigt ist und es zu Veränderungen in der Skelettmuskulatur kommt, was zusätzlich zu einer Verschlechterung der körperlichen Belastbarkeit führt. In der vorliegenden Arbeit konnte auch eine Verbesserung der mitochondrialen Aktivität in vitro gezeigt werden. Des Weiteren kam es durch SAHA zu einem prozentuellen Anstieg von Typ-1-Skelettmuskelfasern, welche eine höhere oxidative Kapazität aufweisen als Typ-2-Fasern und bei Patienten mit HFpEF reduziert sind. Mit Hilfe von Proteomics and Acetylomics konnten diese metabolischen Veränderungen auf posttranslationale Modifikationen zurückgeführt werden. Eine Behandlung mit SAHA führte zu deutlichen Veränderungen im Azetylierungsmuster von wichtigen mitochondrialen Enzymen, bei unveränderter Proteinkonzentration.
Resümee
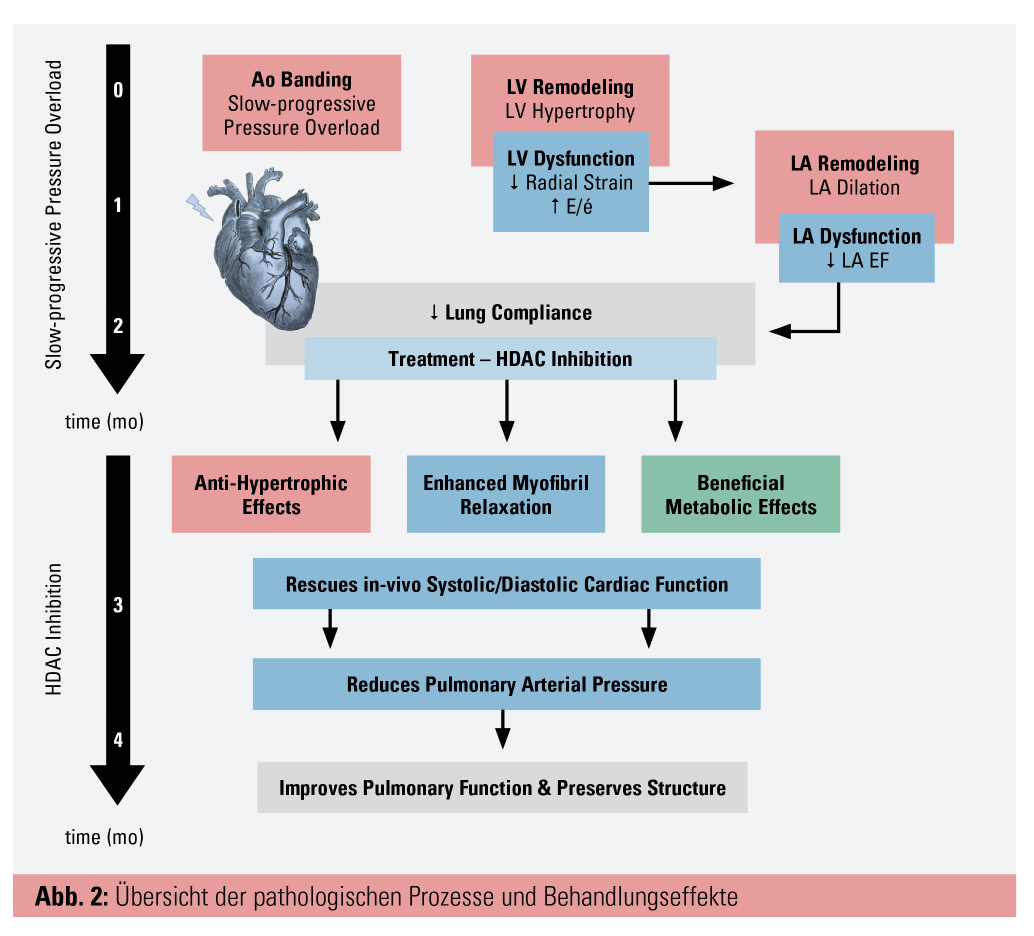
Die vorliegende Arbeit berichtet über die kardiopulmonalen und metabolischen Effekte eines zugelassenen HDAC-Inhibitors in einem experimentellen Großtiermodell für HFpEF. HDAC-Inhibition zeigte starke antihypertrophe Effekte, verbesserte die diastolische und systolische kardiale Funktion, senkte die linksventrikulären Füllungsdrücke und verbesserte die Lungenfunktion. Des Weiteren führte eine Behandlung mit SAHA zu einer Verbesserung der mitochondrialen Funktion, was die kompromittierte Energiebereitstellung bei Herzinsuffizienz wiederherstellen könnte (Abb. 2).
Einige dieser vielversprechenden Effekte von HDAC-Inhibitoren könnten sich auch positiv bei Patienten mit HFpEF auswirken. Neue Therapiekonzepte für HFpEF sind dringend erforderlich, da die Prognose und Lebensqualität von Patienten mit HFpEF schlecht und bis dato noch keine effektiven Therapieoptionen verfügbar sind. Die nun vorliegenden Forschungsergebnisse sind eine wichtige Grundlage, um zukünftig die Effekte von HDAC-Inhibitoren bei Herzinsuffizienz im Rahmen klinischer Studien untersuchen zu können.