Heilung der chronischen Hepatitis C – eine Erfolgsstory
Nach der Entdeckung der Erreger der Hepatitis B (1966) und der Hepatitis A (1973) sowie der Entwicklung von Tests zu deren Diagnose, erkannte man, dass viele Fälle der Posttransfusionshepatitis nicht durch eine Infektion mit einer dieser beiden Viren verursacht wurden. Diese Form wurde Non-A-Non-B-Hepatitis genannt. Der Erreger konnte erst in mühevoller Kleinarbeit durch die Arbeitsgruppe von M. Houghton (San Francisco) 1987 identifiziert werden. Dies wurde zunächst nur in einer Pressekonferenz berichtet und erst 2 Jahre später publiziert.1 Das Virus wurde Hepatitis-C-Virus (HCV) benannt. Ein Antikörpertest für HCV ist seit 1990 verfügbar. Dieser Test (und später die Testung auf HCV durch eine Polymerasekettenreaktion [PCR]) ermöglichte die Testung von Blut- und Blutprodukten und ist heute Standard zur Abklärung der Sicherheit von Bluttransfusionen und von Plasmaprodukten. Seit 1992 ist zumindest in der westlichen Welt die Häufigkeit der Posttransfusionshepatitis C stetig gesunken und liegt heute in Österreich unter 1 bei 2 Millionen Blutkonserven. Die PCR ermöglichte zudem die Klassifizierung unterschiedlicher HCV-Stämme (Genotypen und Subgenotypen). Die häufigsten Genotypen in Österreich sind 1a, 1b und 3a.
Die Therapie im Wandel der Zeit
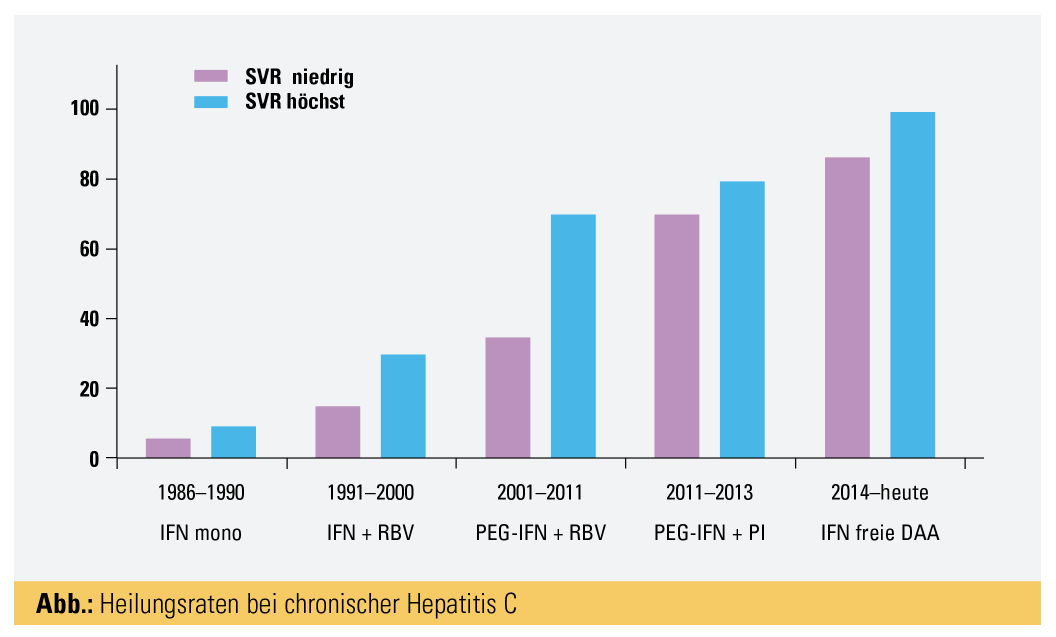
Interferon-α: Die ersten Therapieversuche begannen bereits vor der Identifizierung von HCV. 1986 berichteten Hoofnagle et al.2 über die Therapie mit Interferon-α bei 10 Patienten mit chronischer Non-A-Non-B-Hepatitis: Bei 5 Patienten wurden die Transaminasen normal, stiegen jedoch nach Absetzen meist wieder an. In Wien haben wir bereits 1987 mit der Interferontherapie begonnen. Die ersten randomisiert kontrollierten Studien mit Interferon erbrachten eher enttäuschende Resultate, mit Heilungsraten um 5 % bei 24-wöchiger Therapie und 13–19 % bei einjähriger Gabe. Interferon-α muss täglich s. c. gespritzt werden. Es ist mit beträchtlichen Nebenwirkungen assoziiert und wurde von vielen Patienten sehr schlecht vertragen.
Interferon-α und Ribavirin: Eine deutliche Verbesserung der Ansprechraten brachte die Kombination mit Ribavirin, einem antiviral wirksamen Medikament, dessen genauer Wirkmechanismus bis heute nicht bekannt ist. Ribavirin hat die Nebenwirkungen von Interferon potenziert, insbesondere weil viele Patienten anämisch wurden. Die Heilungsraten stiegen auf 30–38 % bei Patienten mit Genotyp 1 und etwas höher bei Patienten mit Genotyp 2, 3 und 4, bei denen eine 24-wöchige Therapie ausreichte.
Pegyliertes Interferon-α: Der nächste Schritt war die Pegylierung von Interferon-α, wobei zwei unterschiedliche Präparate entwickelt wurden: das 40kD Peg-Interferon-α-2a und das 12kD Peg-Interferon-α-2b. Der Vorteil dieser pegylierten Präparate war, dass diese nur mehr einmal pro Woche verabreicht werden mussten. In Kombination mit Ribavirin wurden Heilungsraten von bis zu 50 % bei Genotyp 1 und bis 75 % bei Genotypen 2 und 3 erzielt. Bereits mit Interferon-α fiel auf, dass bei manchen Patienten bereits nach der ersten Gabe die Viruslast innerhalb von 24 Stunden sehr stark fiel, sich hingegen bei anderen Patienten überhaupt nicht rührte.3
„Response-guided therapy“: Diese Beobachtung führte zur „response-guided therapy“, wobei auf Grund der Geschwindigkeit des Virusabfalls die Therapiedauer zwischen 24, 48 und 72 Wochen variierte.4–6 Bei Patienten mit ungenügendem Virusabfall nach 12 Wochen wurde die Therapie beendet. Die Erklärung für dieses Phänomen wurde durch eine genomweite Assoziationsstudie (GWAS) gefunden.7 Ein Polymorphismus des Gens Interleukin 28b (IL28b) erlaubte, Früh- bzw. Spät-Responder bereits vor Therapiebeginn zu erkennen und die Therapie entsprechend zu planen.
Direkte antivirale Agenzien (DAA): Jahrelang war die Pharmaindustrie bemüht, niedrigmolekulare Substanzen zu entwickeln, die spezifische virale Enzyme hemmen können (DAA). Voraussetzung für die Entwicklung dieser Substanzen war die Entwicklung von In-vitro-Testsystemen, die eine systematische Untersuchung von in Frage kommenden Substanzen erlaubten.8 Das HCV hat zumindest 3 Enzyme, die zur Virusvermehrung nötig sind: die NS3/4-Protease, die NS5B-Polymerase und das NS5A-Protein. Die erste Generation von NS3/4-Proteaseinhibitoren (PI; Telaprevir, Boceprevir) – nur in Kombination mit Peg-Interferon und Ribavirin – kam 2011 in den therapeutischen Einsatz. Mit Erstgeneration-PIs konnten nun Genotyp-1-Patienten behandelt werden, es wurden Ansprechraten von über 70 % erzielt.9 Die beiden Substanzen waren bei anderen Genotypen nicht ausreichend wirksam. Limitiert war diese Tripletherapie mit noch stärkeren Nebenwirkungen, sogar Todesfälle wurden beobachtet. Ein besonderes Problem war auch die Entwicklung PI-resistenter Virusmutanten. Daher wurden bessere PI mit weniger Nebenwirkungen entwickelt (Simeprevir, Faldaprevir, Danoprevir, Asunaprevir), die auch in Kombination mit Peg-Interferon und Ribavirin gegeben wurden. Obwohl diese PI später mit anderen DAA erfolgreich kombiniert wurden, kommen diese in Österreich heutzutage in der Therapie nicht mehr zur Anwendung; es werden nur mehr die neuesten PI (Glecaprevir, Grazoprevir, Voxilaprevir) in Kombination mit anderen DAA verschrieben.
Der große Durchbruch gelang 2013 mit der Entdeckung des NS5B-Polymeraseinhibitors Sofosbuvir (SOF). Heute wird SOF mit NS5A-Inhibitoren (Daclatasvir, Ledipasvir, Velpatasvir)10–12 kombiniert. Eine zweite, heute viel verwendete Kombination ist Glecaprevir mit Pibrentasvir (ein NS5A-Inhibitor).13 Diese Kombinationen sind heute der Therapiestandard, müssen nur mehr für 8–12 Wochen gegeben werden, haben praktisch keine ernsten Nebenwirkungen und erzielen Heilungsraten von über 95 %.14 Sie können auch bei Patienten mit kompensierter Zirrhose und bei Patienten vor und nach Lebertransplantation zum Einsatz kommen. Vorsicht ist geboten bei Patienten mit dekompensierter Leberzirrhose (keine PI!) und bei Patienten mit chronischem Nierenversagen (Vermeidung von SOF). Ansonsten ist die Therapie unproblematisch und bedarf keinerlei Kontrollen unter Therapie. Mit der Verfügbarkeit dieser hochpotenten antiviralen Therapien ist es heute das Ziel der WHO, das HCV weltweit bis 2030 zu eliminieren. Wenn dieses Ziel erreicht werden soll, müssen spezifische Maßnahmen in jedem Land ergriffen werden, um infizierte Patienten zu erkennen und zu behandeln, aber auch um die Übertragung des Virus zu verhindern.
18, J Hepatol 2018; 69:461–511