HIV und Niere – Nephrologische Veränderungen in Zusammenhang mit Infektion und Therapie
Seit Einführung der kombinierten antiretroviralen Therapie (HAART – Highly Active Antiretroviral Therapy) 1996 hat sich die Prognose HIV-positiver Patienten deutlich verbessert. Weiterhin fehlen jedoch Impfungen, sodass eine Bewältigung des globalen Problems nur durch den breiten Einsatz antiretroviraler Substanzen und/oder Prophylaxe zu erreichen ist. In Österreich dürften ungefähr 8.000 Menschen mit HIV/AIDS leben,
wobei die Zahl der Neuinfektionen in den letzten Jahren wieder steigend war. Ein Zunahme
der Neuinfektionen war vor allem bei Menschen mit heterosexueller Orientierung zu beobachten. Die hauptsächlichen Transmissionswege sind nach wie vor ungeschützter
Geschlechtsverkehr, Austausch von Spritzenutensilien bei intravenösem Drogenabusus sowie die vertikale Transmission von der HIV-positiven Mutter auf das Kind. Das
Risiko einer Infektion durch Blutprodukte ist durch Testung mittels PCR als äußerst gering einzuschätzen, der alltägliche Umgang mit HIV-positiven Menschen stellt kein erhöhtes Infektionsrisiko dar.
Bedingt durch das längere Überleben HIV-positiver Patienten werden vermehrt nephrologische Probleme beobachtet. In einer cross-sektionalen Untersuchung fand sich
bei 4 % der Patienten eine mittelgradig eingeschränkte Nierenfunktion (Chronic Kidney
Disease – CKD 3). Spezifische Risikofaktoren sind Alter, niedrige CD4-Zahl sowie Therapien mit Tenofovir und Indinavir.
In Europa waren laut ERA-EDTA-Register (European Renal Association – European Dialysis and Transplant Association) 1990 0,12 % der Patienten mit Dialyse oder
einem Nierentransplantat HIV-positiv. Eine rezente europäische Untersuchung zeigte
einen Anstieg der prävalenten HIV-positiven Patienten mit Nierenersatztherapie auf 0,46
%. In den letzten Jahren ist es zu einer Verschiebung der HIV-positiven Populationen mit terminaler Niereninsuffizienz gekommen. Eine Zunahme ist bei über 45-Jährigen, bei
Frauen und bei Kaukasiern zu beobachten, während bei Afroamerikanern ein Rückgang beschrieben wurde.
Moderne Therapieder HIV-Infektion
Durch die moderne antiretrovirale Therapie (HAART), welche immer eine Kombinationstherapie aus mehreren Wirkstoffklassen darstellt, ist die HIV-Infektion zu einer gut behandelbaren Erkrankung geworden. Die heute eingesetzten Substanzen gehören vier Gruppen an: 1. Nukleosidische/nukleotidische Reverse-Transkriptase-Inhibitoren, nicht-nukleosidische Reverse-Transkriptase-Inhibitoren, 2. Proteaseinhibitoren, 3. Entry- Inhibitoren, 4. Integraseinhibitoren. Ziel der HAART ist eine konstante Suppression der Virusreplikation und damit in weiterer Folge eine Immunrekonstitution (Wiederanstieg, Stabilisierung bzw. Normalisierung der CD4-Zellzahl).
Nierenerkrankungen bei HIV-positiven Patienten
Die Niere wurde schon früh in der Geschichte der HIV-Forschung als ein Ziel der HIV-Schadenswirkung identifiziert. Nierenerkrankungen stellen neben der Immunsuppression bei AIDS die bei weitem häufigste gefährliche Folge der HIV-Infektion dar. Eine eingeschränkte Nierenfunktion ist ein unabhängiger Prädiktor für Mortalität bei diesen Patienten.
Im Rahmen einer HIV-Infektion kann eine Vielzahl von Nierenstörungen auftreten. Bedingt durch das insgesamt längere Überleben von HIV-infizierten Patienten wird auch das Thema von (HIV-assoziierten) Eigennierenerkrankungen ein zunehmendes Thema für Nephrologen.
Akutes Nierenversagen: Die Ursachen für ein akutes Nierenversagen bei HIV-positiven
Patienten sind vergleichbar mit jenen bei HIV-negativen Patienten. Häufig findet sich eine akute Tubulusnekrose bedingt durch Sepsis, Dehydratation, Hypotension oder
Nephrotoxizität.
Nephrotoxische und metabole Langzeiteffekte der HAART: Insgesamt verbessert die HAART die glomeruläre Filtrationsrate, ist aber potenziell nephrotoxisch, sodass vor Therapiebeginn und unter Therapie regelmäßige Kontrollen der Nierenfunktion durchzuführen sind. Unter den antiviralen Substanzen sind vor allem Nukleotid- und Nukleosidanaloga durch Nephrotoxizität gekennzeichnet und bedingen primär eine Tubulopathie. Klinisch können ein akutes Nierenversagen, ein Fanconi-Syndrom, ein nephrogener Diabetes insipidus, eine Hypokaliämie und -magnesiämie oder eine interstitielle Nephritis beobachtet werden. Bei 65 % der Patienten, die
z. B. mit Tenofovir behandelt werden, entwickelt sich innerhalb von 5 Jahren eine Tubulopathie, initial noch ohne Anstieg des Serumkreatinins. Regelmäßige Kontrollen von
Serumphosphor, Proteinurie und Harnglukose können derartige Veränderungen frühzeitig
detektieren. Nukleosidanaloga bedingen ein sekundäres Defizit von Enzymen in der
mitochondrialen Atmungskette und es kann, bedingt durch eine Laktatüberproduktion, zu
einer Hyperlaktatämie kommen. Eine weitere Nebenwirkung der HAART kann das Auftreten einer Rhabdomyolyse sein und zum akuten Nierenversagen führen. Besondere Vorsicht ist daher bei der Kombination mit Statinen geboten.
Innerhalb der Proteaseinhibitoren ist Indinavir der Vertreter mit dem größten nephrotoxischen Potenzial. Die Substanz wird partiell tubulär sezerniert und ist bei saurem pH schlecht löslich. Es findet sich eine Kristallurie mit Steinbildung in den ableitenden Harnwegen und kann Ursache für Obstruktionen und Koliken sein. Die Kristallbildung wird durch Dehydratation gefördert, somit ist auf eine adäquate Flüssigkeitszufuhr zu achten.
HIV-assoziierte Nierenerkrankungen: Bereits 1994 wurde die HIV-assoziierte Nephropathie (HIVAN) bei AIDS-Patienten beschrieben. Sie stellt mittlerweile eine eigenständige, histologisch definierte Glomerulopathie dar (kollabierende fokal-segmentale Glomerulosklerose). Frühzeitig findet sich eine Proteinurie, das Auftreten einer Mikroalbuminurie scheint ein Frühmarker für diese Entität zu sein, gefolgt von einer raschen Verschlechterung (Monate!) der Nierenfunktion. Die klassische HIVAN tritt aber fast isoliert (> 90 %) bei der schwarzen HIV-positiven Population auf und ist unabhängig vom Krankheitsstadium. Therapeutisch – große kontrollierte Studien fehlen allerdings – kommen allgemeine nephroprotektive Maßnahmen
zum Einsatz wie z. B. die Gabe von ACE-Hemmern oder Angiotensinrezeptorblockern. Bei Kindern konnte mittels Therapie mit Cyclosporin A eine Reduktion der Proteinurie
erreicht werden. Einen hohen therapeutischen Stellenwert nimmt allerdings die HAART ein, da es seit Einführung der Kombinationstherapie zu einem deutlichen Rückgang der HIVAN gekommen ist.
HIV-assoziierte Immunkomplexglomerulonephritiden: Diese treten hauptsächlich bei der nicht-schwarzen Population auf. Besonders häufig finden sich eine IgA-Nephropathie,
membranöse und membranoproliferative Glomerulonephritiden, mit dem klinischen Leitsymptom der Proteinurie und/oder Mikrohämaturie sowie mitunter einem nephritischen Harnsediment. Die Prävalenz dieser Erkrankungen wird in der kaukasischen HIV-positiven
Population zwischen 5,6 % und 32 % angegeben und ist in jedem Fall höher als bei HIV-negativen Menschen. Koinfektionen mit Hepatitis B oder C erhöhen das Risiko für die Entwicklung einer Immunkomplexglomerulonephritis. Der Verlust der Nierenfunktion verläuft deutlich langsamer als bei HIVAN. Die Therapie entspricht weitgehend jener HIV-negativer Patienten. Der Einsatz von immunsuppressiven Substanzen kann im Einzelfall vor allem bei negativer HI-Viruslast und normaler CD4-
Zellzahl erwogen werden.
Andere Glomerulopathien: Die HIV-assoziierte thrombotische Mikroangiopathie wurde vor allem in der Prä-HAART-Ära beschrieben, stellt aber bei der nicht mit HAART behandelten Population ein hohes Risiko für ein terminales Nierenversagen dar. Weiters wurden gehäuft Amyloidosen, fibrilläre Glomerulonephritiden, lupusähnliche Nephritiden und interstitielle Nephritiden beschrieben. In Europa stehen aber die IgA-Nephropathie,
die diabetische Nephropathie und die Nephroangiosklerose im Vordergrund als Ursachen für Nierenerkrankungen bei HIVpositiven Patienten.
Sinnvolles nephrologisches Management
Bereits bei Diagnosestellung einer HIV-Infektion sollte die Nierenfunktion gemessen
und der Harn in Hinblick auf das Vorliegen einer Proteinurie/Albuminurie untersucht
werden. Bei bereits initial eingeschränkter Nierenfunktion (eGFR < 60 ml/min) und/oder Proteinurie sollte eine nephrologische Vorstellung erfolgen. Patienten mit einem erhöhten Risiko für eine chronische Nierenerkrankung, wie z. B. Diabetiker, Hypertoniker, Afroamerikaner, CD4-Zellzahl < 200/mm3, hohe HI-Viruslast, Hepatitis C, sollten jährlich untersucht werden. Bei Patienten unter einer Tenofovir-Therapie sind 3-monatliche Kontrollen empfohlen. Hier muss auch ein Screening in Hinblick auf Vorliegen einer tubulären Dysfunktion (Messung von Bikarbonat, Kalium, Phosphat, Harnsäure) 1- bis 2-mal jährlich durchgeführt werden.
Bei Vorliegen einer Proteinurie und/oder eingeschränkter Nierenfunktion und unklarer Nierenerkrankung sollte eine Nierenbiopsie erfolgen, um den Patienten eventuell einer
spezifischen Therapie zuzuführen.
Was tun bei terminaler Niereninsuffizienz?
Bedingt durch das längere Überleben kommt es häufiger zum Auftreten einer terminalen
Niereninsuffizienz, wodurch die Frage der idealen Nierenersatztherapie an Bedeutung
gewinnt.
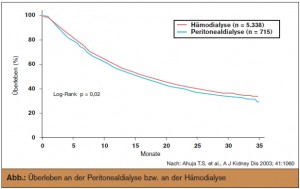
Dialyse: Mittels neuer antiviraler Therapien hat sich das Überleben von HIV-positiven
Patienten an der Dialyse deutlich verbessert. Das Überleben ist an der Peritonealdialyse
und an der Hämodialyse vergleichbar (Abb.). Auch in Hinblick auf die Hospitalisierungsrate
ergibt sich kein Unterschied zwischen den zwei Verfahren.
Obwohl sich das Überleben HIV-positiver Patienten an der Dialyse verbessert hat, sind zum Zeitpunkt des Ablebens HIV-positive Patienten signifikant jünger verglichen mit
HIV-negativen Patienten. Dementsprechend findet sich auch ein anderes Spektrum an
Todesursachen (AIDS 49 %, Infektionen 6 %, kardiale Ursachen 17 %, unbekannt 28 %).
Übertragungsrisiko an der Dialyse: Eine Isolierung von HIV-positiven Patienten an der
Hämodialyse ist im Vergleich zu Hepatitis-B- und Hepatitis-C-positiven Patienten nicht notwendig. Hygienische Routinemaßnahmen und ein achtsamer Umgang mit Blut und Flüssigkeiten reichen aus, um eine Ausbreitung von HIV in einer Dialysestation zu verhindern. Eine Übertragung von Patient zu Patient ist bislang in Institutionen
mit strengen Hygienestandards noch nicht berichtet worden. Standarddesinfektion und Sterilisation sind ausreichend, um eine Übertragung zu verhindern, weshalb
HIV-positive Patienten keine eigenen Dialysegeräte benötigen. Bei den momentan
verwendeten Dialysemembranen kommt es zu keinem Übertritt von HI-Viren ins Ultrafiltrat.
Bei HIV-positiven Peritonealdialysepatienten ist zur Oberflächenreinigung eine Standard-
Desinfektion ausreichend. In der Peritonealdialysatflüssigkeit konnten jedoch replikationsfähige HI-Viren nachgewiesen werden. Der Peritonealdialyseauslauf sollte
deshalb für 30 Minuten mit einer desinfizierenden Lösung behandelt werden. Die
Entsorgung der Flüssigkeit sowie der Beutel und der Schlauchsysteme erfolgt in den
Sondermüll.
Nierentransplantation: Noch bis vor einem Jahrzehnt war eine Nierentransplantation bei
HIV-positiven Patienten undenkbar. Aber auch hier hat die HAART-Therapie zu einem Umdenken geführt. Bei Patienten mit einer CD4-Zahl > 200/mm3 und einer HI-Viruslast
< 50 copies/ml, bei Fehlen sonstiger Kontraindikationen, sollte die Möglichkeit einer
Nierentransplantation angedacht werden. Die Langzeitergebnisse hinsichtlich Patienten-
und Transplantatüberleben liegen bei HIV-Patienten unter denen HIV-negativer Patienten, jedoch stellt diese Form der Nierenersatztherapie eine vielversprechende
Option bei HIV-positiven Patienten dar. Vorsicht ist geboten, da es häufiger zu Abstoßungsreaktionen kommt, teilweise bedingt durch Interaktion von immunsuppressiven
Substanzen und HAART.
FACT-BOX
Die HIV-Infektion stellt eine Herausforderung für den Nephrologen dar. Es kann infektions- und therapiebedingt zu einer Vielzahl nephrologischer Veränderungen kommen, sodass eine enge Zusammenarbeit von HIV-Spezialisten und Nierenfachärzten notwendig ist.