Hohes Blutungsrisiko und DOAK-Therapie
Direkte orale Antikoagulanzien (DOAK) sind zunehmend Teil der klinischen Behandlungspraxis und verdrängen Vitamin-K-Antagonisten (VKA). Bei Patienten mit erhöhtem Blutungsrisiko wird allerdings oft reflektorisch von der Gabe einer Blutverdünnung Abstand genommen, ohne das Thromboserisiko miteinzukalkulieren. Die Entscheidung, wann und in welcher Dosierung dosiert werden darf, ist bei häufig multimorbiden Patienten, bei denen viele Faktoren zu berücksichtigen sind, schwierig zu fällen. Ein österreichisches Konsensuspapier1 gibt einen Überblick über die verschiedentlich exponierten Risikogruppen und versucht, auf Basis der zu Verfügung stehenden Daten, Therapieentscheidungen in der Praxis zu erleichtern bzw. zu ermöglichen.
Die zunehmende DOAK-Verabreichung hat vor allem 3 Gründe:2
- ein besseres Nutzen-Risiko-Profil (insbesondere im Sinne von weniger intrakraniellen Blutungen)
- eine besser vorhersagbare Wirkung ohne stetes Monitoring
- weniger Interaktionen mit Lebensmitteln und anderen Medikamenten
Die derzeit verfügbaren DOAK sind Dabigatran, ein direkter Thrombin-Inhibitor, sowie Apixaban, Edoxaban und Rivaroxaban, die ihre Wirkung über eine direkte Hemmung des Faktors Xa entfalten.
Momentan existieren zwei Hauptindikationen zur Verwendung von DOAK: Behandlung und Sekundärprävention von VTE und Behandlung von nichtvalvulärem Vorhofflimmern (VHF).
Bei valvulärem VHF sind DOAK nicht indiziert. Im Folgenden sollen Aspekte aus dem bereits erwähnten Konsenspapier wiedergegeben werden, um einen Über- und Einblick zu einzelnen Patientengruppen mit hohem Blutungsrisiko zu ermöglichen, die für die klinische Praxis besondere Bedeutung haben. In diesem Zusammenhang erwähnenswert sind die 2018 publizierten Leitlinien der EHRA2 (European Heart Rhythm Association) zur DOAK-Therapie bei VHF.
Chronische Niereninsuffizienz
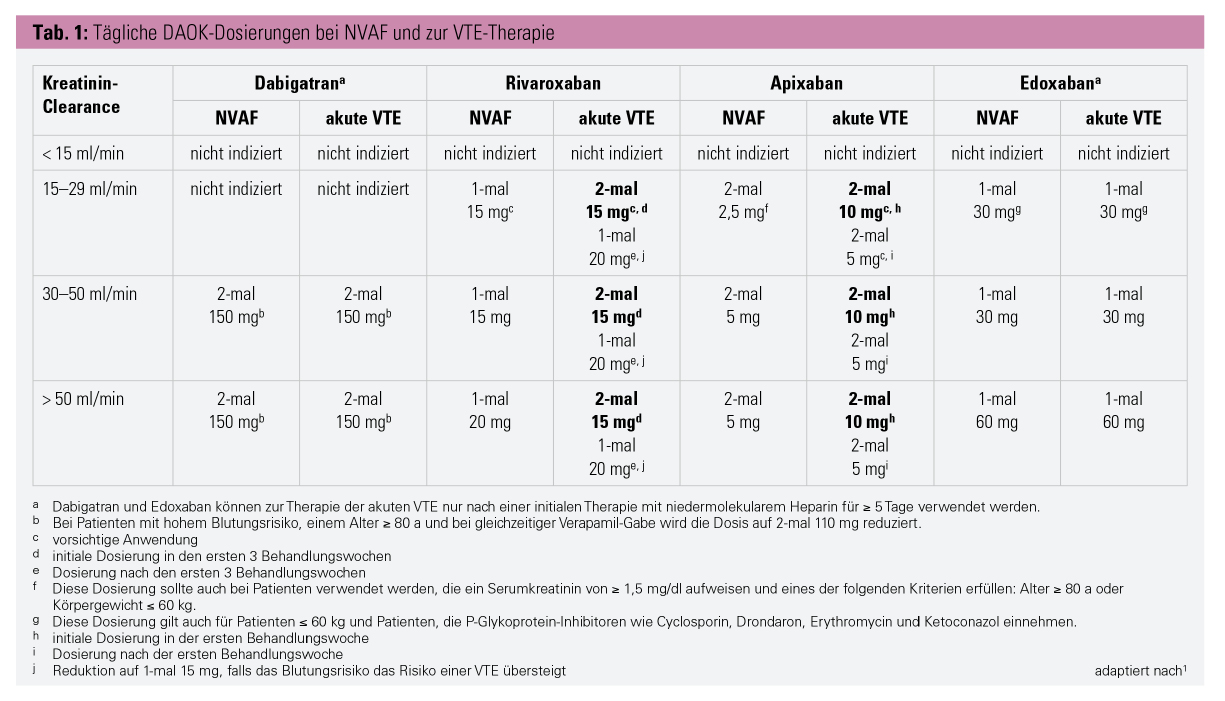
Für Patienten mit chronischer Niereninsuffizienz (CNI) gilt allgemein, dass die empfohlenen Dosierungen eingehalten werden sollten, wie sie in Tabelle 1 zu finden sind. In der klinischen Praxis stellen sich allerdings einige Fragen: Welche Formel wird zur Berechnung der geschätzten glomerulären Filtrationsrate (eGFR) angewendet? Wie oft muss die eGFR kontrolliert werden? Und sollten DOAK bei schwerer Niereninsuffizienz (< 30 ml/min; Stadium 4) überhaupt verwendet werden?
Oft wird zur Berechnung der eGFR die Cockroft-Gault-Formel verwendet, die allerdings bei CNI nur bedingt aussagekräftig ist, da sie bei einer GFR < 60 ml/min zu hohe eGFR-Werte errechnet. Seit Publikation der letzten Kidney Disease Improving Global Outcome-(KDIGO-)Guidelines wird daher eine andere Formel, die CKD-EPI-(Chronic Kidney Disease Epidemiology Collaboration-)Formel, zur eGFR-Berechnung empfohlen.3
Zur Dosisanpassung im klinischen Bereich sollte dennoch die Cockroft-Gault-Formel angewendet werden, da sie auch in den großen DOAK-Studien verwendet wurde. Die Autoren des vorgestellten Konsenspapieres kommen allerdings zu dem Schluss, dass zur Dosisanpassung der DOAK grundsätzlich das Stadium der CNI und nicht die eGFR herangezogen werden sollte.
Monitoring: Die renale Funktion sollte regelmäßig überwacht werden. Die Monitoring-Intervalle hängen von der Stabilität der Nierenfunktion und anderen Faktoren ab, die einen negativen Einfluss haben können (interkurrierende Faktoren). Als allgemeine Regel gilt, dass das Monitoring-Intervall (in Monaten) durch Division der GFR durch den Divisor „10“ berechnet werden kann; der Quotient zeigt das Intervall in Monaten: Liegt die GFR z. B. bei 40 ml/min, gilt 40/10 = 4; demnach sollte in diesem Fall die Nierenfunktion zumindest alle 4 Monate kontrolliert werden.
Hohes Alter (> 80 Jahre)
Mit fortschreitendem Lebensalter kommt es gehäuft zu pathophysiologischen Veränderungen, mit denen ein erhöhtes Blutungsrisiko einhergeht. Dazu zählen eine stete Abnahme der Nierenfunktion, aber auch eine beeinträchtigte Leberfunktion. Zusätzlich führen ein erhöhtes Sturzrisiko und Osteoporose zu einem höheren Frakturrisiko. Eine Studie mit 225 gebrechlichen Bewohnern (Frailty-Index > 5) eines Pflegeheims kam zu dem Ergebnis, dass dieses Patientenkollektiv zwar ein relativ geringes Blutungs-, aber gleichzeitig ein hohes Thromboserisiko aufweist. Dennoch waren in dieser Studie nur 20 % der untersuchten Patienten adäquat antikoaguliert.4
Dabigatran ist das einzige DOAK, dessen Dosierung bei Patienten ≥ 80 Jahren grundsätzlich reduziert wird (2-mal 110 mg bei nicht-valvulärem VHF [NVAF] und VTE). Die Apixaban-Dosierung wird nur bei NVAF-Patienten ≥ 80 Jahren reduziert (2-mal 2,5 mg) und auch nur dann, wenn das Körpergewicht ≤ 60 kg oder das Serumkreatinin ≥ 1,5 mg/dl beträgt. Ein hohes Alter allein stellt weder bei Rivaroxaban noch bei Edoxaban oder bei Apixaban eine Indikation zur Dosisreduktion dar.
Nicht zuletzt muss gerade bei älteren Patienten eine potenziell bestehende Multimedikation in Betracht gezogen werden, wenn eine DOAK-Therapie etabliert wird.
Gerinnungsstörungen
Schwere Formen der Hämophilie, des Von-Willebrand-Syndroms oder anderer Gerinnungsstörungen stellen eine Kontraindikation zur Antikoagulation dar. Ansonsten muss die Entscheidung für oder gegen eine Antikoagulation individuell gefällt werden. Bei der Thrombozytopenie ist ihr Ausmaß entscheidend. Während bei einer Plättchenzahl > 50 G/l eine Antikoagulation angedacht werden kann, ist sie < 20 G/l kontraindiziert. Zwischen diesen Werten sollte die Entscheidung zur Antikoagulation individuell gefällt und als Antikoagulans Heparin in prophylaktischer Dosierung verabreicht werden.
Alternativen zur Antikoagulation: Tritt eine VTE unter sehr hohem Blutungsrisiko auf, kann ein Vena-cava-Filter in Betracht gezogen werden. Analog dazu kann bei Patienten mit Vorhofflimmern, bei denen eine Antikoagulation kontraindiziert ist, der Verschluss des linken Herzohres angezeigt sein.
Akute Blutungen und Operationen
Akute Blutungen verbieten jegliche Form der Antikoagulation grundsätzlich. Tritt umgekehrt aber eine akute Blutung unter bestehender DOAK-Therapie auf, muss zunächst geklärt werden, ob eine Aufhebung der Wirkung (Antagonisierung) erforderlich ist oder ob nur noch niedrige, kaum wirksame Mengen des DOAKs vorhanden sind. Mittlerweile stehen für alle verfügbaren DOAK Antagonisten zur Verfügung. Bei Dabigatran kann zur raschen Eliminierung ebenfalls eine Hämodialyse in Betracht gezogen werden.
Antidots
Mittlerweile sind für alle verfügbaren DOAK Antidots zugelassen. Dabigatran wird mittels Idarucizumab antagonisiert, die Faktor-Xa-Inhibitoren mit dem seit 2019 EU-weit zugelassenen Andexanet alpha (EMA-Zulassung). In der REVERSE-AD-Studie benötigten 1,8 % der Patienten eine zweifache Gabe des Antikörpers, um die Wirkung von Dabigatran zu antagonisieren.5
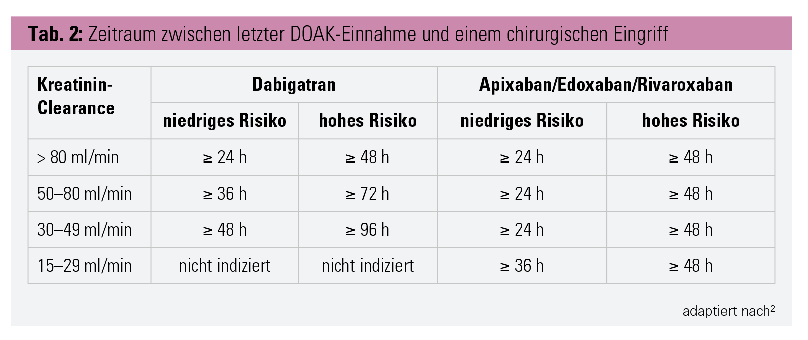
Vorgehen bei chirurgischen Eingriffen: Soll eine OP durchgeführt werden, stellt sich zuerst die Frage, ob es sich um einen elektiven Eingriff handelt. Ist dem so, wird die OP erst durchgeführt, wenn das DOAK ausreichend eliminiert worden ist. Die Zeiträume, die zwischen der letzten DOAK-Einnahme und einem chirurgischen Eingriff mit niedrigem bzw. hohem Blutungsrisiko liegen sollen, hängen von der Nierenfunktion ab und finden sich in Tabelle 2.
Ist ein sofortiger Eingriff erforderlich, wird der DOAK-Plasmaspiegel nach empirischen Werten geschätzt und das DOAK dann dementsprechend antagonisiert. Auch bei einer Akutoperation sollte vor Antagonisierung eine Bestimmung des DOAK-Plasmaspiegels erfolgen. Das Ergebnis wird zwar nicht abgewartet, sondern es wird gleich operiert; allerdings können die bestimmten Werte perioperativ relevante Informationen darstellen.
Antiplättchentherapie bei KHK
In Kombination mit Thrombozytenaggregationshemmern (TAH) finden DOAK aufgrund des geringeren Blutungsrisikos gegenüber VKA auch bei koronarer Herzkrankheit (KHK) zunehmend Verwendung.
Die Dauer einer Dual- oder Tripletherapie (DOAK plus 1 oder 2 TAH) hängt vom Schlaganfalls- und Blutungsrisiko und von der klinischen Situation sowie der Komplexität der potenziell vorangegangenen Koronarintervention ab. Ein Jahr nach einem KHK-Ereignis sollte die Antiplättchentherapie beendet und die DOAK-Gabe als Monotherapie fortgesetzt werden. Momentan wird bei einer Triple-Therapie eine Kombination aus einem DOAK, Acetylsalicylsäure und dem TAH Clopidogrel empfohlen, da Triple-Kombinationen mit Prasugrel bzw. mit Ticagrelor in der TRITON-TIMI-386- bzw. in der PLATO-Studie7 ein erhöhtes Blutungsrisiko zeigten.
DOAK-Therapie und Schlaganfall
Grundsätzlich muss bei Patienten post Insult bzw. transitorischer ischämischer Attacke (TIA) vor Etablierung bzw. vor dem Fortsetzen einer Antikoagulationstherapie eine akute Blutung ausgeschlossen werden.
Nach einer TIA kann die DOAK-Therapie sofort etabliert bzw. fortgesetzt werden, wenn zusätzlich zur Blutung eine ischämische Läsion ausgeschlossen werden kann. Bei einem Schlaganfall kann nach 4 Tagen (nach Blutungsausschluss) die Antikoagulation etabliert bzw. fortgesetzt werden, wenn der NIH-(National Institutes of Health-)Stroke-Scale-Wert bei ≤ 16 liegt; bei einem NIH-Wert > 16 wird 2 Wochen nach dem Ereignis abgewartet. Liegt eine intrakranielle Blutung vor, muss individuell unter Einbeziehung mehrerer klinischer Faktoren entschieden werden, ob und wann eine DOAK-Therapie angewendet werden kann. Ein entsprechender Algorithmus findet sich in den ESC-Guidelines zum Management des Vorhofflimmerns aus dem Jahr 2016.8
Tritt unter OAK eine intrakranielle Blutung auf, die keiner anderen Ursache zuordenbar ist, ist eine Weiterführung der OAK jedenfalls kontraindiziert.
Interaktionen (bei Multimedikation)
Insbesondere bei vorliegender Multimedikation (gleichzeitiger Einnahme mehreren Medikamenten) sind die Interaktionen von DOAK mit anderen Medikamenten (oder auch mit Lebensmitteln) zu beachten. Eine Übersicht über bekannte Interaktionsmöglichkeiten und erforderliche Dosisanpassungen findet sich in den EHRA-Leitlinien.2
Folgende Substanzen können den DOAK-Plasmaspiegel stark erhöhen – Kombinationen sind daher zu vermeiden:
- HIV-Protease-Inhibitoren
- Azol-Antimykotika
Substanzen, die den DOAK-Plasmaspiegel stark senken und daher ebenfalls nicht mit DOAK kombiniert werden sollen, sind:
- einige Antikonvulsive (wie Carbamazepin, Phenobarbital, Phenytoin)
- echtes Johanniskraut
- Rifampicin
Eine Dosisreduktion kann erforderlich sein bei:
- Edoxaban in Kombination mit den P-Glykoproteininhibitoren Cyclosporin, Dronedaron, Erythromycin oder Ketoconazol
- Dabigatran in Kombination mit Verapamil
Dabigatran darf darüber hinaus nicht mit Dronedaron oder mit Immunsuppressiva wie Cyclosporin oder Tacrolimus kombiniert werden.
Daneben sind bei DOAK-Gabe pharmakodynamische Interaktionen möglich mit:
- anderen Antikoagulanzien
- Thrombozyten-Aggregationshemmern
- Glukokortikoiden
- selektiven Serotonin-Wiederaufnahmehemmern (SSRI)