Hot am ASCO 2012
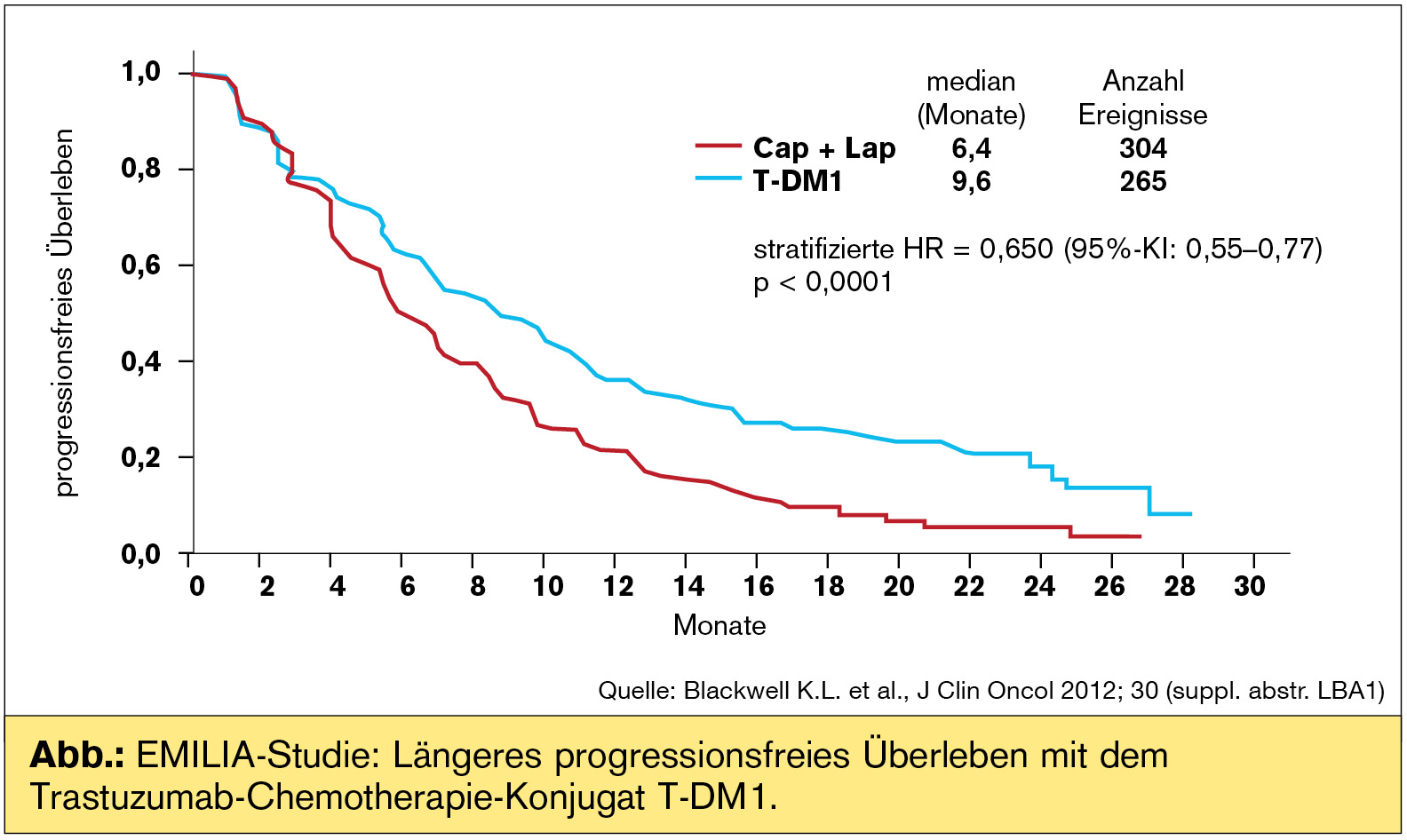
Abstract #1: EMILIA-Studie – targetabhängige Zytotoxizität beim Mammakarzinom
Interessant, am EBCC 8 in Wien war das Late-breaking Abstract #1 eine Studie zur intradermalen Applikation von Trastuzumab, am ASCO 2012 ist es die EMILIA-Studie mit T-DM1, Trastuzumab-Emtansin, einem Trastuzumab-Chemotherapie-Konjugat. Die kovalente Bindung des Zytostatikums DM1 an Trastuzumab erhöht die tumorselektive Zytotoxizität. T-DM1 wurde beim vorbehandelten metastasierten Mammakarzinom gegen Lapatinib-Capecitabin untersucht, der bislang einzigen Immunchemotherapie mit Zulassung in der Trastuzumab-„refraktären“ Situation. Es gab 2 primäre Studienendpunkte, PFS und Gesamtüberleben. In der Auswertung zum progressionsfreien Überleben zeigte sich, dass T-DM1 zu einer signifikanten Verbesserung führt (HR: 0,65; p 65 Jahre. In der gleichzeitig erfolgten Zwischenauswertung zum Gesamtüberleben zeigte sich ebenfalls ein statistisch signifikanter Vorteil (HR: 0,621; p = 0,0005), knapp an der Grenze zum Studienstopp (was bei einer Hazard Ratio von 0,617, p = 0,0003 der Fall gewesen wäre). Nicht zuletzt wurden auch die Ansprechraten um 12 % signifikant verbessert (p = 0,0002). Zusammenfassend bietet sich mit dem weiterentwickelten Trastuzumab ein innovatives „magic bullet“ (frei nach Paul Ehrlich) beim metastasierten Mammakarzinom an und könnte auch in der adjuvanten Situation interessant sein.
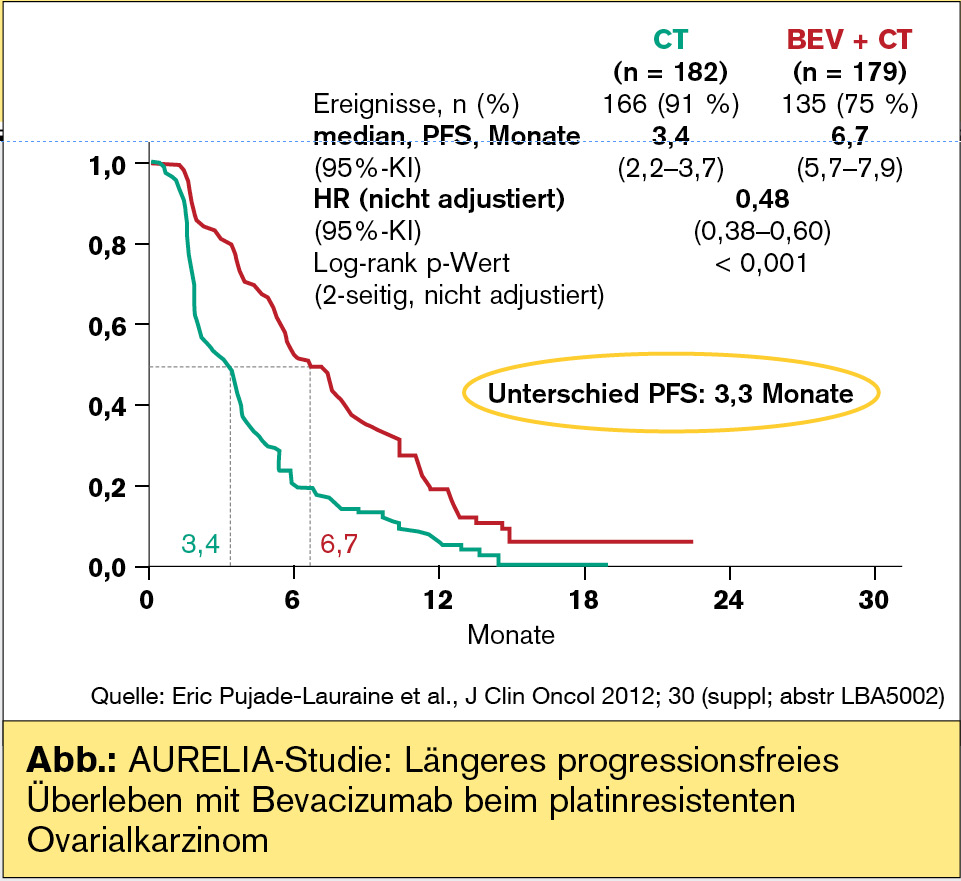
AURELIA-Studie mit Bevacizumab beim platinresistenten Ovarialkarzinom
AURELIA ist die erste prospektiv-randomisierte Phase-III-Studie mit Bevacizumab + Chemotherapie beim platinresistenten Ovarialkarzinom (Eric Pujade-Lauraine et al., J Clin Oncol 2012; 30:[suppl; abstr LBA5002]). Von einer platinresistenten Erkrankung sind beim ersten Rezidiv etwa 25 % der Patientinnen betroffen, im weiteren Verlauf letztlich alle Patientinnen, die in dieser Situation dann zumeist eine Lebenserwartung von weniger als 12 Monaten haben. Es wurde festgehalten, dass Bevacizumab in dieser Indikation vielleicht zu den Substanzen mit der besten Wirkung zählt. Primärer Endpunkt der AURELIA-Studie war das progressionsfreie Überleben. Die meisten Patientinnen waren mit 2 Chemotherapielinien vorbehandelt, die Therapie wurde bis zur Tumorprogression verabreicht und die Wahl des Zytostatikums wurde den Zentren freigestellt (Paclitaxel, Topotecan oder pegyliertes liposomales Doxorubicin).
Im Ergebnis konnte Bevacizumab das progressionsfreie Überleben beinahe verdoppeln, von 3,4 auf 6,7 Monate (HR: 0,48; p < 0,001), was als bisher längstes PFS in dieser Situation beschrieben wurde. Ansprechraten wurden signifikant verbessert und nach RECIST-Kriterien von 11,8 % auf 27,3 % angehoben (p = 0,001). Die Zugabe von Bevacizumab hatte einen positiven Effekt auf tumorassoziierte Symptome und einen negativen Effekt auf ausgewählte Nebenwirkungen der Chemotherapie wie periphere sensorische Neuropathie oder Hand-Fuß-Syndrome (Grad 3), was damit erklärt wurde, dass die Chemotherapieexposition durch Bevacizumab verstärkt wird. AURELIA ist damit die erste Phase-III-Studie beim platinresistenten Ovarialkarzinom, in der eine biologische Therapie einen Benefit erreichen konnte und in der eine Kombinationstherapie besser war als eine Monotherapie. Daten zum Gesamtüberleben werden im Jahr 2013 erwartet.
Hohe Messlatte für BREAK-3: Dabrafenib beim Melanom mit BRAF-Mutation
Nach den Erfolgen mit Vemurafenib und Ipilimumab liegt die Messlatte neuer Therapien nunmehr auch beim Melanom sehr hoch. Der BRAF-Hemmer Dabrafenib wurde in der BREAK-3-Studie gegen Dacarbazin (DTIC) als Referenzsubstanz untersucht. Vorgänger von BREAK-3 ist die bislang noch nicht publizierte BREAK-2-Studie, in der Dabrafenib Ansprechraten von 59 % und ein medianes progressionsfreies Überleben von 6,3 Monaten erzielte. In die aktuelle Studie wurden Patienten mit Stadium-III/IV-Tumoren (stratifiziert nach M1a+M1b, M1c) und BRAFV600E-Mutation 3 : 1 randomisiert, primärer Endpunkt war das progressionsfreie Überleben.
Im Ergebnis konnte der BRAF-Inhibitor Dabrafenib das progressionsfreie Überleben von median 2,9 auf 6,7 Monate verlängern (unabhängige Auswertung, HR: 0,35; p 80 % möglich und ein Gesamtüberleben von > 31 Wochen, was die Ganzhirnbestrahlung bei diesen Patienten möglicherweise obsolet macht. Das selektive Auftreten von Keratoakanthomen und Plattenepithelkarzinomen wurde in 7 % berichtet, Phototoxizitäten in 3 % der Fälle (deutlich weniger als unter Vemurafenib). Die nächsten Schritte sollen darin bestehen, den BRAF-Hemmer in Kombination mit dem MEK-Inhibitor Trametinib zu prüfen, in der Hoffnung, BRAF-Resistenzen mit der Kombinationstherapie besser umgehen zu können. In der Diskussion wurde festgehalten, dass nach langer Zeit frustraner Therapieversuche nunmehr mit Vemurafenib und Ipilimumab lebensverlängernde Substanzen verfügbar sind, was für Dabrafenib in ähnlicher Weise gelten dürfte.
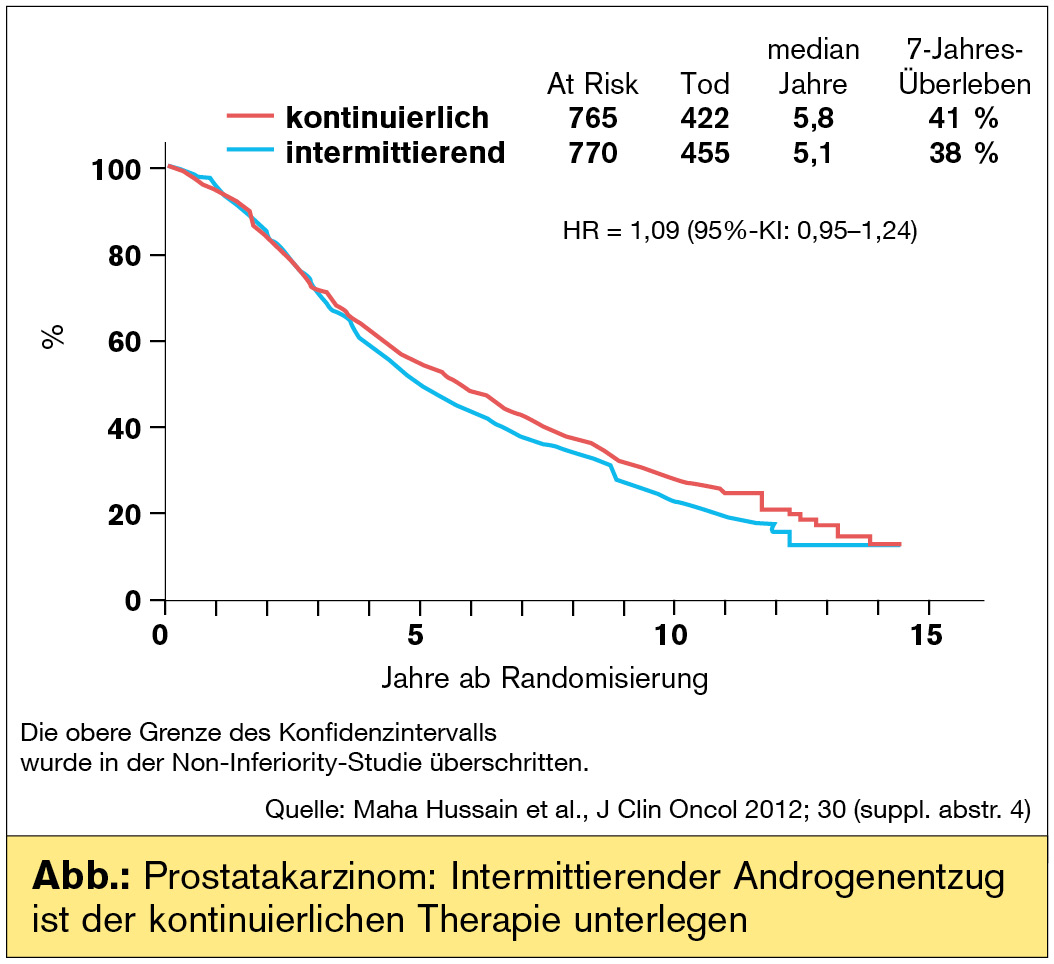
Prostatakarzinom – keine Empfehlung für den intermittierenden Androgenentzug
Standard in der Therapie des hormonabhängigen Prostatakarzinoms in der metastasierten Situation ist die kontinuierliche Androgendeprivation. Vom Konzept der intermittierenden Therapie wurden weniger kardiale oder metabolische Nebenwirkungen erwartet und eine bessere Lebensqualität, was Impotenz, Libido und Vitalität betrifft, interessanterweise auch eine Verzögerung des Fortschreitens der Erkrankung zum kastrationsresistenten (damals noch androgenunabhängigen) Tumor (Akakura, Cancer 1993). So wurde von der Southwest Oncology Group (SWOG) bei Patienten mit neudiagnostiziertem metastasiertem Prostatakarzinom eine Non-Inferiority-Studie zum Vergleich des Gesamtüberlebens unter kontinuierlicher (Standard) vs. intermittierender Therapie aufgelegt, die sekundär auch die PSA-Dynamik und die Lebensqualität evaluierte (Maha Hussain et al., J Clin Oncol 2012;30:[suppl; abstr. 4]). Die Phase-III-Studie wurde bereits im Jahr 1995 initiiert und Anfang 2008 geschlossen. Im ersten Schritt erhielten die Patienten 7 Monate lang eine Induktionstherapie aus Goserelin und Bicalutamid. Bei nach wie vor hohen PSA-Werten wurde die Therapie bis zur Progression weiter verabreicht. Sank der PSA-Wert nach diesem Zeitraum auf normale Werte (< 4 ng/ml), erhielten die Patienten entweder eine kontinuierliche Androgendeprivation oder sie wurden nachbeobachtet. In der Nachbeobachtung wurde der PSA-Wert monatlich gemessen und die Therapie (gemäß der Induktionstherapie) erst dann wieder initiiert, wenn der Wert auf 20 ng/ml anstieg.
Im Ergebnis zeigte sich ein schlechteres Ergebnis für die intermittierende Therapie. Das mediane Gesamtüberleben war mit 5,1 vs. 5,8 Jahren kürzer als im kontinuierlichen Therapiearm. 7-Jahres-Überlebensraten: 38 % vs. 42 %. 455 Todesfälle traten unter intermittierender Therapie auf, 422 bei kontinuierlicher Androgendeprivation. Es gab eine Subgruppe, nämlich Patienten mit „extensiver“ Erkrankung (Rippen, Röhrenknochen, Schädel, innere Organe), bei denen die intermittierende Androgendeprivation nicht unterlegen war. Definitiv schlechter war sie in der Subgruppe von Patienten mit „minimaler“ Erkrankung (Wirbelsäule, Becken, Lymphknoten) (HR: 1,23; p = 0,034). Leider bewahrheitet sich einmal mehr, dass Phase-II-Studien, in denen die intermittierende Therapie überwiegend positiv aufgefallen ist, kein guter Ratgeber für praxisverändernde Konzepte sind. Die Studie steht allerdings auch im Widerspruch zur Phase-III-Studie NCIC-PR7, in der das Gesamtüberleben zwischen beiden Therapiemodalitäten nicht unterschiedlich war. Interessanterweise wurde in der Diskussion auch die Frage gestellt, wie intermittierend das intermittierende Regime eigentlich war, wenn die Patienten zwei Drittel der Zeit unter Androgendeprivation standen? Aber wie auch immer: Es gibt keinen neuen Therapiestandard, nachdem bislang keine randomisierte Studie einen Vorteil für die Intervalltherapie zeigen konnte. Selten deutlich wurde zum Ausdruck gebracht, dass eine Weiterführung des präklinischen Konzepts aus den späten 1980er-Jahren keinen Sinn mehr macht. Einzige Ausnahme: Auf Basis der Studie NCIC-PR7 wurde die intermittierende Therapie in der nichtmetastasierten Situation weiterhin als Option genannt.
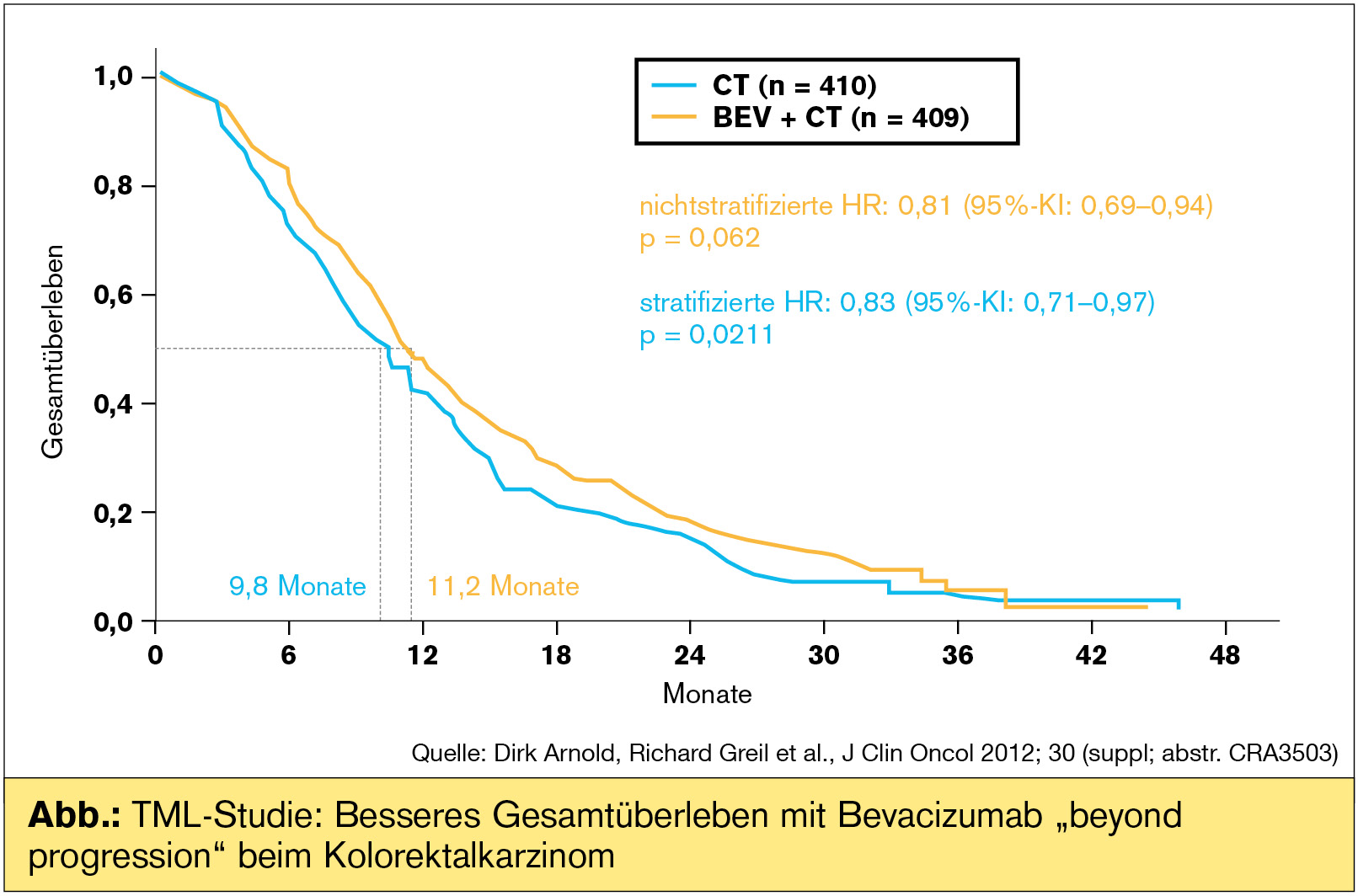
„Beyond progression“: TML-Studie mit Bevacizumab beim Kolorektalkarzinom
Bevacizumab wurde in der Phase-III-Studie TML über die Progression hinaus verabreicht, lediglich die Chemotherapie wurde gewechselt. Es handelt sich um die erste prospektive Evaluierung dieser Therapiemodalität beim Kolorektalkarzinom, an der die Arbeitsgemeinschaft Medikamentöse Tumortherapie (AGMT) mit Professor Richard Greil aus Salzburg beteiligt war. Als präklinische Rationale wurde festgehalten, dass VEGF die Tumorangiogenese kontinuierlich stimuliert, was eine dauerhafte VEGF-Inhibition nahelegt. Im klinischen Setting konnte in der Beobachtungsstudie BRiTE ein längeres Überleben bei jenen Patienten festgestellt werden, bei denen Bevacizumab im Fall einer Tumorprogression beibehalten wurde: medianes Gesamtüberleben 19,2 vs. 9,5 Monate. Der Schluss lag nahe, dass eine Progression auf Chemotherapie noch keine Resistenz auf den VEGF-Antikörper bedeuten muss – was prospektiv zu beweisen war. Bevacizumab wurde in der TML-Studie weitergeführt und als Second-Line-Chemotherapie wurde je nach Vorbehandlung Oxaliplatin (FOLFOX) oder Irinotecan (FOLFIRI) eingesetzt. Primärer Endpunkt war das Gesamtüberleben. Als Hintergrund: Bei etwa 55 % der Patienten war das PFS in der First-Line-Therapie 9 Monate (was aber für das aktuelle Ergebnis keinen Unterschied machte). Ein sehr kurzes First-Line-PFS < 3 Monate war ein Ausschlussgrund für die Studie. Die Dauer der Therapieunterbrechung für Bevacizumab (vor der First- zur Second-Line-Therapie) betrug mehrheitlich weniger als 6 Wochen.
Im Ergebnis war das Gesamtüberleben jener Patienten, bei denen Bevacizumab beyond progression weiter verabreicht wurde, signifikant länger als mit alleiniger Chemotherapie (HR: 0,81; p = 0,0062). Das progressionsfreie Überleben war ebenfalls signifikant länger (HR: 0,68; p < 0,0001). Therapieunterbrechungen waren numerisch höher in der Chemotherapie + Bevacizumab-Gruppe, mehrheitlich aufgrund von Nebenwirkungen der Chemotherapie. Damit verlängert Bevacizumab beyond progression beim Kolorektalkarzinom das Gesamtüberleben und das progressionsfreie Überleben. Die Studie impliziert die Möglichkeit einer Multiple-Line-Therapie, wie sie in ähnlicher Weise mit dem HER2-Antikörper beim Mammakarzinom etabliert ist. In der Diskussion wurde festgehalten, dass die Ergebnisse der randomisierten Studie doch relativ weit hinter den Ergebnissen des BRiTE-Registers liegen (Grothey, J Clin Oncol 2008), was vielleicht noch Diskussionen über den Wert von Beobachtungsstudien nach sich ziehen kann.
Neuer Therapiestandard für ältere Patienten mit indolenten B-Zell-Lymphomen
Da Patienten mit indolenten B-Zell-Lymphomen zumeist in fortgeschrittenem Lebensalter diagnostiziert werden, besteht ein großer Bedarf an wirksamen und gleichzeitig gut verträglichen Therapien. Bis vor einigen Jahren standen hierfür nur wenige Therapieoptionen zur Verfügung. In der diesjährigen Plenarsitzung des ASCO wurde ein Studien-Follow-up der deutschen STiL (Studiengruppe indolente Lymphome), geleitet von Prof. Mathias Rummel, präsentiert.
In der Studie NHL1-2003 wurden 514 Patienten mit verschiedenen indolenten Lymphomen im fortgeschrittenen Stadium (follikuläre Lymphome, Mantelzelllymphome, Patienten mit Morbus Waldenström, Marginalzonenlymphome und kleinzellig-lymphozytische Lymphome) entweder mit R-CHOP oder der Kombination bestehend aus Rituximab plus Bendamustin (R-B) als Erstlinientherapie inkludiert. Als primärer Studienendpunkt wurde eine Nichtunterlegenheit von R-Bendamustin gegenüber R-CHOP definiert. Darüber hinaus sollten die akuten sowie Spättoxizitäten und die Möglichkeit der Stammzellmobilisierung bei jüngeren Patienten untersucht werden.
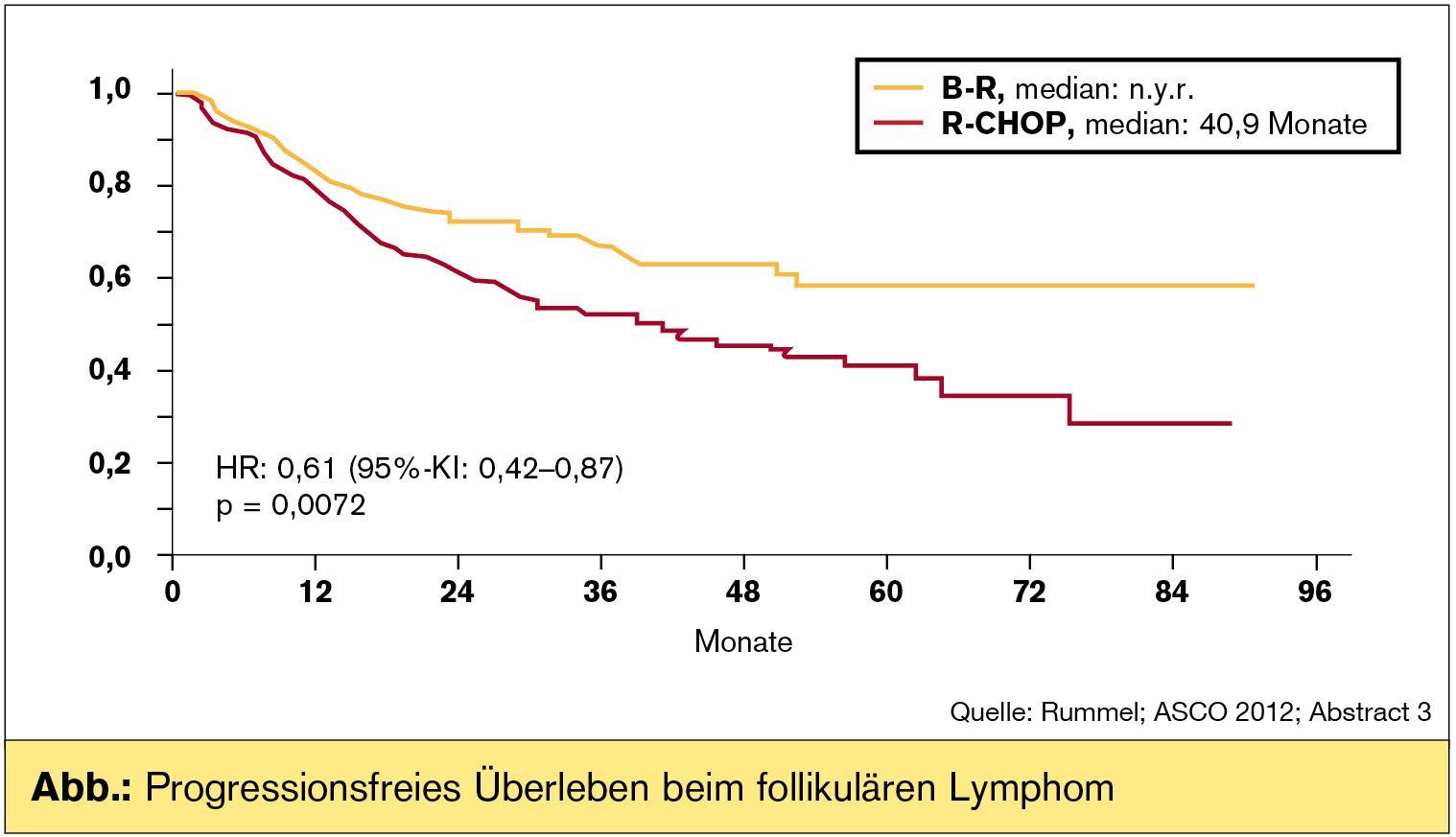
Nach diesem am ASCO erstmalig präsentierten Langzeit-Follow-up von 45 Monaten betrug das mediane progressionsfreie Überleben (PFS) im Bendamustin-Rituximab-Kombinationsarm 69,5 Monate verglichen mit nur 31,2 Monaten im R-CHOP-Studienarm (HR: 0,58, 95%-KI: 0,44; p = 0,0000148). Die Verlängerung des PFS wurde sowohl für die Patientenpopulation mit follikulärem Lymphom (Abb.) als auch für Patienten mit Mantelzelllymphom beobachtet.
In beiden Behandlungsarmen war die Gesamtansprechrate vergleichbar (92,7 % bei R-B, 91,3 % bei R-CHOP). Die Rate an kompletten Remissionen war jedoch signifikant höher bei Patienten, welche mit R-B behandelt wurden (39,8 % vs. 30 % bei R-CHOP; p = 0,021).
Auch hinsichtlich der Verträglichkeit war R-B dem R-CHOP überlegen (signifikant weniger hämatologische Nebenwirkungen vom Grad 3/4, dementsprechend auch weniger infektiöse Komplikationen; keine Alopezie, nur geringe Rate an Polyneuropathien).