Kontroversiell diskutiert: Stellenwert von Oxaliplatin im UICC-Stadium II
Eine oxaliplatinhältige adjuvante Therapie verbessert signifikant die Chance auf Heilung. Dies konnte für das Kolorektalkarzinom im Stadium III durch prospektiv-randomisierte Studien bestätigt werden (MOSAIC, NSABP C-07, Xeloxa).1–4
Weit weniger eindeutig sind die Daten für das nodal negative Karzinom: Die Notwendigkeit einer adjuvanten Therapie per se sowie deren Zusammensetzung wird seit Jahren kontroversiell diskutiert.
Einerseits ist die Prognose mit alleiniger Operation gut, das Rezidivrisiko beträgt maximal 20–25 %, das 5-Jahres-Überleben mehr als 80 %. Durch eine generelle Therapieempfehlung würden viele Patienten eine unnötige, potenziell toxische Chemotherapie erhalten.
Andererseits zeigt die größte prospektivrandomisierte Studie bei nodal negativen Patienten einen statistisch signifikanten, jedoch klinisch nur moderaten Benefit einer 5-FU-Monotherapie. Das Gesamtüberleben konnte absolut um knapp 3 % verbessert werden, die Rezidivrate von 26 % im Kontrollarm auf 22 % im Therapiearm gesenkt werden (QUASAR).5 Die meisten Fachgesellschaften formulieren zurückhaltend, dass bei nodal negativen Patienten eine Fluoropyrimidin- basierte Therapie erwogen werden kann.
Für den Nutzen einer oxaliplatinhältigen Therapie im Stadium II gibt es bis dato keine signifikante Evidenz. In der MOSAIC-Studie (40 % nodal negative Patienten) zeigt sich für die gesamte N0-Population kein Benefit durch FOLFOX, in einer Subgruppenanalyse profitieren Patienten mit Risikofaktoren mit einer absoluten Verbesserung des krankheitsfreien Überlebens (DFS) von 7 % und des Gesamtüberlebens (OS) von 3 %. Aufgrund der geringen Patientenzahl sind die Ergebnisse statistisch nicht signifikant, jedoch als klinisch relevant einzuschätzen.
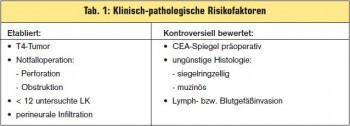
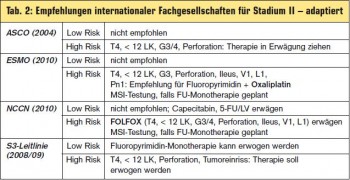
Definition einer High-Risk-Population: Eine Reihe klinischer und pathologischer Parameter (> Tab. 1) bedingt eine ungünstigere Prognose mit einem Rezidivrisiko zwischen 30–40 % ähnlich dem nodal positiver Tumoren. Die Frage nach der Effizienz einer oxaliplatinhältigen Therapie bei dieser Subgruppe wurde nie prospektiv-randomisiert untersucht. Trotzdem besteht weitgehender Konsens, dass bei Vorliegen eines oder mehrerer Faktoren eine adjuvante Chemotherapie mit FOLFOX oder XELOX analog zum Stadium III erwogen werden soll (> Tab. 2).
Mikrosatelliteninstabilität (MSI): Mikrosatelliten- instabilen Tumoren liegen Defekte des DNA-Mismatch-Repair-Systems (dMMR) zugrunde. Eine hochgradige Mikrosatelliteninstabilität (MSI-H) impliziert im Stadium II erstens eine günstigere Prognose und zweitens eine Resistenz gegenüber einer adjuvanten 5-FU-Therapie.6 Für Oxaliplatin sind keine negativen Resultate bei MSI-H-Tumoren bekannt, sodass sich eine MSI-Testung bei geplanter oxaliplatinbasierter Therapie erübrigt.
Oxaliplatin bei älteren Patienten: Etwa 70 % der Erkrankten sind heute älter als 65 Jahre, in naher Zukunft wird ein hoher Prozentsatz über 70 Jahre alt sein. Diese Tatsache findet in klinischen Studien kaum Beachtung, zu den Einschlusskriterien gehört meist eine Altersobergrenze von 65 bzw. maximal 70 Jahren. Die Datenlage für eine adjuvante oxaliplatinhältige Therapie ist daher äußerst dürftig. Während MOSAIC und NSABP C-07 bei älteren Patienten keinen additiven Effekt zeigen, profitieren sie in der XELOXA-Studie (nur nodal positive Patienten) im gleichen Ausmaß wie < 65-Jährige. Eine strenge Nutzen- Risiko-Abwägung ist bei älteren Patienten unumgänglich, umso mehr als häufiger hämatologische und gastrointestinale Nebenwirkungen zu erwarten sind.
FACT-BOX
• Die Entscheidung pro oder contra
adjuvante Therapie bei nodal negativem
Kolonkarzinom stellt eine onkologische
Herausforderung dar.
• Da kein Standard definiert werden kann,
muss die Therapie in Abhängigkeit vom
individuellen Risikoprofil erstellt werden,
das Tumor- und Patientencharakteristika
berücksichtigt.
• Oxaliplatin soll nur bei High-Risk-
Tumoren eingesetzt werden.
• Kritisch ist die Indikation für eine
oxaliplatinbasierte Therapie bei Patienten
mit biologischem Alter > 70 und
Komorbiditäten zu bewerten.
1 André T. et al., N Engl J Med 2004; 350:2343-2351
2 André T. et al., J Clin Oncol 2009; 27: 3109-3116
3 Kuebler J.P. et al., J Clin Oncol 2007; 25:2198-2204
4 Haller D.G. et al., J Clin Oncol 2011; 29:1465-1471
5 Quasar Collaborative Group, Lancet 2007; 370:2020-2029
6 Sargent D.J. et al., J Clin Oncol 2010; 28:3219-3226