Langerhans-Zell-Granulomatose
Die pulmonale Langerhans-Zell-Granulomatose (pulmonale Histiocytosis X, pLHZG) ist eine sehr seltene Krankheit. Exakte Häufigkeitsangaben zur pLHZG fehlen, nicht zuletzt wegen der recht hohen spontanen Regressionsrate. Man geht derzeit von einer geschätzten Inzidenz von 1–2/1.000.000 aus.1 Der deutsche Pathologe Paul Langerhans (1847–88) beschrieb als Erster die für die pathologischen Veränderungen aller Formen verantwortlichen charakteristischen Zellen. 1940 gelang Lichtenstein und Jaffé die Erstbeschreibung einer Knochenmanifestation („eosinophiles Granulom“).2
Epidemiologie: Die pLHZG tritt in unterschiedlichen Formen auf. Während Kinder und Jugendliche vorwiegend von der generalisierten Variante betroffen sind (Kinder < 10 Jahre: Abt-Letterer-Siwe-Krankheit, Kinder > 10 Jahre: Hand-Schüller-Christian-Krankheit), erkranken Erwachsene meist an der pulmonal limitierten Form. Extrapulmonale Manifestationen bei Erwachsenen werden eher selten beobachtet. Die pLHZG betrifft vorwiegend Erwachsene und weist einen Häufigkeitsgipfel zwischen dem 40. und 50. Lebensjahr auf. Das Geschlechtsverhältnis scheint ausgeglichen zu sein.
In den letzten Jahren wurden nach der Publikation von Vassallo et al. von 20023 zwei multizentrische Untersuchungsserien veröffentlicht,4, 5 die unsere Kenntnisse insbesondere zum Krankheitsverlauf und zur Prognose weiter vertieft haben.
Ätiologie und Pathogenese: Das inhalative Zigarettenrauchen bei Erwachsenen scheint ein entscheidender Faktor bei der Krankheitsentstehung zu sein, da nahezu alle Betroffenen Raucher bzw. Exraucher sind. Unklar blieb bislang, welche Komponenten des Zigarettenrauches die Aktivierung der Langerhans-Zellen bewirken. Eine direkte Wirkung des Zigarettenrauchs wird ebenfalls diskutiert. Bei der Häufigkeit des Zigarettenkonsums scheint es, dass nur Personen betroffen sind, bei denen eine genetische Disposition besteht. Roden et al. konnten zeigen, dass bei einigen Patienten mit pLHZG eine BRAF-Mutation besteht.6 Darüber hinaus präsentierten Jouenne et al. aus der Arbeitsgruppe von Tazi eine molekular-genetische Landkarte.7 Diese zeigte, dass neben den BRAF-V600E-Mutationen weitere Mutationen, insbesondere von MAP2K1 („mitogen-activated protein kinase“), vorliegen. Inzwischen konnte bei einigen Patienten mit pLHZG auch eine klonale Proliferation nachgewiesen werden.8
Die Langerhans-Zellen finden sich in der Haut, der Lunge, der Pleura und im retikuloendothelialen System. Sie leiten sich von den dendritischen Zellen ab, exprimieren Oberflächenantigene der MHC-Klassen I und II und werden durch CD1-Moleküle charakterisiert. Die vermehrt gebildeten Zytokine ihrerseits sind zur Akkumulation von Entzündungszellen und zur Granulombildung fähig. So ähneln die Granulome in gewisser Weise auch den Sarkoidosegranulomen, da sie wie diese einen schmalen Lymphozytensaum tragen.
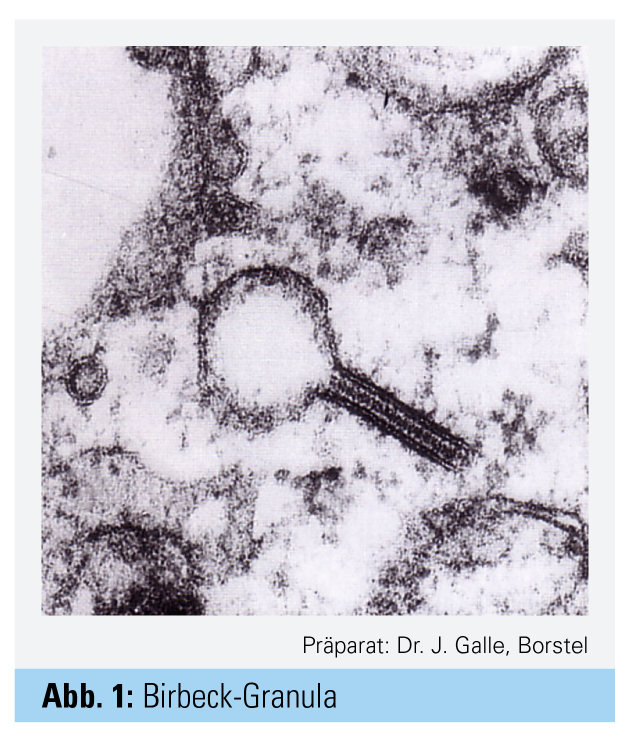
Histologisch erkennt man Granulome mit Langerhans-Zellen und eosinophilen Granulozyten, die lokal alle Komponenten der Lungenstruktur zerstören können. Elektronenmikroskopisch zeigen sich die für die Erkrankung typischen Birbeck-Granula (Abb. 1) oder „x-bodies“. Im histologischen Präparat sind oft mehrere nebeneinander ablaufende Krankheitsphasen (Noduli, Zysten, Fibrose) erkennbar.
In der Initialphase findet man locker angeordnete interstitielle und auch intraalveoläre Infiltrate mit proliferierenden Langerhans-Zellen, dies meist in Verbindung mit eosinophilen Granulozyten. In der zweiten Phase der Erkrankung finden sich oft dicht stehende Herdsetzungen mit Destruktionen von Gefäßen und Bronchien. In der Narbenphase dominieren Fibrozyten mit Makrophagen, Mastzellen und Lymphfollikeln. Diagnostisch hilfreich sind Antikörperfärbungen gegen CD1a, aber auch gegen S-100.
Zusammenfassend geht man aktuell von dem Kenntnisstand aus, dass es sich bei dieser Erkrankung um eine entzündliche und myeloid-neoplastische Erkrankung mit variabler klinischer Ausprägung handelt.9
Symptomatologie: Die Tabelle zeigt die Häufigkeit der Symptome bei pulmonaler LHZG, wie sie bei der deutschen WATL-Studie4 erhoben werden konnten. Typisch ist neben den respiratorischen Symptomen der große Anteil an vegetativer Symptomatik.
Diagnostik: Die Diagnostik umfasst nach Anamnese und klinischer Untersuchung in erster Linie die radiologische Bildgebung. Das entscheidende radiologische Charakteristikum auf der Thoraxübersichtsaufnahme und – naturgemäß noch besser dargestellt – im hochauflösenden Thorax-CT ist das gemeinsame Vorhandensein von größenmäßig unterschiedlichen Noduli und dünnwandigen Lungenzysten. So ist im Anfangsstadium, in dem meistens nur Noduli vorhanden sind, die Differenzialdiagnose zur Sarkoidose besonders wichtig. In aller Regel sind beide Seiten befallen, wobei die Obermittelfelder bevorzugt sind. Radiologisch gibt es, wie bei allen Granulomatosen, eine große Vielfalt im Erscheinungsbild.
Es kommen meist fein disseminierte Herdsetzungen (retikulo-mikronodulär) vor, die dann später gelegentlich auch in größere Konglomerate übergehen. Möglich ist jedoch auch das primäre Auftreten derartiger großer Konglomeratbefunde. Je weiter die Krankheit fortschreitet, desto mehr retikuläre Veränderungen und Einschmelzungen kommen hinzu, die sich als Ringschatten oder zystische Strukturen darstellen („Schrotschussmuster“). Bei charakteristischem Computertomogramm der Thoraxorgane (Abb. 2) und guter klinischer Erfahrung ist es heute in vielen Fällen möglich, auf eine bioptische Sicherung der Diagnose zu verzichten.
Die vorherrschende Lungenfunktionsstörung ist die restriktive Ventilationsstörung, wobei eine zusätzliche obstruktive Komponente aufgrund der Raucheranamnese beobachtet werden kann. Die Hälfte der Patienten zeigt darüber hinaus eine Diffusionsstörung unterschiedlichen Ausmaßes.
Die diagnostische Methode der Wahl – wenn man eine histologische Sicherung anstreben will oder muss – ist gegenwärtig die videothorakoskopische Gewebsentnahme eines oder mehrerer Lungenkeile. Eine BAL wird man in jedem Fall, auch zur Differenzialdiagnose zu anderen radiologisch ähnlichen Erkrankungen, durchführen. Dabei helfen immunzytologische Techniken ebenfalls, wenn die CD1-Antikörper bei > 5 % entdeckt werden können. In Spätstadien ausgeprägter pulmonaler Histiozytosen werden Komplikationen (pulmonale Hypertonie, chronische Cor pulmonale und respiratorische Insuffizienz) häufiger beobachtet.
Extrapulmonale Manifestation bei pLHZG: Die Knochenbeteiligung betrifft in erster Linie die Schädelkalotte. Es kommen jedoch auch Granulome in den Beckenknochen, Rippen und Wirbelkörpern vor. Gelegentlich führt das Auftreten eines Diabetes insipidus bei Infiltration der Schädelbasis zur Erstdiagnose. Das PET-CT ist bei bekannter Diagnose einer pLHZG hilfreich zur Diagnostik derartiger extrapulmonaler Manifestationen.
Therapie: Eine kausale Therapie der Langerhans-Zell-Granulomatose ist nicht bekannt. Die Therapie stützt sich also auf die Erfahrungen und wenigen Sammeldaten dieser Erkrankung.10, 11 Wichtig und u. E. weiterhin unverzichtbar ist die Forderung des Nikotinverzichts angesichts der Bedeutung des Rauchens für gerade diese Erkrankung. Glukokortikoide zeigen bei symptomatischen Formen meist eine gute klinische Wirkung. Eine Indikation zur Kortisonbehandlung besteht besonders bei den nodulären Formen der pLHZG. Die Behandlung wird in Anlehnung an die Sarkoidosetherapie mit ca. 0,5 mg/kg Körpergewicht durchgeführt, monatsweise um 10 mg reduziert und über eine Gesamtdauer von 6 bis 9 Monaten verabreicht. Bei fortgeschrittenen Stadien der Erkrankung versagen die Steroide in aller Regel.
Bei therapierefraktären progressiven Verläufen wird man angesichts der neueren Therapieoptionen eine Genanalyse durchführen, um dann eine zielgerichtete Therapie ggf. mit BRAF- oder MAPK-Inhibitoren off-label durchzuführen.
Die unerwünschten Wirkungen dieser Therapien zwingen immer zu einer Nutzen-Risiko-Abwägung!
Als Ultima-Ratio-Therapie ist auch bei dieser Erkrankung die Lungentransplantation und bei schwerem Cor pulmonale mit irreversiblen Strukturstörungen die Herz-Lungen-Transplantation diskutabel.
Prognose: Die Prognose der pulmonalen HX ist schlechter als die der Sarkoidose, aber deutlich besser als die der idiopathischen Lungenfibrose. Bei ca. zwei Drittel der Patienten kommt es zu einer längerfristigen Remission. Spontanremissionen sind möglich. Eine schlechte Prognose weisen ältere Patienten mit zusätzlicher schwerer obstruktiver Ventilationsstörung und pulmonalem Hochdruck auf.