MIS-C: Neue mysteriöse Krankheit bei Kindern und Jugendlichen
Das Multisystem Inflammatory Syndrome in Children (MIS-C), auch als Pediatric Inflammatory Multisystem Syndrome temporally associated with SARS-CoV-2 (PIMS-TS) bezeichnet, wurde erstmals im April 2020 als hyperinflammatorische Reaktion mit Ähnlichkeiten zur Kawasaki-Krankheit, zum Toxic-Shock-Syndrom und zur hämophagozytischen Lymphohistiozytose beobachtet. Bis Ende Januar 2021 wurden in Österreich 51 Kinder bzw. Jugendliche mit MIS-C behandelt. Die akute SARS-CoV-2-Infektion verläuft bei Kindern meistens mild oder sogar asymptomatisch. Selten, mit einer Inzidenz von ungefähr 2 pro 100.000 Personen unter 21 Jahren, kann es im Schnitt 2 bis 5 Wochen nach akuter Erkrankung an COVID-19 zu diesem lebensbedrohlichen Zustand kommen, der für 70–80 % der Patienten eine Aufnahme auf eine Intensivstation notwendig macht.
Pathophysiologie
Die Pathophysiologie wurde bis jetzt noch nicht vollständig geklärt. Es wird vermutet, dass es zu einer postinfektiösen Immundysregulation im Sinne einer abnormen Immunantwort auf das Virus kommt, mit einer Aktivierung von Entzündungsprozessen durch einen „Zytokinsturm“ sowie durch Bildung von Immunkomplexen und Autoantigenen. Als mögliche Ursache werden genetische Prädisposition und virale Superantigene diskutiert. Rezente Studien zeigten außerdem, dass es im Unterschied zur akuten COVID-19-Erkrankung zur Persistenz von Immunglobulin G mit erhöhter Fähigkeit zur Monozytenaktivierung, zu anhaltenden Zytopenien (insbesondere T-Zell-Lymphopenie) sowie zu einer erhöhten Aktivierung von CD8+-T-Zellen kommt. Letzteres hilft auch zur Unterscheidung vom Kawasaki-Syndrom.
Epidemiologie und Klinik
Die meisten Patienten mit MIS-C sind im Median 8 Jahre alt und präsentieren sich mit Fieber, Zeichen einer generalisierten Entzündung, Hypotonie bis hin zum Schock sowie einer Funktionsstörung mehrerer Organe. Einzelne Fälle von MIS-C im Säuglingsalter wurden beschrieben, wobei weiterhin kein Konsens über die Möglichkeit der vertikalen Transmission von der Mutter auf den Fötus besteht. Zudem wurde dieses Krankheitsbild in Einzelfällen auch bei Erwachsenen beschrieben und als MIS-A (Multisystemic Inflammatory Syndrome in Adults) bezeichnet.
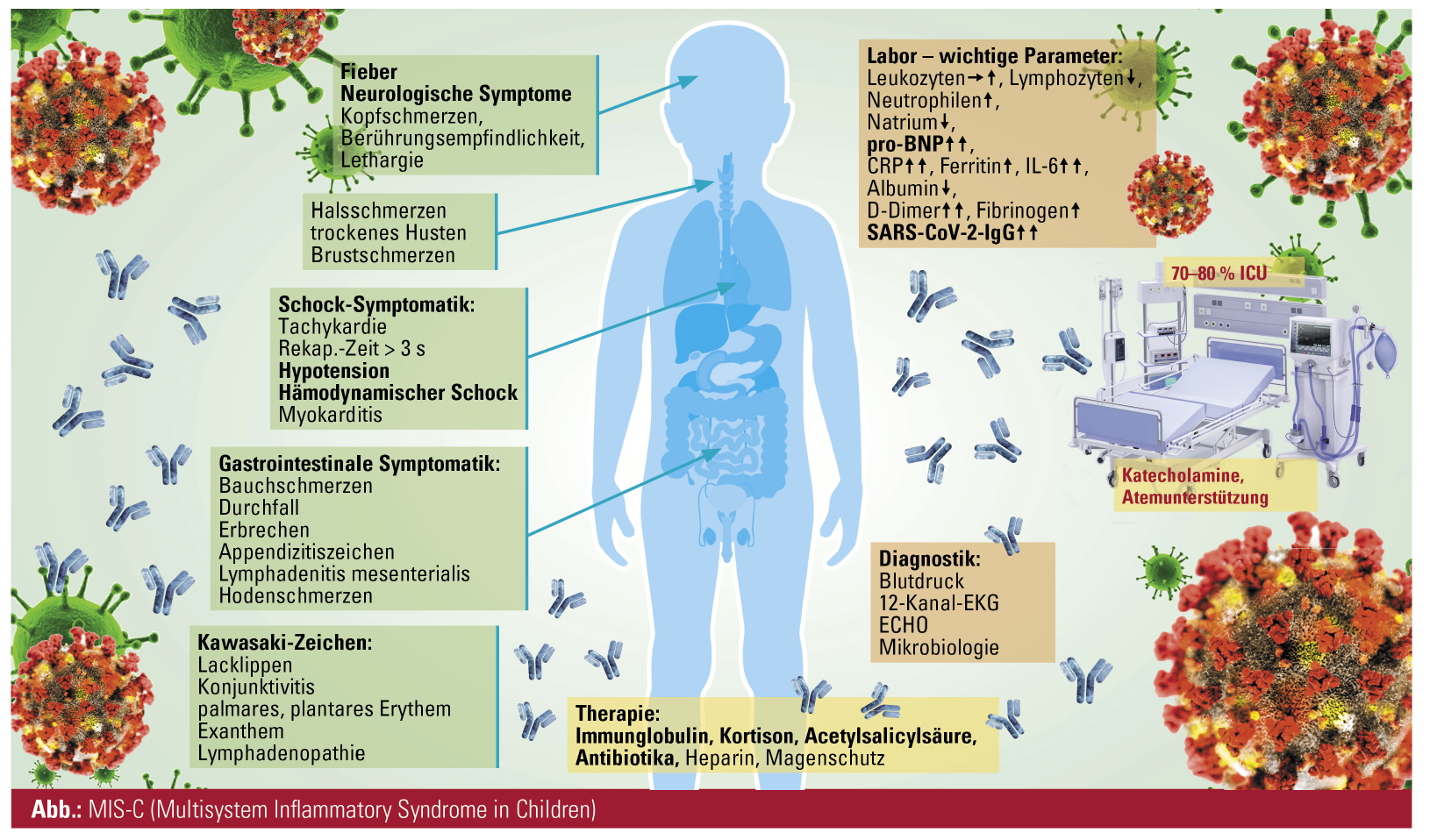
Das klinische Haupterscheinungsbild umfasst bei fast allen Patienten Fieber, meistens über einen Zeitraum von mindestens 3 aufeinanderfolgenden Tagen. Gastrointestinale Symptome, allen voran massive Bauchschmerzen, Erbrechen und Durchfall, werden als zweithäufigste Symptome beschrieben. Als herausfordernd zeigte sich die Unterscheidung zu einer akuten Appendizitis, nicht selten kam es bereits zu Appendektomien. Die kardiovaskulären Manifestationen umfassen Tachykardien, Hypotension bis hin zu hämodynamischem Schock, Myokarditis und leicht bis moderat reduzierter linksventrikulärer Auswurffraktion (LVEF). Schwere kardiovaskuläre Komplikationen wie Koronardilatation oder -aneurysmen sowie eine LVEF unter 30 % sind selten zu beobachten. Häufiger kommt es zur Ausbildung eines Perikardergusses. Respiratorische Symptome zeigt ungefähr die Hälfte der Patienten, insbesondere Symptome des oberen Respirationstraktes, Atemnot und vereinzelt auch multiple radiologische Infiltrate. Selten wurden thromboembolische Komplikationen berichtet.
In einem Viertel der Fälle waren die Kriterien für ein Kawasaki-Syndrom komplett erfüllt. In einem weiteren Viertel waren die Kriterien im Sinne eines inkompletten Kawasaki-Syndroms nur zum Teil erfüllt (2 oder 3 Kriterien kombiniert mit prolongiertem Fieber, am häufigsten ein polymorphes Exanthem und eine nichtpurulente Konjunktivitis).
Jüngere Kinder präsentieren sich öfters mit gastrointestinaler Symptomatik, Konjunktivitis und Exanthem, Jugendliche dagegen eher mit Halsschmerzen, Dyspnoe, Husten und Brustschmerzen.
Komplikationen
Bei 70–80 % der Patienten mit MIS-C war eine Betreuung auf einer Intensivstation notwendig. Die häufigste Indikation hierfür war eine ausgeprägte Hypotonie mit Notwendigkeit einer Kreislaufunterstützung durch Katecholamine oder einer Beatmung.
Die Mehrheit (98 %) der Patienten erholte sich vollständig. Lediglich bei 7 % der Patienten bestand bei Spitalsentlassung noch eine anhaltende linksventrikuläre Dysfunktion.
Aus internationalen Registern ist bekannt, dass bei bis zu 4 % der MIS-C-Patienten eine extrakorporale Membranoxygenierung (ECMO) notwendig war, mit einer Letalität von bis zu 1,9 %. Die häufigsten Gründe hierfür waren thrombotische Komplikationen im Rahmen der ECMO bzw. kardiales Versagen.
Diagnostik
Aufgrund der fehlenden Erfahrung im Umgang mit diesem neuen Krankheitsbild sowie der beträchtlichen Anzahl an Patienten innerhalb kurzer Zeit an unserer Abteilung wurde ein multidisziplinäres Team von Fachärzten aus dem Gebiet der pädiatrischen Kardiologie, der Rheumatologie und der Intensivmedizin etabliert und auf der Grundlage der bestehenden Empfehlungen eine Abteilungsleitlinie erarbeitet.
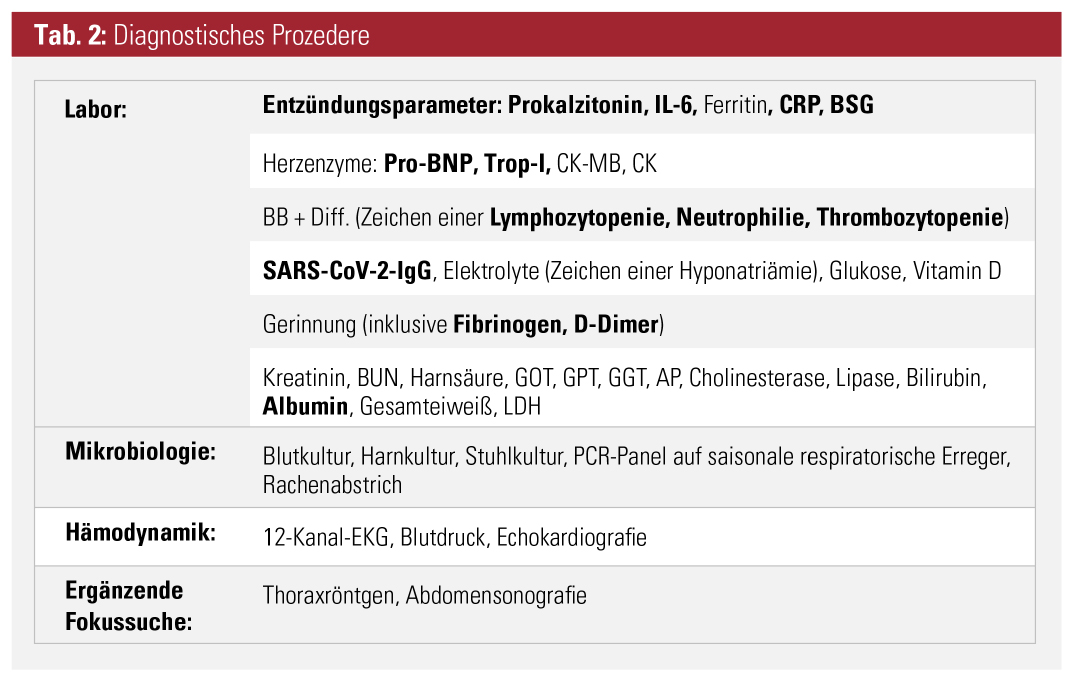
Basierend auf den diagnostischen Kriterien der WHO (Tab. 1) werden bei Verdacht auf MIS-C umfangreiche diagnostische Tests durchgeführt, um die vermutete Diagnose zu bestätigen sowie Ursachen einer bakteriellen Infektion auszuschließen (Tab. 2).
Zu den Auffälligkeiten des Blutbildes zählen typischerweise eine Lymphozytopenie, eine Neutrophilie sowie oft eine Thrombozytopenie bei normalen bis leicht erhöhten Leukozytenzahlen. Bei den Inflammationsmarkern zeigen sich meist massiv erhöhte CRP-, IL-6- und Ferritin-Werte, und im Gerinnungsstatus ein ausgelenktes D-Dimer und Fibrinogen. Weiters bestehen typischerweise (oft massiv) erhöhte Herzenzyme (insbesondere pro-BNP), eine Hyponatriämie sowie eine Hypalbuminämie. Im Vergleich hierzu zeigt sich beim Kawasaki-Syndrom typischerweise ein deutlich niedrigeres CRP, eine deutliche Leukozytose sowie eine Thrombozytose. Als Erhärtung der Diagnose gilt der positive Nachweis der SARS-CoV-2-IgG-Antikörper.
Bisher konnte kein prognostischer Marker gefunden werden, um die Schwere des Verlaufs vorherzusagen. Die Literatur lässt vermuten, dass frühzeitige spezifische Therapie besseres Therapieansprechen sowie weniger Komplikationen verspricht.
Therapie
Die Therapie besteht aus 4 Grundpfeilern und soll zum ehestmöglichen Zeitpunkt nach Diagnosesicherung gestartet werden. Eine intravenöse Immunglobulin-Gabe soll zeitgleich mit einer Hochdosis-Glukokortikoid-Stoßtherapie etabliert werden. Ein verbesserter Outcome bei zeitgleichem Beginn von Immunglobulin und Kortikoid konnte bereits nachgewiesen werden. Zudem wird eine Therapie mit Acetylsalicylsäure in Hochdosis (bzw. in angepasster Dosierung bei Thrombozytopenie) und einer empirisch angesetzten Antibiose (angepasst an die lokale Resistenzlage) hinzugefügt. Ergänzend wird zu einer Thromboseprophylaxe (s. c. LMWH bzw. intravenös bei zentralvenösem Zugang) sowie zu einem Magenschutz im Rahmen der Kortikoidtherapie geraten. Individuelle Anpassungen bzw. ein weiteres Vorgehen bei fehlendem Ansprechen sollte unter Einbeziehung der pädiatrischen Kardiologen und Rheumatologen erfolgen. Dieses Vorgehen würde ggf. einen zweiten Zyklus von Immunoglobulinen oder den Beginn von Biologikatherapien einschließen.
Generell wird empfohlen, Kinder und Jugendliche in einem Krankenhaus mit pädiatrischer Intensivstation im Hintergrund bzw. rascher Transfermöglichkeit zu einer solchen Einheit zu behandeln, da sich der klinische Zustand der Patienten jederzeit schnell verschlechtern kann. Die häufigste Indikation für eine Übernahme auf die Intensivstation ist Kreislaufunterstützung mit Katecholaminen, gefolgt von der Beatmungsnotwendigkeit. Nach der Entlassung aus dem Krankenhaus wird den Patienten für mindestens 3–4 Monate von anstrengender körperlicher Aktivität abgeraten (in Anlehnung an Myokarditis-Richtlinien), und es werden regelmäßige Verlaufskontrollen in unserer kinderkardiologischen Ambulanz etabliert.
Zusammenfassung
Die akute SARS-CoV-2-Infektion verläuft bei Kindern meistens mild oder asymptomatisch. Das MIS-C ist eine neue Krankheit bei Kindern und Jugendlichen und tritt einige Wochen nach einer SARS-CoV-2-Infektion auf. Das Auftreten ist unvorhersehbar und selten, aber die Krankheit kann lebensbedrohlich sein und muss in vielen Fällen auf einer Intensivstation behandelt werden. Derzeit existieren unterschiedliche nationale und internationale Guidelines und Therapieempfehlungen. Über den Zeitpunkt des Therapiebeginns, die Zusammenstellung der Therapie bei welchem Phänotyp, ihre Dosierung und Dauer wird weiterhin diskutiert.
In Österreich führte die zweite Welle der Pandemie im November 2020 zu hohen Infektionsraten. Allein im Folgemonat wurden 8 Kinder bzw. Jugendliche mit MIS-C auf unserer Abteilung für Kinder- und Jugendheilkunde in der Klinik Donaustadt aufgenommen, davon wurden 6 auf der pädiatrischen Intensivstation behandelt. Wir erstellten anhand der bisher verfügbaren Literatur eine interne Leitlinie, die aus der gleichzeitigen Behandlung mit Immunglobulinen, hochdosiertem Glukokortikoid, Acetylsalicylsäure und Antibiotika besteht. Unter dieser Therapie konnten alle unsere Patienten (15 entlassene Patienten zum Zeitpunkt des Erscheinens des Artikels) vollständig erholt entlassen werden.
Da die Infektionszahlen in den letzten Wochen hierzulande neue Höhepunkte erreichten, ist es umso wichtiger, über dieses Krankheitsbild gut informiert zu sein, da mit einem Anstieg der MIS-C-Fälle zu rechnen ist. Bei Kindern und Jugendlichen, seltener bei Neonaten und jungen Erwachsenen, mit persistierendem Fieber und Zeichen einer Hyperinflammation sollen nicht nur Kinderärzte, sondern insbesondere Allgemeinmediziner und Internisten an die wichtige Differenzialdiagnose des MIS-C denken.
Literatur beim Verfasser
© FOTOS: SHUTTERSTOCK.COM