PAH-Therapie im Umbruch – Was versprechen die neuen pharmakologischen Strategien?
Mit dem Einsatz des Prostazyklinanalogons Epoprostenol Mitte der 1990er- Jahre kam es zu einer ersten deutlichen Verringerung der Mortalität.2 Frühere Diagnosestellung und die nachfolgenden Pharmaka führten zu einer verbesserten Leistungsfähigkeit und Lebensqualität sowie einer weiteren Steigerung der Überlebensrate.3 Trotz dieser deutlichen Fortschritte handelt es sich weiterhin um eine – in ihrem Verlauf unterschätzte – maligne Erkrankung.
Heutiger Therapiestandard
Die Therapie der PAH unterscheidet zwischen der klassischen Standardtherapie (supportiv) und einer spezifischen medikamentösen Therapie. Supportive Maßnahmen beinhalten, trotz niedrigen Evidenzgrades, insbesondere eine orale Antikoagulation, Diuretika- vermittelte Vorlastsenkung, Langzeitsauerstofftherapie ab einem pO2 < 60 mmHg, Infektprophylaxe, eine verlässliche Kontrazeption bei Frauen sowie Rehabilitationsmaßnahmen an Spezialzentren.
Die Grundlage der spezifischen Therapie basiert auf den pathophysiologischen Mechanismen der PAH – einem Ungleichgewicht zwischen Vasodilatation und Konstriktion: so steht primär eine überschießende Vasokonstriktion im pulmonalen Gefäßbett durch einem Mangel an Vasodilatatoren (NO, Prostazyklin) und einer verstärkten Freisetzung von Vasokonstriktoren (Endothelin, Sero – tonin) im Vordergrund. Die spezifische Therapie umfasst derzeit den dualen Endothelinrezeptorantagonisten (ERA) Bosentan, den selektiven ERA Ambrisentan, die Phosphodiesterase- 5-Hemmer (Sildenafil, Tadalafil) sowie Prostazyklinanaloga mit unterschiedlicher Halbwertszeit und Applikationsmöglichkeiten (Epoprostenol, Iloprost und Treprostinil). 4 Für eine genau definierte Patientengruppe, die im akuten Vasoreagibilitätstest während des diagnostischen Rechtsherzkatheters positiv reagiert, stellen nach wie vor hochdosierte Kalziumantagonisten die Therapie der ersten Wahl dar.5,6
Der Erfolg einer spezifischen Monotherapie spiegelt sich im gesteigerten Überleben, in der Zunahme der Leistungsfähigkeit, in der Verbesserung der pulmonalen Hämodynamik sowie in der Verlängerung des progredienzfreien Intervalls wider und ist mehrfach durch randomisierte Studien belegt.7–9 Der Therapieerfolg ist vom Zeitpunkt der Diagnose abhängig und individuell unterschiedlich. So zeigt sich in einer retrospektiven Analyse des französischen PAH-Registers ein 2-Jahres-Überleben inzidenter Fälle von nur 69,6 %, wobei das Mortalitätsrisiko mit dem Schweregrad des NHYA-Stadiums, Höhe des rechtsatrialen Drucks, Reduktion des Herzzeitvolumens sowie konsekutiv mit der Einschränkung der 6- Minuten-Gehstrecke ansteigt.3
Neue Therapieziele in der Behandlung der PAH: Die seit der Konsensuskonferenz von Dana Point 2008 geltenden neuen therapeutischen Zielkriterien zur Verbesserung des Überlebens von PAH-Patienten haben zum Ziel, die Patienten aus der „roten“ in die klar 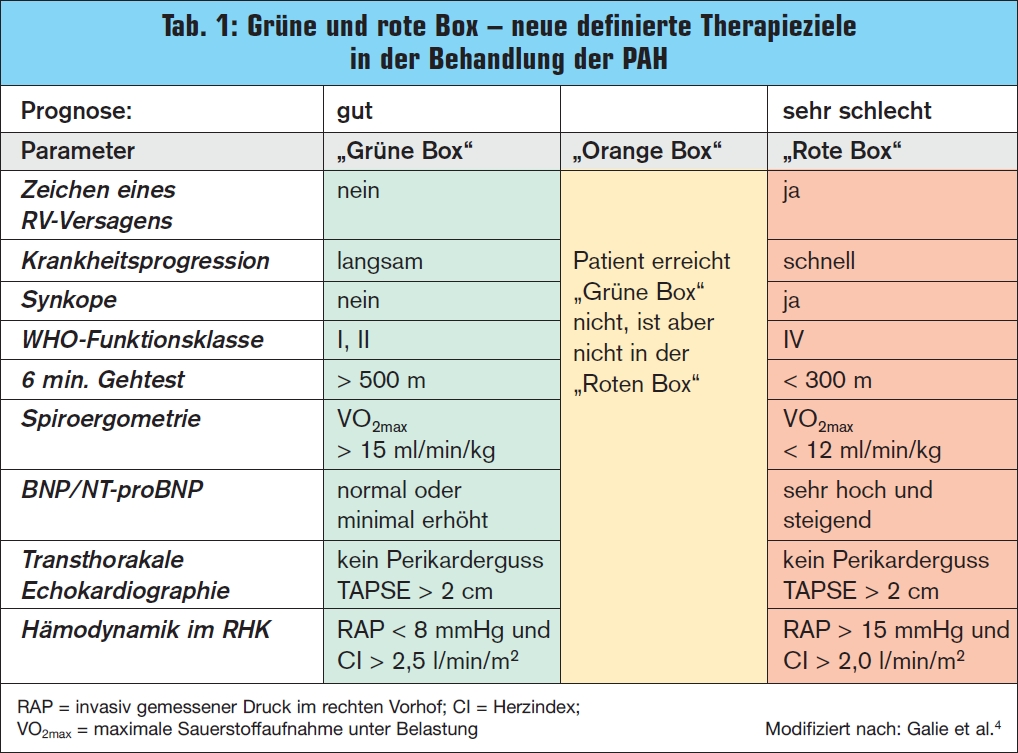 definierte „grüne“ Box zu heben (> Tab. 1).4 Laut den derzeitigen Therapieempfehlungen wird eine „sequenzielle“ Kombinationstherapie mehrerer Substanzklassen bei nicht erreichtem Therapieziel unter einer laufenden Monotherapie empfohlen. Mehrere Studien konnten den positiven Effekt eines derartigen therapeutischen Vorgehens auf die Leis – tungsfähigkeit der betroffenen Patienten und eine Verlängerung der Zeit bis zur klinischen Verschlechterung belegen.9–15 Die derzeit laufende AMBITION-Studie vergleicht die sequenzielle mit der „Upfront“ -Kombinationstherapie. 16
definierte „grüne“ Box zu heben (> Tab. 1).4 Laut den derzeitigen Therapieempfehlungen wird eine „sequenzielle“ Kombinationstherapie mehrerer Substanzklassen bei nicht erreichtem Therapieziel unter einer laufenden Monotherapie empfohlen. Mehrere Studien konnten den positiven Effekt eines derartigen therapeutischen Vorgehens auf die Leis – tungsfähigkeit der betroffenen Patienten und eine Verlängerung der Zeit bis zur klinischen Verschlechterung belegen.9–15 Die derzeit laufende AMBITION-Studie vergleicht die sequenzielle mit der „Upfront“ -Kombinationstherapie. 16
In der Forschungs-Pipeline
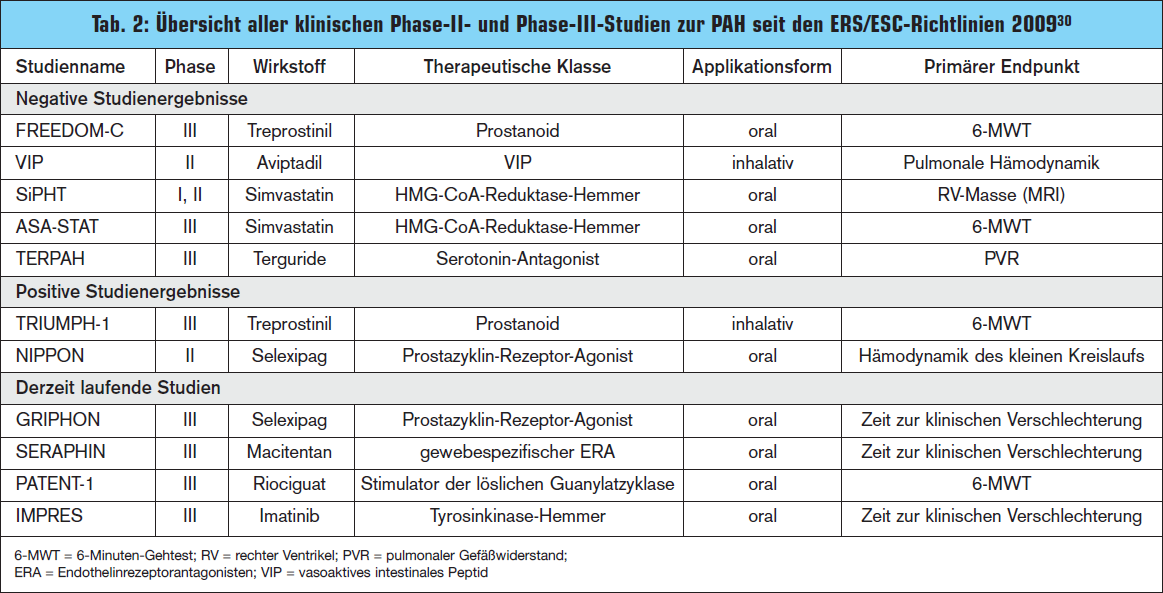
Neue Endothelinrezeptorantagonisten: Anfänglich lag das Interesse der PAH-Forschung in der Entdeckung neuer pathogenetischer Wirkmechanismen. Derzeit wird intensiv an der Verbesserung von Formulierungen bekannter Substanzen gearbeitet. So wurden die bereits verfügbaren Endothelin – rezeptorantagonisten durch die Entwicklung des lipophilen und somit besser gewebegängigen „Macizentan“ weiterentwickelt.17 Diese neue „ERA-Substanz“ agiert ähnlich wie Bosentan als dualer Antagonist an den beiden Endothelinrezeptoren und wird derzeit im Rahmen einer Phase-III-Studie mit 750 Patienten getestet.18
Gefäßerweiterndes Prostazyklin Selexipag: Selexipag ist eine neue Substanz aus der Gruppe der Prostazykline, das als erster oraler, selektiver Prostanoid-IP-Rezeptor-Agonist eine gefäßerweiternde Wirkung zeigt, ohne gleichzeitig die üblicherweise durch Kostimulation anderer Prostanoidrezeptoren auftretenden Nebenwirkungen wie z. B. gastrointestinale Symptome zu haben. Prä – klinische Studien zeigten bereits eine Verbesserung der pulmonalen Hämodynamik im Tiermodell.19 Eine Phase-IIa-Studie mit 43 Patienten berichtete ebenfalls von einem gebesserten pulmonalen Gefäßwiderstand und konsekutiv von einer Steigerung der 6-Minuten- Gehstrecke.20 Eine ergänzende Phase-IIIStudie ist derzeit im Laufen (GRIPHON-Studie). 21
Mit Riociguat auch NO-unabhängige Vasodilatation: Eine weitere Neuheit stellt Riociguat dar. Einerseits sensibilisiert es das Enzym lösliche Guanylatzyklase (sGC) für das körpereigene NO, andererseits wird die sGC direkt stimuliert, was zu einer NOunabhängigen Vasodilatation – anders als bei den Phosphodiesterase-5-Inhibitoren – in der Lungenstrombahn führt.22 Es zeigte sich in einer multizentrischen Phase-II-Studie an 75 Patienten eine verbesserte pulmonale Hämodynamik und Leistungsfähigkeit sowie ein Rückgang der klinischen Symptomatik. Nun werden in zwei weiteren Phase-III-Studien (PATENT und CHEST) die Effekte in der chronisch-thromboembolischen pulmonalen Hypertonie (CTEPH) und PAH evaluiert.23
Hemmung der Angiogenese-Signaltransduktion mit Imatinib: Einen anderen therapeutischen Ansatz macht sich Imatinib, ein kompetitiver und selektiver Blocker der ATP-Bindungsstelle spezifischer Tyrosinkinasen zunutze. Ein Beispiel für einen solchen Tyrosinkinaserezeptor ist jener für PDGF, einem hochpotenten Wachstumsfaktor für Endothel- und glatte Gefäßmuskelzellen. Bei PAHPatienten zeigte sich eine deutliche Erhöhung der PDGF-Rezeptoren im Vergleich zu gesunden Probanden. Durch eine Rezeptorblockade kann der pathophysiologische Umbau der Präkapillaren, welcher zur Fixierung der PAH führt, verhindert und sogar rückgängig gemacht werden („reverse remodelling“). 24–26
Die Arbeitsgruppe um Prof. Schermuly konnte in seinen Arbeiten an einem PAH-Tiermodell erstmalig zeigen, dass eine Rückbildung der stattgefundenen Umbauprozesse in der Gefäßwand mittels Imatinib möglich ist.22, 27 Eine Pilotstudie mit 59 PAH-Patienten (NYHA Klasse II–IV) erbrachte so den ersten Beweis, dass der Einsatz von Imatinib in Kombination mit gängigen spezifischen Medikamenten zu einer verbesserten Hämodynamik führt – besonders bei Patienten mit einem pulmonalen Gefäßwiderstand (PVR) > 800 dynes.s.cm–5 (Post-hoc-Analyse). Der primäre Endpunkt, eine signifikante Verbesserung der 6-Minuten-Gehstrecke gegenüber Placebo, wurde allerdings nicht erreicht.28 Auf Basis dieser Ergebnisse wurde eine multizentrische, randomisierte und placebokontrollierte Phase-III-Studie initiiert (IMPRES-Studie). Im Rahmen des Jahreskongresses der European Respiratory Society 2011 in Ams – terdam wurden die ersten vielversprechenden Ergebnisse präsentiert.29
RESÜMEE: Die Prognose der Patienten mit pulmonaler arterieller Hypertonie wie auch deren Lebensqualität hat sich im letzten Jahrzehnt deutlich verbessert. Neben einer frühen Diagnose werden optimierte Applikationsformen, neue Wirkstoffe und eine rechtzeitige Kombinationstherapie die Situation in der nächsten Dekade wohl weiter dramatisch verbessern.
FACT-BOX
Die Standardtherapie der PAH basiert derzeit auf dem gezielten Einsatz vasodilatatorischer Medikamente kombiniert mit supportiven Maßnahmen. Nach wie vor geht diese Erkrankung jedoch mit einer Minderung der Lebensqualität und einer hohen Mortalitätsrate einher. Der derzeitige Therapieansatz einer Monotherapie und sequenziellen Kombinationstherapie wandelt sich zu einer initialen Kombinationstherapie, nach dem Motto „hit hard and early“. Alternative Therapiewege könnten sich zum einen durch eine verbesserte Formulierung bereits etablierter Medikamente ergeben als auch durch neue Wirkmechanismen, die den Umbauprozessen in den Lungengefäßen entgegenhalten.
1 D’Alonzo et al., Ann Intern Med 1991; 115 (5):343-9
2 Barst R.J. et al., N Engl J Med 1996; 334 (5):296-302
3 Humbert M. et al., Circulation 2010; 122 (2):156-63
4 Galie N. et al., Eur Heart J 2009; 30 (20):2493-537
5 Rich S. et al., N Engl J Med 1992; 327 (2):76-81
6 Sitbon O. et al., Circulation 2005; 111 (23):3105-11
7 Galie N. et al., Eur Heart J 2009; 30 (4):394-403
8 Galie N. et al., Eur Heart J 2010; 31 (17):2080-6
9 Macchia A. et al., Am Heart J 2010; 159 (2):245-57
10 Channick R.N. et al., Lancet 2001; 358 (9288):1119-23
11 Galie N. et al., Circulation. 2009; 119 (22):2894-903
12 Macchia A. et al., Am Heart J 2007; 153 (6):1037-47
13 McLaughlin V.V. et al., J Am Coll Cardiol 2010; 55 (18):1915-22
14 McLaughlin V.V. et al., Am J Respir Crit Care Med 2006; 174 (11):1257-63
15 Simonneau G. et al., Ann Intern Med 2008; 149 (8):521-30
16 AMBITION Study, 2011: http://clinicaltrials.gov/ct2/ show/NCT01178073?term=ambition&rank=1
17 Iglarz M. et al., Pharmacol Exp Ther 2008; 327 (3):736-45
18 Study of ACT-064992 on Morbidity and Mortality in Patients With Symptomatic Pulmonary Arterial Hypertension, 2010: http://clinicaltrials.gov/ct2/ show/NCT00660179?term=SERAPHIN&rank=2
19 Kuwano K. et al., J Pharmacol Exp Ther 2008; 326 (3):691-9
20 Simonneau G. et al., Am J Respir Crit Care Med 2010; 181 (B16):A2515
21 ClinicalTrials.gov UN. ACT-293987 in Pulmonary Arterial Hypertension, 2011
22 Ghofrani H.A. et al., Eur Respir Rev 2009; 18 (111):35-41
23 PATENT-1 Study, 2011: http://clinicaltrials.gov/ct2/ show/NCT00810693?term=BAY63–2521&rank=1
24 Chen S.J. et al., J Appl Physiol 1995; 79 (6):2122-31
25 Schermuly R.T. et al., Am J Respir Crit Care Med 2004; 169 (1):39-45
26 Yen C.H. et al., J Cardiovasc Pharmacol 2010; 55 (6):574-84
27 Schermuly R.T. et al., J Clin Invest 2005; 115 (10):2811-21
28 Ghofrani H.A. et al., Am J Respir Crit Care Med 2010; 182 (9):1171-7
29 IMPRES Study, 2010: http://clinicaltrials.gov/ct2/show/NCT00902174
30 O’Callaghan D.S. et al., Nat Rev Cardiol 2011; 8 (9):526-38