Community-acquired Pneumonia (CAP): Therapieentscheidung in der Praxis
Dass eine antibiotische Therapie die Mortalität der Pneumonie verringert, steht außer Streit. Eine ambulant erworbene Pneumonie (Community-acquired Pneumonia – CAP) in der niedergelassenen Praxis frühzeitig zu erkennen und die richtige Therapiewahl zu treffen ist allerdings nicht immer einfach. Mit Prim. Univ.-Prof. Dr. Otto Burghuber, Otto-Wagner-Spital Wien, Univ.-Prof. DDr. Wolfgang Graninger, Medizinische Universität Wien, Univ.-Prof. Dr. Florian Thalhammer, Medizinische Universität Wien, und Prof. Dr. Tobias Welte, Medizinische Hochschule Hannover, Vorsitzender des CAPNETZ-Stiftungsrats (Kompetenznetz Ambulant Erworbene Pneumonie), widmete sich eine Expertenrunde der Frage nach dem optimalen diagnostischen und therapeutischen Vorgehen im ambulanten Bereich. “Die Pneumonie ist eine gefährliche Erkrankung und wir müssen rechtzeitig entscheiden, wer zu Hause behandelt werden kann, und wer eine stationäre Behandlung benötigt”, sagte Graninger.
Thalhammer bot in seiner nach eigenen Worten “polemischen Einführung zur Pneumonie & Mortalität” einen Überblick über die neuesten Erkenntnisse zum Management der Pneumonie und räumte mit einigen falschen Glaubenssätzen zur Wirksamkeit und dem Nebenwirkungsspektrum von Antibiotika bei Pneumonie auf.
Röntgen bei wem und wann?
Die American Thoracic Society fordert zur Diagnose der Pneumonie den radiologischen Nachweis eines Infiltrats. In der niedergelassenen Praxis scheitert dies jedoch, wie auch die Erregerdiagnostik, immer wieder an den fehlenden Möglichkeiten. Wann auf ein Lungenröntgen nicht verzichtet werden sollte, zeigt > Tab. 1.
Ein Erregernachweis ist keine unbedingte Notwendigkeit für die Therapieentscheidung
in der Praxis, da man die beiden Haupterreger der CAP – Pneumokokken und Mykoplasmen – kennt. Streptococcus pneumoniae ist der wichtigste Erreger der CAP mit der höchsten Sterblichkeit. Dies sei, wie Welte erklärte, nicht auf die Resistenz, sondern auf die Virulenz des Erregers zurückzuführen. Die Pneumokokkenpneumonie kann in der Regel anhand des klinischen Erscheinungsbildes von der Mykoplasmen-Pneumonie differenziert werden, erklärte Welte: “Für eine Infektion mit Mycoplasma pneumoniae sprechen das jüngere Alter des Patienten und ein Erkrankungsbeginn mit Halsschmerzen und Husten, der zwei Tage später von den klinischen Zeichen der Pneumonie gefolgt wird. Die Gefahr einer schweren Mykoplasmen-Pneumonie ist ausgesprochen gering.” Bei Mykoplasmen-Pneumonie sind sowohl Makrolide als auch Fluorchinolone zuverlässig wirksam.
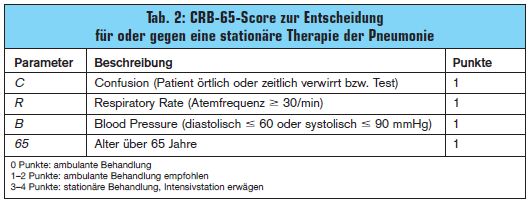
Risikoabschätzung in der Praxis
Wesentliche Risikofaktoren für einen potenziell gefährlichen Verlauf einer Pneumonie sind Komorbiditäten, betonte Burghuber: “Kardiovaskuläre und zerebrovaskuläre Erkrankungen wie auch vorbestehende Lungenerkrankungen müssen daher unbedingt abgefragt werden.” Denn während die Mortalität der Pneumonie bei sonst Gesunden sehr gering ist, steigt sie bei Multimorbiden deutlich an.
Zusätzliche Hilfestellung zur Abschätzung des Risikos und damit der Notwendigkeit für eine stationäre Behandlung bietet der von Thalhammer erläuterte CRB-65-Score (>
Tab. 2). Die 4 Kriterien – Verwirrtheit, Atemfrequenz, Blutdruck und Alter – sind im ambulanten Bereich sehr einfach zu erheben. Einen entscheidenden Stellenwert bei der Entscheidung zwischen ambulanter und stationärer Therapie hat, wie Burghuber betonte, die klinische Beurteilung der Situation: “Diese wird dadurch erleichtert, dass Hausärzte ihre Patienten oft seit vielen Jahren kennen.”
Welte empfahl, den CRB-65-Score gerade in Hinblick auf das Alter differenziert zu interpretieren: “Bei jungen Patienten ist bereits ein einziges CRB-Zeichen klinisch bedeutsam und erfordert besondere Aufmerksamkeit. Ein sonst gesunder 70-Jähriger mit Pneumonie ohne besondere klinische Warnsignale muss andererseits nicht stationär behandelt werden.”
Betalaktame als Mittel der Wahl bei Pneumokokkenpneumonie
Penicillin G i. v. hat die höchste Aktivität gegen Streptococcus pneumoniae und ist im stationären Bereich das Mittel der Wahl. Studienergebnisse unterstützen den Einsatz von
Moxifloxacin bei hospitalisierten CAP-Patienten mit einem CRB-65-Score von 1-2.1 CAPNETZ-Daten weisen auf keinen Anstieg der Fluorchinolonresistenz im Zusammenhang mit dem hohen Fluorochinolonverbrauch hin. Dies könnte durch den
hohen Anteil der Fluorchinolone der 4. Generation wie Moxifloxacin mit verstärkter Aktivität gegen Pneumokokken erklärbar sein.2
Für die ambulante
Therapie der CAP sind, wie Thalhammer ausführte, Amoxicillin (3 x 1,0 g p. o.) und Doxycyclin (1 x 0,2-0,3 g p. o.) Mittel der 1. Wahl, alternativ können Makrolide eingesetzt werden. Er verwies allerdings darauf, dass die Rate makrolidresistenter Pneumokokken in Österreich im vergangenen Jahr bei 10,3% lag: “Man muss also mit Therapieversagern rechnen. Im Gegensatz dazu gibt es so gut wie keine penicillinresistenten Pneumokokken.” Zu bedenken sei auch die geringe Resorptionsrate der oralen Makrolide (Clarithromycin: 50%, Azithromycin: 38%).
Chinolone sind Alternativen bei Betalaktamunverträglichkeit und Mittel der Wahl bei Legionellen. Ciprofloxacin und Ofloxacin haben allerdings keine Wirkung gegen S. pneumoniae, und Levofloxacin muss in hoher Dosis eingesetzt werden. Oralcephalosporine sind wegen fehlender Wirkung gegen S. peumoniae keine Erstlinientherapeutika bei Pneumonie.
Dauer der antibiotischen Therapie
Bei Verdacht auf Pneumonie sollte das Ansprechen auf die antibiotische Therapie nach 48 bis 72 Stunden kontrolliert werden. Bei entsprechender Response reicht eine Behandlungsdauer von 5 bis 7 Tagen, wie eine Metaanalyse der Daten von über 5.100 Patienten zeigt.3 Verbessert sich die Symptomatik innerhalb von 48 bis 72 Stunden nicht, dann sollte auch bei jüngeren Patienten eine Spitalseinweisung erwogen werden. Bei stationär behandelten Patienten mit komplizierten Verläufen ist in der Regel eine antibiotische Therapie über zumindest 10 Tage notwendig.
Zur Frage der Bedeutung der Viruspneumonie hielt Welte fest, dass das eigentliche Risiko einer pulmonalen Virusinfektion von der bakteriellen Superinfektion vor allem von Pneumokokken, aber auch von Staphylokokken ausgehe. Schwere Staphylokokkenpneumonien waren speziell bei jungen Patienten im Rahmen der Schweinegrippeepidemie zu verzeichnen.
Bei Verdacht auf Pneumonie schnell behandeln
Das Ergebnis einer Analyse der Influenza-Mortalität aus den CAPNETZ-Daten deckte sich, so Welte, nicht mit den in den Laienmedien kolportierten hohen Raten. Er berichtete, dass die Mortalität der Pneumonie in Krankenhäusern länderweit sehr unterschiedlich sei. In Österreich und Deutschland liegt die Sterblichkeit bei 12%, in England hingegen bei 20%. Dies dürfte, so Welte, auf den aus Spargründen restriktiveren Zugang zum Gesundheitssystem in England zurückzuführen sein. In England würden mit Betalaktamen zwar die richtigen Antibiotika in der richtigen Dosierung eingesetzt, die Patienten kämen aber mit einigen Tagen Verspätung zum Arzt und einige hätten dann den “point of no
return” schon überschritten. Auch Burghuber betonte die Notwendigkeit, bei Verdacht auf eine Pneumonie rasch zu behandeln: “Junge Patienten ohne Komorbiditäten, die auf der Intensivstation an einer Pneumokokkenpneumonie versterben, wurden in der Regel zu spät behandelt. Bei Verdacht auf Pneumonie sollte unbedingt schnell mit einer Therapie begonnen werden.”
Impfung bei Kindern hocheffektiv
Einen großen Fortschritt im Kampf gegen die Pneumonie bei Kindern brachte der neue Konjugatimpfstoff. Denn die Pneumokokkenpneumonie wird durch Erreger ausgelöst, die den Hals-Rachen-Raum besiedeln und bei Immunschwäche unterschiedlicher Genese invasiv werden. Ältere Pneumokokkenimpfstoffe konnten die Ansiedlung der Erreger nicht verhindern. Seit dem Jahr 2006 stehen Konjugatimpfstoffe zur mukosalen Immunitätsimpfung zur Verfügung, mit denen genau das möglich ist. Wie Welte berichtete, konnte in Deutschland mit diesem Impfstoff die Zahl der invasiven Pneumokokkeninfektionen bei Kindern um den Faktor 25 reduziert werden. Die Infektionen mit Impfstoff-Serotypen wurden fast auf null reduziert. Die Durchimpfungsrate bei Kindern liegt in Deutschland bei 85%. Anders als in Österreich werden in unserem Nachbarland die Kosten für die Kinderimpfung allerdings auch vom Staat übernommen.
* Pneumonie und Mortalität –
Vortrag und Expertendiskussion, 15. 2. 2012, Wien
1) Ewig
S. et al., J Infect 2011; 62 (3):218-225
2) Pletz M.W. et al., Int J Med Microbiol 2011; 301 (1):53-57
3) Dimopoulos G. et al., Drugs 2008; 68(13):1841-54