Statine bei Lebererkrankungen
Statine haben seit jeher einen – aus meiner Sicht nicht nachvollziehbaren – schlechten Ruf. Manche Kollegen und viele Patienten stehen ihnen aufgrund teilweise übertrieben dargestellter oder gar nicht dem Statin geschuldeter Nebenwirkungen skeptisch gegenüber. Dabei sind Statine eine der meistuntersuchten Substanzklassen mit insgesamt sehr hohen Patientenzahlen in Metaanalysen und durchwegs sehr guten Sicherheitsdaten. Dies belegt schlussendlich auch die bereits Jahrzehnte währende praktische Anwendung von Statinen.
Einfluss von LDL-Cholesterin
In Hinblick auf eine Reduktion kardiovaskulärer (CV) Ereignisse durch eine Senkung des LDL-Cholesterins (Low-Density-Lipoprotein-Cholesterin, LDL-C) sprechen die Studienergebnisse mit Statinen allesamt eine eindeutige Sprache. „The lower, the better“ ist zum Leitspruch geworden, will heißen: Je niedriger das LDL-C gesenkt werden kann, desto besser ist das Outcome bzgl. CV-Ereignisse/Folgeereignisse in der Sekundärprävention bei KHK, nach STEMI/NSTEMI, Insult etc., aber auch in der Primärprävention, etwa bei Patienten mit familiärer Hypercholesterinämie. Am Rande sei erwähnt, dass allein eine adäquate LDL-C-Senkung entscheidend ist – womit diese erreicht wird (Statin, PCSK9-Hemmer, Ezetimib etc.), ist nachrangig! Laut den aktuellen ESC/EAS-Guidelines 2019 ist in der Sekundärprävention ein LDL-C < 70 mg/dl gefordert, bei Hochrisikopatienten (z. B. Mehrfachereignisse oder Ereignisse in 2 bzw. 3 Stromgebieten) sogar < 55 mg/dl. Diese Ziele sind, abgesehen von den PCSK9-Hemmern, nur mit Power-Statinen wie Atorvastatin und Rosuvastatin in höheren Dosierungen zu erreichen. Dies birgt ein gewisses Nebenwirkungspotenzial in sich, denn je potenter ein Statin in der Wirkung und je höher die Dosis, desto ausgeprägter können Nebenwirkungen, zum Beispiel Transaminasenerhöhungen, sein.
Transaminasenerhöhungen: Eine Metaanalyse1 zeigte bei über 100.000 Patienten, die mit Atorvastatin 10–80 mg, Fluvastatin 80 mg, Pravastatin 40 mg und Simvastatin 20–80 mg therapiert wurden, den klaren Zusammenhang zwischen High-Dose-Statin und Lebertransaminasenerhöhung. Eklatant unterschiedlich war der Anstieg der Transaminasen zwischen Atorvastatin 10 mg und 80 mg. Der Effekt auf die LDL-C-Senkung korrelierte nicht mit dem Ausmaß der Transaminasenerhöhung. In einer Arbeit von E. Leitersdorf2 konnte eine klare Korrelation zwischen Transaminasenerhöhung und Steigerung von Simvastatin von 40 mg auf 80 mg beobachtet werden, wonach es von da an als obsolet anzusehen ist, Simvastatin mit 80 mg zu geben. Weiters war auch der Titrationssprung von Atorvastatin 40 mg auf 80 mg mit einer signifikanten Erhöhung der Aminotransferase verbunden. Dennoch sollte bei Leberfermenterhöhung unter Statintherapie immer auch nach anderen Ursachen gefahndet werden.
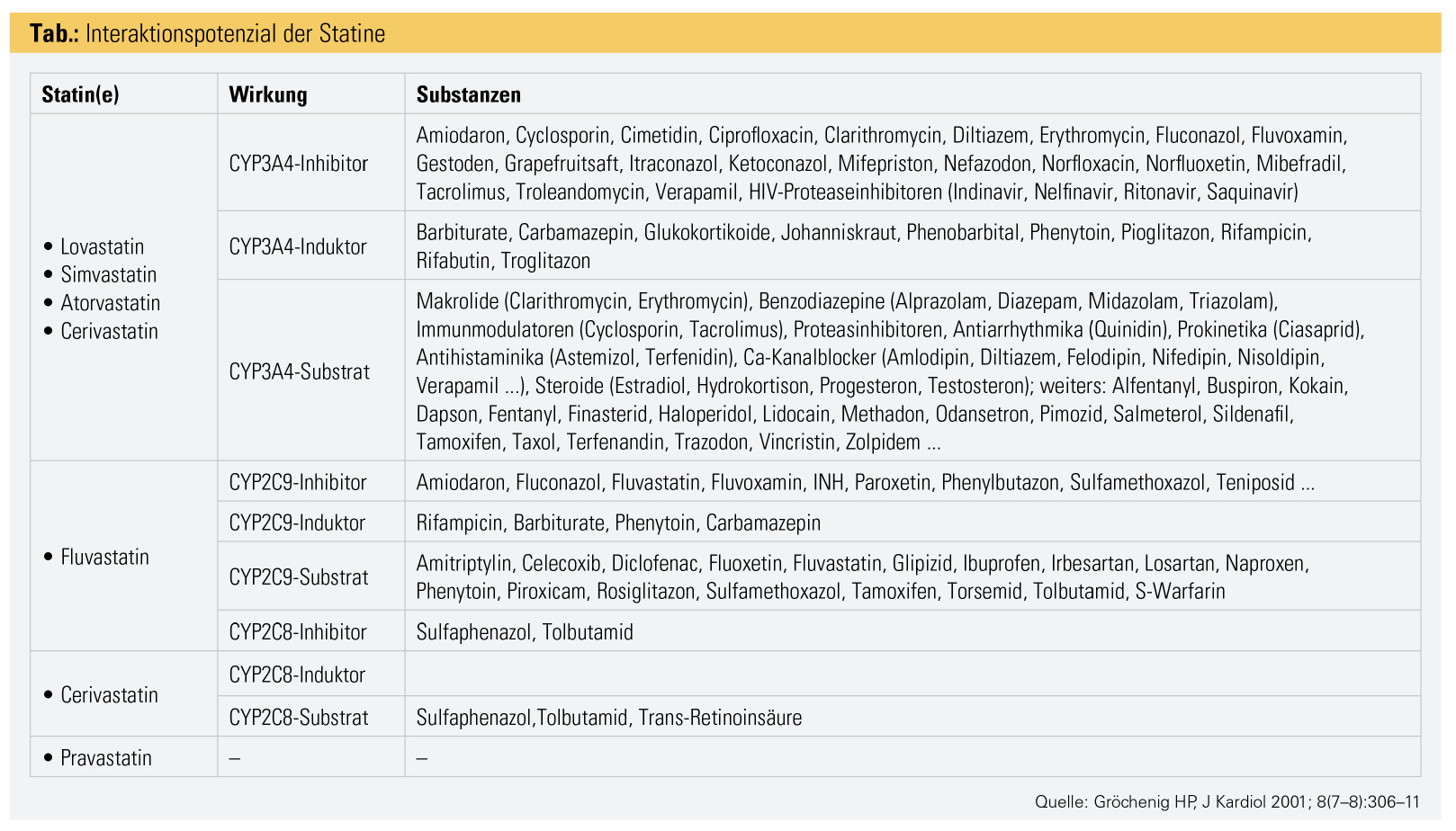
Interaktionen
Ein anderer Grund für Leberfermenterhöhung unter Statinen ist ihr Interaktionspotenzial (Tab.). Statine werden über das Cytochrom-P450-(CYP-)System abgebaut; Atorvastatin und Simvastatin über das gängige CYP3A4, worüber viele andere Medikamente auch metabolisiert werden und womit ein erhöhtes Interaktionspotenzial vorliegt; Fluvastatin und Rosuvastatin, aber auch Pitavastatin werden über CYP2C9 abgebaut, wo es deutlich seltener zu Medikamenteninteraktionen kommt und womit bei Polypharmazie speziell Rosuvastatin der Vorzug zu geben ist. Pravastatin wird nicht über CYP450 metabolisiert und kann damit als Reservepräparat (weil gering wirksam) in der Therapie von Dyslipidämien nach Organtransplantationen unter immunsuppressiver Therapie eingesetzt werden.
An Assessment by the Statin Liver Safety Task Force
Im Journal of Clinical Lipidology wurde ein Update der Statin Liver Safety Task Force (Expertenpanel von Hepatologen) veröffentlicht3, worin einige brennende Fragen zu diesem Thema konklusiv beantwortet wurden. Demnach besteht eine Assoziation zwischen Statintherapie und Transaminasenerhöhung als Klasseeffekt, welcher aber transient ist und sich nach dem Absetzen des Statins rückläufig zeigt und nicht als dauerhafter Leberschaden zu werten ist. In einer Langzeittherapie mit Statinen sind regelmäßige Kontrollen der Leberfunktion nicht empfohlen. Die Inzidenz für Leberversagen oder Tod im Rahmen eines Leberversagen unter Statintherapie ist nicht erhöht. Kompensierte Leberzirrhose, NAFLD und NASH sind keine Kontraindikationen für eine Statintherapie, die dekompensierte Leberzirrhose hingegen sehr wohl. Statine können bei NAFLD, nach Lebertransplantation und auch bei Autoimmunhepatitis eingesetzt werden; vor Beginn der Therapie sollte eine Kontrolle der Leberparameter erfolgen.
Ein Absetzen der Statintherapie und Fahnden nach anderen Ursachen der Leberfermenterhöhung sollte bei Transaminasenanstieg auf das über 3-Fache der oberen Norm erfolgen, darunter und bei normaler CK ist die wahrscheinlichste Diagnose die NAFLD und bedingt kein automatisches Absetzen des Statins. Diese Empfehlung deckt sich auch mit der S2k-Leitlinie Nichtalkoholische Fettlebererkrankungen, denn im Umkehrschluss sind Fettstoffwechselstörungen wie Abetalipoproteinämien, Hypobetalipoproteinämien, familiäre Hyperlipidämien, Glykogenosen oder Cholesterolesterspeichererkrankungen (CESD) oft Ursache der NAFLD.
Statine bei NAFLD und ihre Effekte auf die Leberhistologie
Bislang haben Studien eindrucksvolle Ergebnisse für den Nutzen einer Statintherapie bei NAFLD gezeigt.
Atorvastatin, Simvastatin, Pravastatin und Rosuvastatin wurden in Studien bei NAFLD/NASH getestet. Vor und nach einem Follow-up von 6–12 Monaten der Statineinnahme wurden Ultraschalluntersuchungen der Leber, teilweise CT und Leberbiopsien durchgeführt. Unter Pravastatin und Atorvastatin wurde eine Verbesserung im Steatosegrad und in der Inflammation beobachtet, bei Rosuvastatin konnte zusätzlich eine Verbesserung im Fibrosegrad gezeigt werden. Auch andere Studien mit Rosuvastatin zeigen einen positiven Effekt4: 20 Patienten mit NASH wurden 12 Monate mit Rosuvastatin 10 mg therapiert und jeweils zu Beginn und am Ende leberbiopsiert. In der Kontrollbiopsie zeigten 19 Patienten eine komplette Remission der NASH. Histologische Beurteilungskriterien waren der NAFLD Activity Score, lobuläre Inflammation, Fibrose und hepatozelluläres Ballooning. 2 Pathologen mussten unabhängig voneinander die Biopsate beurteilen. Ein Patient war Non-Responder, er hatte Alkohol konsumiert und die Medikation nicht eingenommen.
Statine bei spezifischen Lebererkrankungen
In einer Metaanalyse von Adverse-Event-Datenbanken aus 27 randomisierten klinischen Studien mit insgesamt 174.000 Patienten wurde die Statintherapie bei Hepatitis C evaluiert.5 Es zeigte sich eine weniger starke Auslenkung in schweren Verläufen und ein besserer Abfall der Transaminasen bei Patienten mit chronischer Hepatitis C unter Statintherapie sowie ein besseres Ansprechen der antiviralen Therapie im Vergleich zu jenen ohne Statin. Bei primär biliärer Zirrhose wurden bei Hyperlipidämie Statine eingesetzt, es traten keine signifikant vermehrten Adverse Events in Bezug auf die Leberfunktion auf. Statin-Ezetimib-Kombinationen hatten über 3 Jahre Follow-up ebenfalls keinen negativen Effekt auf den ALT-Verlauf. Auch für die Autoimmunhepatitis gibt es keine negativen Effekte unter Statintherapie, solange die Syntheseleistung der Leber gewährleitet ist. Berichte über eine statininduzierte autoimmune Hepatitis sind wahrscheinlich idiosynkratisch. Nach Lebertransplantation kann eine immunsuppressive Therapie eine massive, therapiepflichtige Hypercholesterinämie oder, wie durch unzählige klinische Beispiele bestätigt, insbesondere kombinierte Hyperlipidämie verursachen. Auch hier gilt die Statintherapie als sicher, empfohlen werden aber nur Statine mit alternativem Metabolismus (keine CYP3A4-Substrate), diese wären, no
chmals erwähnt, Rosuvastatin, Pravastatin und Fluvastatin, um Interaktionen mit Immunsuppressiva zu vermeiden.
In mehreren Studien wurde ein Effekt einer Statintherapie auf die Inzidenz und Prognose des hepatozellulären Karzinoms (HCC) untersucht. In einer Metaanalyse von 5 Observationsstudien konnte eine relative Risikoreduktion von 37 % bzw. 42 % mit Atorvastatin und Fluvastatin gezeigt werden. Eine weitere Metaanalyse von 10 Studien (observational und randomized) zeigte den Zusammenhang von Statintherapie und reduziertem Risiko für HCC bei mehr als 1.450.000 Patienten in westlicher und asiatischer Population. Zwei weitere kleine Studien aus Japan6 und Deutschland7 untersuchten den Effekt von Statinen in 836 bzw. 1317 Patienten mit HCC, die sich einer Chemoembolisation unterziehen mussten. Überlebensraten waren unter Statin höher (18 vs. 9 Monate6 und 20,9 vs. 12,0 Monate7) im Vergleich zur Nicht-Statin-Gruppe.